| Navigation |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
|
|
| |
La quantité de matière
La quantité de matière (n), est proportionnelle au nombre N d'entités contenus dans un échantillon donné.
L'unité choisie est la mole, de symbole mol.
Un échantillon de carbone constitué uniquement d'isotopes 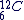 et de masse exactement égale à 12g contient une quantité de matière exactement égale à 1 mol. et de masse exactement égale à 12g contient une quantité de matière exactement égale à 1 mol.
C'est un nombre d'entités par mole, (donc exprimé en 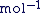 ). ).
Ce nombre est appellé Constante d'Avogadro (Na), en hommage à Amedeo Avogadro pour ses travaux.
La relation entre la quantité de matière et le nombre d'entité d'un échantillon est :
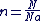 
Quantité de matière d'un échantillon solide ou liquide
Masse molaire
La masse molaire d'une espèce chimique, M, est la masse d'une mole de cette espèce.
M est exprimé en 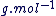 . .
La masse molaire atomique d'un élément est la masse d'une mole d'atome de cet élément (isotopes inclus).
La masse molaire moléculaire d'une molécule est la masse d'une mole de cette molécule.
Elle est égale à la somme des masses molaires atomiques qui composent la molécule.
La masse molaire ionique d'un ion est la masse d'une mole d'ion.
Détermination de quantité de matière par pesée ou mesure du volume
Quand on connait la masse (m), d'un échantillon de masse molaire (M), sa quantité de matière est donné par la relation suivante :
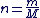 
Connaissant le volume d'une espèce chimique, (V) et sa masse volumique (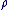 ). ).
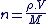 
Quantité de matière d'un échantillon gazeux
Volume molaire
Le volume molaire Vm d'un gaz est le volume occupé par une mole de ce gaz.
Vm est donnée en 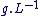
En connaissant, le volume d'un échantillon gazeux, on peut connaitre sa quantité de matière :
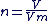 
Equation d'état des gaz parfaits
C'est la relation entre la pression P, le volume V et la température T d'un gaz pour une quantité de matière n.
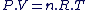 
T(en K) = T(en °C) + 273.15
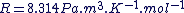
Quantité de matière d'un soluté moléculaire
La concentration molaire d'un soluté est défini comme le rapport entre la quantité de matière n de soluté et le volume V de solution homogène.
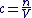 
Donc 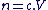
Solides ioniques cristallins
Structure
Certains composés solides présentent des formes régulières tels que le chlorure de sodium ou le sucre.
C'est René-Just Haüy qui fut le premier à penser que la régularité des formes du cristal était la conséquence d'un arrangement des composants du cristal (atomes, ions ou molécules).
Un solide ionique est un solide composé d'ions dans un solide ionique cristallin (cristal ionique), les anions et les cations sont disposés de façon ordonnée dans l'espace.
On peut représenter le cristal ionique sous différente manières : le modèle compact, le modèle éclaté et le modèle macroscopique.
 |
 |
 |
| Modèle compact |
Modèle éclaté |
Modèle macroscopique |
Cohésion du cristal ionique
Dans un solide ionique, les ions présents exercent les uns sur les autres des forces d'interaction électrostatique (interaction coulombienne). Si les deux charges sont de même signe alors elles vont se repousser et si les charges sont de signes contraires alors les charges vont s'attirer. La valeur de la force d'attraction/répulsion est plus forte (respectivement plus faible) si les ions sont plus proches (respectivement plus éloignés).
L'ensemble des interactions coulombiennes entretient la cohésion des ions dans le solide ionique.
Polarité d'une molécule
Notion d'électronégativité
Une liaison covalente entre deux atomes est la mise en commun d'un électron de chaque atome.
Les atomes qui sont engagés dans la liaison covalente n'attirent pas les électrons de la liaison covalente avec la même force.
Plus un atome est électronégatif, plus il aura tendance à attirer les électrons de la liaison covalente dans laquelle il est engagé.
En regardant le tableau périodique, l'électronégativité augmente de bas en haut et de gauche à droite.
Exemple : Chlorure d'hydrogène dont la liaison covalente est attirée par l'ion chlorure :

Molécule diatomique
On attribue une charge partielle 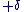 à l'atome le moins électronégatif et une charge partielle à l'atome le moins électronégatif et une charge partielle 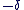 à l'atome le plus électronégatif. à l'atome le plus électronégatif.
La molécule est polaire, c'est un dipôle.
Dans le cas où les 2 atomes sont les mêmes (ex : dihydrogène), la molécule est apolaire.
Molécule polyatomique
On cherche le barycentre de 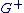 de toutes les charges de toutes les charges 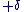 et le barycentre et le barycentre 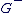 de toutes les charges négatives de toutes les charges négatives 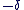 . .
 Si Si 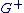 et et 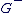 sont confondus alors la molécule est apolaire. sont confondus alors la molécule est apolaire.
 Si Si 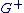 et et 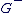 ne sont pas confondus alors la molécule est polaire. ne sont pas confondus alors la molécule est polaire.
Attention : La polarité d'une molécule est aussi due à sa géométrie (si la molécule est coudée ou linéaire etc.).
Les solutions aqueuses électrolytiques
Une solution est par définition, obtenue par dissolution d'un soluté dans un solvant.
Une solution électrolytique contient des ions et conduit le courant électrique.
La dissolution d'un électrolyte dans l'eau se déroule en 3 étapes :
 1. La dissociation 1. La dissociation
Les molécules d'eau affaiblissent les interactions entre les ions du cristal ionique qui se désagrège.
 2. La solvatation 2. La solvatation
Les ions s'entourent de molécules d'eau. Quand un ion est hydraté, on lui rajoute (aq) à la fin de la formule.
 3. La dispersion 3. La dispersion
Les ions hydratés se dispersent dans la solution qui devient homogène.
Saturation
La quantité maximale de soluté que l'on peut dissoudre dans un solvant est appelée solubilité de ce soluté. Celle-ci dépend du solvant et de la température.
Quand on dépasse la limite maximale, la solution est dite saturée.
Exemple : La solubilité du NaCl est de 36g par 100g d'eau.
Cas du proton
L'ion hydrogène est constitué d'un proton. On l'appelle couramment proton.
Une molécule d'eau peut former une liaison covalente avec le proton pour former le cation oxonium 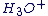 . .
Equation chimique de la dissolution
La dissolution d'un électrolyte est une transformation chimique qui se modélise par l'équation de la réaction chimique.
Exemples :
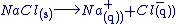
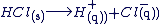

Concentrations
Concentration de soluté apporté
La concentration molaire de soluté apporté est définie par la relation suivante :
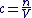 avec avec 
Concentrations des espèces présentes en solution
La concentration d'une espèce X présente en solution est donnée par la relation suivante :
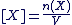 avec avec 
Dilution
Quand on effectue une dilution, on peut utiliser cette relation (vu en seconde) :
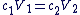
Cette relation peut aussi s'écrire, grâce aux concentrations en espèces dissoutes :
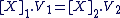
|
|
|
|
|
|
| |
nombre de visiteurs venus 813942 visiteurs (2679887 hits) Ici!
Tracked by Histats.com
$value) {
if ($param == 'client') {
google_append_url($google_ad_url, $param,
'ca-mb-' . $GLOBALS['google'][$param]);
} else if (strpos($param, 'color_') === 0) {
google_append_color($google_ad_url, $param);
} else if ((strpos($param, 'host') === 0)
|| (strpos($param, 'url') === 0)) {
google_append_url($google_ad_url, $param,
$google_scheme . $GLOBALS['google'][$param]);
} else {
google_append_globals($google_ad_url, $param);
}
}
google_append_url($google_ad_url, 'dt',
round(1000 * array_sum(explode(' ', microtime()))));
return $google_ad_url;
}
$google_ad_handle = @fopen(google_get_ad_url(), 'r');
if ($google_ad_handle) {
while (!feof($google_ad_handle)) {
echo fread($google_ad_handle, 8192);
}
fclose($google_ad_handle);
}
?>
|
|
|
|
|
|
|
|