Sommaire du cours de Paléontologie.
Fossiles et monde vivant.
I Définition de la paléontologie.La paléontologie est la science qui étudie les êtres ayant vécu autrefois et dont les fossiles sont conservés dans les sédiments.
II Les fossiles.
A Les restes.
Ce sont les restes des animaux morts et, exceptionnellement, les corps en totalité. Généralement, on a uniquement les parties dures (coquilles, valves, carapaces, tests, squelettes, os, dents). Parfois, on peut avoir des moulages de l’ensemble de l’animal (moules internes, externes ou les deux à la fois).
B Les traces.
Les traces représentent l’activité biologique (déplacement, piste, empreinte, terrier). On peut trouver des perforations dues à la nutrition (cas des éponges et des gastéropodes). Parfois, ce sont des perforations du calcaire. On peut aussi trouver des traces d’excréments (des coprolithes).
III La fossilisation.
A Condition de la fossilisation.
La fossilisation est un phénomène exceptionnel qui nécessite des conditions très favorables.
Pour qu’il y ait fossilisation, il faut que le corps soit à l’abri des prédateurs, des bactéries aérobies (des processus d’oxydation).
Les milieux les plus propices sont les sédiments à granulométrie fine. Les meilleurs sédiments sont les boues calcaires et argileuses mais aussi, les cendres volcaniques. En général, les milieux de fossilisation sont marins. Les milieux terrestres sont peu propices.
B Evolution après la mort.
Après la mort, les parties molles se décomposent. De même pour la trame organique qui est associée aux parties minéralisées. En conséquences, les parties dures deviennent poreuses et cassantes. Elles peuvent suivre trois évolutions distinctes :
- Conservation sans modifications importantes. C’est un cas exceptionnel.
- Dissolution complète (cas le plus fréquent). Il peut rester des moules internes ou externes de l’animal.
- Remplacement du minéral initial par un autre minéral  c’est l’épigénie (ou pseudomorphose). Le plus souvent, on trouve :
c’est l’épigénie (ou pseudomorphose). Le plus souvent, on trouve :
• La calcite : elle est rare dans la coquille des animaux. Elle n’est quasiment que chez les échinodermes et brachiopodes. Chez les autres animaux, on a de l’aragonite. Ce dernier minéral est instable et, à l’état fossile, elle donnera de la calcite.
• La calcédoine (SiO2) : elle entraîne la silicification des végétaux et des coquilles d’invertébrés.
• La pyrite (FeS2) : elle a une couleur jaunâtre.
• L’apatite (phosphate de calcium) : ce minéral intervient dans le cas des os et des dents. IV Monde vivant et peuplements fossiles.La fossilisation nécessite trois types de conditions favorables :
- Existence de parties dures dans l’organisme.
- Aptitude de ces parties dures à être conservées par l’épigénie.
- Conditions des milieux favorables à la fossilisation.
La paléontologie est loin d’avoir découvert tous les fossiles conservés dans les sédiments. Il y a une très forte distorsion entre le monde vivant et les peuplements fossiles.
A Echelle d’un groupe organique déterminé.
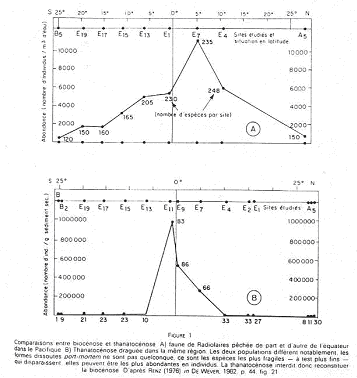
On compare sur ces documents le nombre d’individus vivants et le nombre d’espèces péchées dans le plancton avec les sédiments actuels situés sur le même site.  Il y a une perte considérable en espèces et en individus, ainsi qu’une distorsion très importante.
Il y a une perte considérable en espèces et en individus, ainsi qu’une distorsion très importante.
B Echelle de la vie.
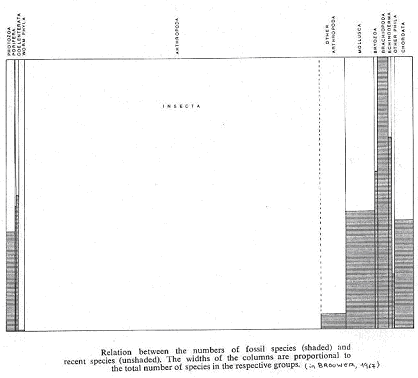
Les individus sans squelette en milieu marin sont rarement fossilisés et encore moins sur le milieu continental. Les animaux bien connus sont ceux à squelette ou à coquille.
Le cas des mollusques : il y a plus d’espèces actuelles que d’espèces fossiles. Toutefois, ces mollusques sont connus depuis plus de 500 millions d’années : déformation.
 Résultats : Les fossiles ne donnent qu’une image très fragmentaire et déformée de la vie.
Résultats : Les fossiles ne donnent qu’une image très fragmentaire et déformée de la vie.
Actuellement, on compte trois millions d’espèces animales et végétales connues. Le nombre total d’espèces est estimé à 4,5 millions. Hors, seules 150 000 espèces fossiles ont été décrites ; soit, 3% des espèces connues actuellement et 3,3% des vivantes actuellement.
En 540 millions d’années, on estime qu’un milliard d’espèces a vécu sur terre et que 10 millions étaient fossilisables.
 Les fossiles connus représentent 1/660ème des espèces animales et végétales ayant vécu sur Terre et 1/66ème des espèces fossilisables.
Les fossiles connus représentent 1/660ème des espèces animales et végétales ayant vécu sur Terre et 1/66ème des espèces fossilisables.
V L’espèce en paléontologie.
Les espèces sont nommées de manière identique à la biologie animale ou à la biologie végétale.
A Espèces paléontologiques et espèces actuelles.
L’espèce est l’unité de base de la classification mais l’espèce paléontologique diffère des espèces actuelles par divers aspects :
- Le paléontologiste travaille sur du matériel mort où les expérimentations sont impossibles.
- Les restes fossiles sont fragmentaires (parties molles sont inconnues). Malgré tout, il y a corrélation étroite entre divers caractères d’une même espèce. Donc, une espèce fossile peut être identifiée par une partie seulement de l’organisme.
- Les spécimens fossiles sont plus rares que les spécimens actuels. Les collections d’individus sont peu abondantes et on n’est jamais sûr qu’elles soient contemporaines : il y a une difficulté pour étudier une population à un moment donné.
- Une espèce paléontologique est décrite, non seulement avec ses caractères à un moment donné mais aussi avec son évolution au cours des temps. On doit délimiter des espèces à un moment donné mais aussi au cours des temps.
B Définition de l’espèce paléontologique.
1 Espèce typologique.
C’est la conception la plus ancienne. L’espèce est définie à partir des caractères d’un individu tenu pour représentatif : c’est le « type ». Il est déposé dans une collection puis décrit et figuré. Tout individu à morphologie semblable au « type » ou qui s’en rapproche suffisamment sera classée dans la même espèce :  le critère est la ressemblance.
le critère est la ressemblance.
Exemple : Les alvéolines de l’éocène.
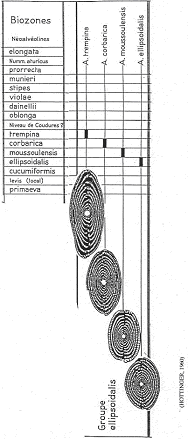
On a diverses lignées et pour ellipsoïdalis, quatre espèces se succèdent dans le temps. Elles ont été décrites en 1960 par un suisse (Hottinguer).
Espèce 1 : Ellipsoïdalis (1883-Egypte) 6 millions d’années. Description : coquille de petite taille, peu allongée, spire serrée et petite loge initiale.
Espèce 2 : Moussoulensis (1960-près de Carcassonne, par Hottinguer). Description : un peu plus grande, un peu plus allongée (pôles plus aplatis), spire plus lâche, loge initiale de taille moyenne.
Espèce 3 : Corbarica (1960-dans les corbières, par Hottinguer). Description : encore plus grande, plus allongée, pôles pointus, spire serrée, loge initiale assez grande.
Espèce 4 : Trempina (1960-dans les Pyrénées, par Hottinguer). Description : plus allongée, plus grande, grande loge initiale.
Chacune de ces espèces est définie par un type qui sert de référence pour les déterminations.
Cette conception de l’espèce présente deux inconvénients majeurs :
- Le « type » : c’est le premier spécimen trouvé ou le mieux conservé parmi les premiers trouvés. Il ne peut pas être parfaitement représentatif des caractères moyens de l’espèce.
- Dans une espèce, tous les individus ne sont pas identiques et les formes plus ou moins éloignées du « type » ne sont pas toujours prises en compte pour la définition de l’espèce. L’appréciation des limites de l’espèce est très subjective.
Dans le Minervois, on constate que deux espèces peuvent cohabiter dans le même niveau.
On a des intermédiaires entre les espèces. A t’on deux espèces qui coexistent ou avons-nous des variations dans une même espèce.
2 L’espèce biologique.
La biologie moderne donne cette définition. Magr : « L’espèce est constituée par les groupes de population naturelle réellement ou potentiellement interféconds et isolés quand à la reproduction de tout autre groupe semblable. ». On a ici un critère de descendance.
Notion d’interfécondité : on peut appréhender cette notion d’interfécondité par l’analyse des populations. En effet, dans la mesure où il y a une continuité morphologique dans une population, on peut en déduire qu’il y a eu des croisements, donc interfécondité.
L’espèce est définie à partir d’un groupe d’individus : « la série type ». On prend un représentant moyen : « l’holotype ». Les autres sont les « paratypes ».
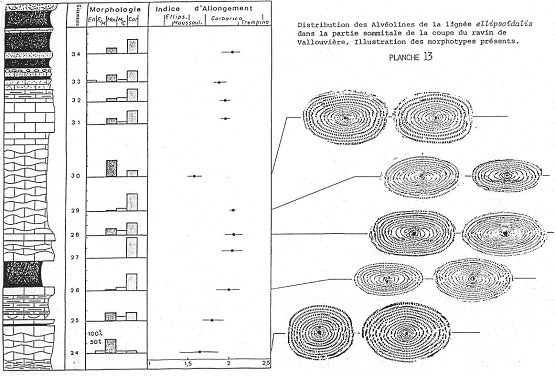
Pour créer une espèce, il faut faire une étude statistique de population à partir de données biométriques. Si la population est hétérogène, l’analyse fera apparaître des discontinuités. Si la population est homogène, on a alors une distribution Gaussienne. Si elle ne l’est pas, c’est qu’il y a plusieurs espèces.
Réalisation d’histogrammes de répartition de population en fonction de l’indice d’allongement :
Quand le nombre d’individus est suffisant, les histogrammes indiquent une population homogène.  Dans chaque gisement, la population est homogène et ne renferme qu’une espèce.
Dans chaque gisement, la population est homogène et ne renferme qu’une espèce.
Dans la partie inférieure : la moyenne correspond à moussoulensis mais avec aux deux extrémités de la population, des représentants d’ellipsoïdalis et de corbarica.
Dans la partie supérieure : la moyenne correspond généralement à corbarica mais avec, aux extrémités, des représentants de moussoulensis et de trempina.
 Finalement, ellipsoïdalis, moussoulensis, corbarica et trempina sont des formes différentes d’une même espèce. De la base au sommet de la courbe, on passe d’une population à moussoulensis dominante à une population corbarica dominante. Toutefois, des croisements se produisent toujours entre ces formes. Dans le détail, les proportions des deux formes fluctuent en fonction des conditions du milieu.
Finalement, ellipsoïdalis, moussoulensis, corbarica et trempina sont des formes différentes d’une même espèce. De la base au sommet de la courbe, on passe d’une population à moussoulensis dominante à une population corbarica dominante. Toutefois, des croisements se produisent toujours entre ces formes. Dans le détail, les proportions des deux formes fluctuent en fonction des conditions du milieu.
 On a donc une seule espèce biologique qui évolue par un remplacement d’individus à caractères archaïques par des individus à caractères plus évolués : c’est une chronoespèce.
On a donc une seule espèce biologique qui évolue par un remplacement d’individus à caractères archaïques par des individus à caractères plus évolués : c’est une chronoespèce.
Cette conception biologique de l’espèce est plus objective mais nécessite la mise en œuvre de méthodes statistiques qui ne sont pas toujours applicables en paléontologie :
- Le nombre d’individus collectés est souvent insuffisant.
- Les individus collectés dans un même gisement ne parviennent pas toujours d’une population naturelle et ne découlent pratiquement jamais d’une même génération.
 En paléontologie, l’espèce biologique est un idéal à atteindre mais on ne peut souvent définir qu’une espèce typologique.
En paléontologie, l’espèce biologique est un idéal à atteindre mais on ne peut souvent définir qu’une espèce typologique.
C La validité de l’espèce paléontologique.
Quelle que soit la démarche utilisée (typologique ou biologique), l’espèce paléontologique est uniquement fondée sur des critères morphologiques. Or, ces critères sont totalement insuffisants, comme le montre trois phénomènes :
- Le polymorphisme : c’est la coexistence dans une même population d’individus interféconds mais morphologiquement différents.
- Le polytypisme : c’est l’existence dans une même espèce de populations morphologiquement différentes (« races » géographiques).
- Les espèces jumelles : ce sont des ensembles morphologiquement identiques mais séparés génétiquement (drosophiles).
Dans le cas où il y a polymorphisme ou polytypisme, s’il y a ségrégation morphologique, il se produira au cours des temps une ségrégation génétique.
Dans le cas des espèces jumelles, il y a d’abord séparation génétique puis, avec le temps, séparation morphologique.
Il y a un décalage pour la distinction des espèces entre la paléontologie et la biologie. (en avance : polymorphisme ; en retard : espèces jumelles).
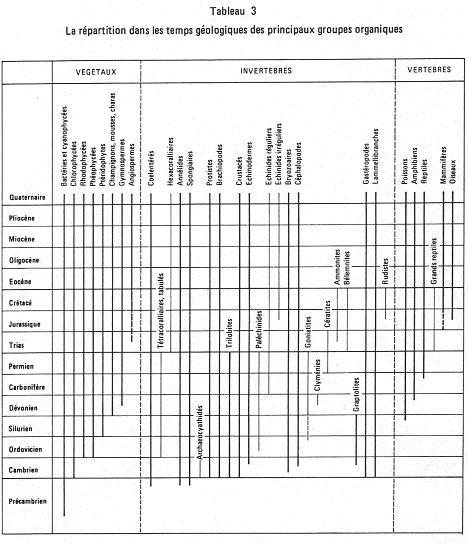
Histoire générale de la biosphère.
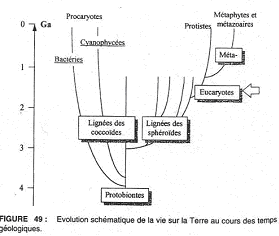
I Précambrien et première manifestation de la vie.
A Conditions chimiques du précambrien.
L’atmosphère primitive s’est formée après l’accrétion de la Terre et un dégazage du manteau (-4,6 milliards d’années).
Composition de cette atmosphère : H2O (vapeur), H2, CH4, NH3, H2S, SO2, CO2, N2. L’O2 libre est absent. Il n’y a donc pas de couche d’ozone.
Cette atmosphère a été déduite des inclusions gazeuses que l’on a retrouvées dans des diamants ou dans des cristaux de sels. L’océan : il résulterait de la condensation de toute l’eau au cours du refroidissement de la Terre (mêmes éléments chimiques que l’atmosphère plus des sels solubles dont des chlorures des sulfates et du phosphate qui proviendraient de la croûte terrestre. On obtient donc des eaux salées, chaudes et légèrement basiques (pH proche de  . Les UV arrivaient à la surface de l’eau et arrivaient jusqu’à dix mètres de profondeurs. L’oxygénation de la terre fut plus ultérieure (- 3,5 milliards d’années).
. Les UV arrivaient à la surface de l’eau et arrivaient jusqu’à dix mètres de profondeurs. L’oxygénation de la terre fut plus ultérieure (- 3,5 milliards d’années).
L’O2 apparaît en mer mais passe en totalité dans l’atmosphère. Quand le taux d’O2 atteint 1% dans l’atmosphère, une partie de l’O2 libre peut se maintenir dans l’océan (ce qui se produit à –2,5 milliards d’années). On le sait car des oxydes de fer apparaissent dans les sédiments marins durant le protérozoïque. La teneur en O2 augmente fortement. A la fin du précambrien, la teneur en O2 est de 18% (contre 21% actuellement) et de 1mL/L dans l’océan.
B Evolution biochimique.
La vie dépend de la présence de molécules organiques.
1 L’origine des premières molécules organiques.
Trois hypothèses expliquent l’origine des premières molécules organiques.
• La soupe primitive : Sous l’effet des UV et de charges électriques (foudre), les composés chimiques des océans primaires (en particulier : H2, CH4, NH3) se condensent en entraînant la formation de molécules organiques. Cette formation n’a lieu qu’en surface (à cause des UV). Ces molécules vont ensuite descendre à plus de dix mètres de profondeur et être préservées des UV. Cf. l’expérience de Miller qui permet la synthèse de 90 molécules de la vie : acides aminés, acides nucléiques, lipides, glucides et polypeptides. • Les sources hydrothermales : Le volcanisme sous-marin aurait apporté les composants chimiques de base (CH4, H2S, H2, CO2, …). Le magma apporte, lui, l’énergie thermique qui permet la synthèse de molécules, or, actuellement, ce fait est impossible à cause de l’oxygénation de l’océan.
• La Panspermie : A ce moment là, de sont des ensemencements d’origine extraterrestres qui sont à l’origine de la vie sur Terre par leur accumulation dans les eaux anoxiques (sans O2). Les composants chimiques se rencontrent dans les nuages interstellaires ; dans le vide et à -260°C, on peut obtenir des molécules organiques. De plus, certaines météorites renferment des acides aminés, des acides nucléiques, des lipides et d’autres molécules organiques (comme dans les comètes).
2 Les macromolécules et leur réplique.
L’assemblage d’acides aminés permet la formation de protéines avec la possibilité de reproduction à l’identique (de ce mécanisme). Fox, par expérimentation, à obtenu, à partir de plusieurs acides aminés, des proténoïdes (des protéines non biologiques). Les argiles ont pu catalyser la formation de macromolécules d’ARN par absorption de ribose, de phosphate et de bases nucléiques sur la surface des feuillets.
3 Le passage macromoléculaire à la vie.
Les macromolécules doivent pouvoir s’auto organiser et croître pour donner des structures prévivantes, intermédiaires entre l’état chimique et l’état vivant. On a pu obtenir ceci par expérimentation.
 L’expérience d’Oparin.
L’expérience d’Oparin.
Par un mélange de polypeptides et de nucléotides, on obtient des gouttelettes (2-500µm) : des coacervats capables d’absorber des glucides et des acides aminés pour croître : ces coacervats ont un métabolisme rudimentaire.
 Fox.
Fox.
En partant de proténoïdes, Fox a obtenu des microsphères capables de croître et de s’entourer d’une membrane et même de bourgeonner.
 On peut dire que les microsphères et les coacervats sont des modèles expérimentaux de ce que furent les protobiontes (
On peut dire que les microsphères et les coacervats sont des modèles expérimentaux de ce que furent les protobiontes ( premières structures organisées, comparables aux virus, mais sans en être). Certains de protobiontes, les plus organisés, protégés d’une enveloppe plus épaisse et capables de se reproduire auraient franchi l’étape de la vie.
premières structures organisées, comparables aux virus, mais sans en être). Certains de protobiontes, les plus organisés, protégés d’une enveloppe plus épaisse et capables de se reproduire auraient franchi l’étape de la vie.
C Témoignage de la vie au précambrien.
1 Identification de la vie.
On considère la vie présente quand une structure organique individualisée possède un métabolisme et peut se reproduire. Il existe deux types de critères :
- Morphologie : il consiste à repérer des structures limitées par des parois et pouvant se retrouver en exemplaires semblables. Les pièces minéralisées sont exceptionnelles, souvent en silice. Des artéfacts sont toujours possibles.
- Composition chimique : on a les structures organiques (molécules organiques complexes) telles que les charbons, kérogène, porphyrines ne pouvant résulter que de l’accumulation de matière organique.
2 Les coccoïdes : composants de nature organique.
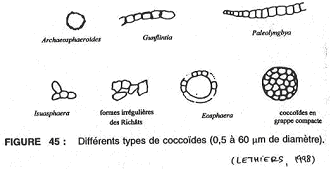
Elles ressemblent à des bactéries actuelles. Elles sont connues de 3,8 milliards d’années jusqu’à 200 millions d’années. On trouve aussi des formes isolées ou associées de manière irrégulière (isuasphaera : la plus ancienne connue).
On les trouve : en filaments ou en grappes sphériques.
Les coccoïdes sont la souche des procaryotes caractérisés par un régime dit autotrophe primitif (synthèse de matière organique à partir de CH4 et d’H2S). On peut aussi trouver un régime hétérotrophe (cannibalisme primaire).
3 Les sphéroïdes.
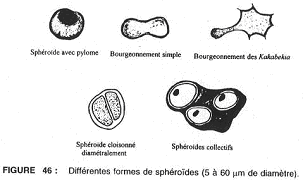
Ce sont des micro-fossiles à membrane épaisse de forme plus ou moins sphérique présentant des bourgeonnements ou des pores (orifices) qui libèrent de nouveaux sphéroïdes (connus entre 3,6 milliards et 800 millions d’années). Ils sont cloisonnés diamétralement : on a une division par mitose.
On considère qu’ils seraient à l’origine des eucaryotes (il y aurait une mitose par division). Ils pourraient dériver de coccoïdes à grappe compacte qui se seraient entourés d’une enveloppe et qui auraient associé des organites cellulaires à fonctions différentes et d’autotrophes primitifs ou hétérotrophes.
4 Les stromatolithes.
Ce sont des masses calcaires avec une surface mamelonnée à aspect stratiforme ou formant des piliers ; ils présentent toujours une très fine lamination qui indique une croissance rythmique par encroûtement successif. Elles existent toujours (en Australie). Elles résultent de l’activité de cyanophycae qui piègent les sédiments et fixent les boues calcaires. Leur régime est autotrophe par photosynthèse (CO2 et H2 permettent la synthèse de matière organique).
 Les stromatolithes entraînent une diminution de la teneur du milieu en CO2 et une augmentation de celle d’O2 libre.
Les stromatolithes entraînent une diminution de la teneur du milieu en CO2 et une augmentation de celle d’O2 libre.
Les cyanophycae sont donc à l’origine du grand développement de l’O2 dans l’océan et dans l’atmosphère. Elles vivent sur les plate-formes marine peu profondes. Les premières sont apparues il y a 3,5 milliards d’années en Australie. Leur prolifération a eu lieu entre 2,5 milliards d’années et 600 millions d’années. Maintenant, elles sont en déclin.
5 Les métazoaires : faune d’Ediacara.
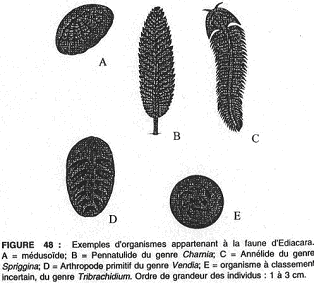
Ils sont connus dans tous les boucliers anciens à partir de 800 millions d’années. Ils sont surtout connus par un gisement en Australie (-580 millions d’années) où l’on a trouvé 1500 spécimens appartenant à une trentaine de formes qui ne sont que des empreintes.
Plus de la moitié de ces empreintes proviennent de cœlentérés (méduses, pennalutidés [fixés]). Les autres sont plus énigmatiques ; ils doivent être des ancêtres d’annélides, d’arthropodes et d’échinodermes.
D’autres considèrent qu’il s’agit d’un groupe spécial, les vendobiontes, qui auraient absorbé l’O2 et les nutriments dissous par toute la surface du corps et auraient vécu en symbiose avec des algues.
Ce peuplement marin très original disparaît à la fin du précambrien (540 millions d’années).
II La vie au paléozoïque.
A Paléozoïque inférieur (540-410 millions d’années).
1 Limite précambrien/cambrien.
Entre le précambrien et le cambrien, il y a des événements fondamentaux : apparition de carapace et de coquille du fait de la concentration en O2 qui devient supérieureà 1mL/L d’eau. C’est le seuil à partir duquel les invertébrés vont extraire le carbonate pour former la coquille.
Ces carapaces ont un rôle protecteur. A partir de ce moment, on a une pièce fossilisable qui permet l’accroissement des documents paléontologiques.
2 Vie marine.
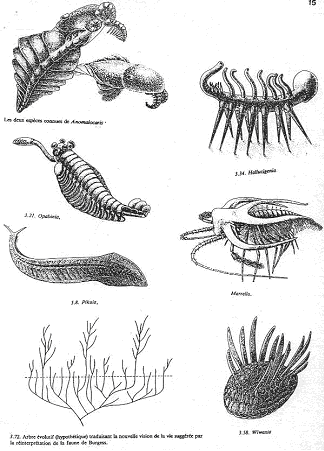
On a un développement de groupes très particuliers (faune primitive) qui n’ont pas de représentant actuel (sans descendance). Les schistes de Burgess (cambrien moyen, Canada) contiennent un peuplement très diversifié décimé par une crise : Achéocyates, Graptolites…
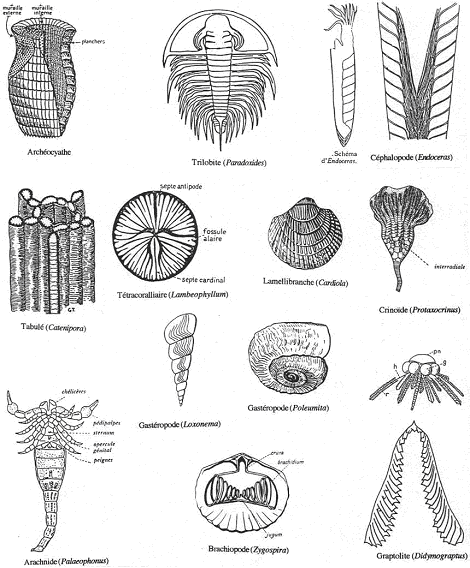
On note la présence de tous les groupes d’invertébrés actuels avec des formes primitives vivant sur une plate-forme :
- Arthropodes et trilobites.
- Cœlentérés madréporaires (polypiers).
- Céphalopodes ; annélides ; lamellibranches ; brachiopodes ; échinoderme.
3 L’apparition des vertébrés.
Dans les schistes de Burgess, on trouve Pikaïa que l’on considère comme procordé. Les premiers vertébrés sont connus à la fin du paléozoïque inférieure ; par exemple, au silurien on a les agnathes, des poissons cuirassés (carapace osseuse).
* Sur Terre : à la fin du paléozoïque inférieure, on trouve les premiers fossiles continentaux de flore : ptéridophytes primitifs sans racine différenciée (et arachnides).
B Le paléozoïque supérieur : 410-250 millions d’années.
1 La vie marine.
On assiste à l’extinction des graptolites et à la régression des trilobites. C’est l’épanouissement et la diversification des céphalopodes (goniatites) et des brachiopodes (fixés ou pélagiques).
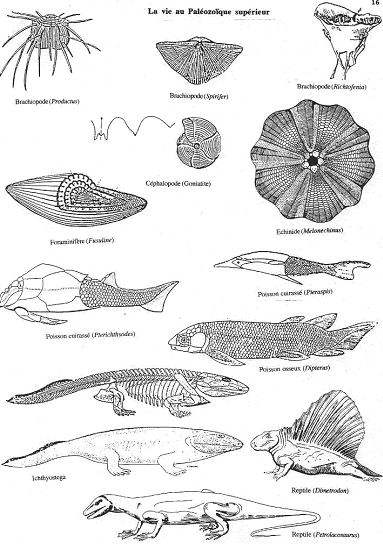
Il y a apparition des foraminifères et des échinides.
Les poissons cuirassés sont remplacés par les poissons. Ce phénomène ne dure toutefois pas longtemps : jusqu’à la fin du dévonien. On peut l’expliquer par le développement de toute la lignée des poissons.
2 En milieu continental : la conquête des continents.
 Les végétaux.
Les végétaux.
Deux flores se succèdent : une au dévonien (les psilophitales, dans les marécages) et une au carbonifère et permien (les ptéridophytes et les gymnospermes).
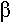 Les invertébrés.
Les invertébrés.
Divers groupes gagnent les continents, comme les crustacés géants (2 mètres de long) au dévonien, ils sont dans des eaux saumâtres. Au carbonifère, ils passent dans les eaux douces. Les gastéropodes et les lamellibranches passent aussi en eau douce.
Les myriapodes, insectes (libellules de 80cm, blattes qui n’évolueront plus) et arachnides apparaissent.
3 Le dévonien.
Dès le dévonien, les poissons gagnent le milieu continental. Parmi les espèces qui franchissent la limite, on trouve : les dipneustes (dipterus) et les crossoptérygiens (nageoires articulées).
Au dévonien supérieur, les crossoptérygiens donnent naissance aux amphibiens par un animal intermédiaire qui est inconnu (appelé Ichtyostéga). Les amphibiens sont encore assujettis à la vie aquatique.
4 Carbonifère et Permien.
Au carbonifère supérieur se différencient les reptiles qui sont totalement libérés de l’eau grâce aux œufs adaptés.
Dès le permien, les reptiles se divisent en deux lignées :
- Les sauropsidés qui donneront les autres reptiles.
- Les théropsidés ou reptiles mammaliens qui donneront les mammifères.
III La vie au mésozoïque (Trias – Jurassique - Crétacé), 250MA-65MA.
Les continents étaient largement recouverts par des mers peu profondes. Ces eaux étaient chaudes (10°C de plus que maintenant) et riches en ions (éléments chimiques). Le climat était donc doux et peu contrasté.
 Les conditions étaient très favorables à la vie.
Les conditions étaient très favorables à la vie.
A Vie marine très florissante.
Les algues et les protistes prolifèrent. Le plancton était très abondant. On va avoir un développement de nouveaux cœlentérés (hexacoralliaires), de nouvelles pousses évolutives chez les mollusques (lamellibranches) adaptés à la vie récifale (rudistes).
On observe aussi le développement de nouveaux céphalopodes : ammonites et bélemnites. Le phénomène arrive chez les brachiopodes et les échinides irréguliers).
Les poissons sont très proches de ce qu’ils sont actuellement.
B Vie continentale.
On assiste à un renouvellement de la flore.
Les ptéridophytes régressent, les gymnospermes dominent et les angiospermes apparaissent au jurassique supérieur.
Le mésozoïque voit principalement le développement des grands reptiles avec les dinosauriens.
Les dinosauriens vont se diviser en deux lignées :
- Les sauripelviens : à bassin triradié.
- Les avipelviens : bassin tétraradié (+ le pré-pubis).
Les reptiles peuplent les mers mais aussi les airs (ptérosauriens).
Au jurassique supérieur, les dinosauriens triradiés donnent naissance aux oiseaux. L’animal intermédiaire est archéoptéryx. On n’en a trouvé que 6 dans le monde, et tous en bavière. Les écailles donnent les plumes.
C’est à cette période que l’on connaît les premiers mammifères descendant des reptiles mammaliens : ils sont petits et vivent la nuit.
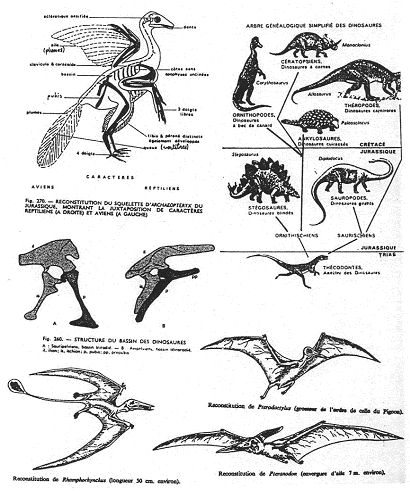
IV Vie au cénozoïque : éocène, oligocène, miocène, pliocène (-65MA à presque actuel).
La vie est profondément renouvelée. On le voit particulièrement en milieu marin : On peut aussi observer un épanouissement des gastéropodes. Les brachiopodes régressent et sont remplacés par les lamellibranches. Les céphalopodes sans coquille externe prennent la place des ammonites et des bélemnites.
De plus, on voit une diversification des échinides et une apparition de nouveaux foraminifères comme les alvéolines et les nummulites.
En milieu continental, on observe une diminution des gymnospermes au profit des angiospermes. C’est l’ère des mammifères et les reptiles sont en forte régression.
On peut observer deux faunes successives :
- Une au début du paléocène : faune archaïque sans descendance.
- Dès l’éocène, il y a explosion de toutes les lignées actuelles.
Il ne faut pas oublier l’apparition des hominidés (pliocène) et l’épanouissement des oiseaux.
V Conclusion.
• Les grands groupes apparaissent dans un ordre de complexité croissante (différent de la diversité).
• Tous les grands groupes d’invertébrés sont connus au primaire.
• L’évolution des vertébrés se réalise en totalité au cours du phanérozoïque.
• Des formes intermédiaires existent entre les groupes de vertébrés. Cela prouve qu’il y a continuité dans l’évolution.
• Les formes marines précèdent toujours les formes continentales que ce soit à l’échelle de la vie ou de chaque groupe.
• Les périodes d’expansion des divers groupes se succèdent dans le même ordre que leur apparition. On trouve les relais : gymnospermes  angiospermes, brachiopodes
angiospermes, brachiopodes  lamellibranches, reptiles
lamellibranches, reptiles  mammifères.
mammifères.
A chaque ère ou sous-ère géologique correspond un peuplement spécifique. Une ère est un renouvellement biologique majeur. Mais il reste le problème des crises biologiques.
Les grandes crises biologiques.
I Définitions.
Les grandes crises biologiques correspondent à l’extinction en masse d’espèces sur une durée de l’ordre de 10.000 ans à 1 million d’années. Ces extinctions sont reconnaissables à l’échelle de la planète. On peut en distinguer trois types :
- Extinction graduelle.
- Extinction par étapes.
- Extinction catastrophique.
Il y aurait eu deux grandes crises. La plus importante des deux a eu lieu à la fin du permien (-245 millions d’années) et aurait fait disparaître entre 50 et 57% des animaux marins et plus de 50% des familles d’animaux terrestres.
On peut observer quatre crises majeures :
- Fin de l’ordovicien (-435 millions d’années) : -25% des familles d’animaux marins.
- Fin du dévonien supérieur (-365 millions d’années) : -22% des familles d’animaux marins.
- Fin du trias (-215 millions d’années) : -22% des familles d’animaux marins.
- Limite crétacé-tertiaire : -15% des familles d’animaux marins.
On distingue également quinze crises intermédiaires.
Depuis le permien, on peut observer une périodicité de 26 millions d’années dans les crises.
II La crises intermédiaire du cénomanien supérieur. (-100 MA)
A Caractéristiques biologiques.
Cette crise a éliminé 7% des familles et 26% des genres d’animaux marins.
Dans un premier temps, il y a eu élimination de peuplements benthiques (vivent au fond) : rudistes, foraminifères, ostracodes. Dans un second temps, les peuplements planctoniques (entre deux eaux) ont été éliminés. Cette extinction s’est faite sur une étape de un million d’années, à la partie supérieure du cénomanien et jusqu’au sommet de cette même période.
B Evènements géologiques.
On a mit en évidence deux évènements importants :
- Deux couches noires dues à un développement de marnes noires. Elles sont riches en matière organique d’origine marine et disposées en fins feuillets (ou lamines)  il n’y avait pas de vie sur le fond. Par contre, on y trouve des micro-fossiles planctoniques venant des eaux de surface.
il n’y avait pas de vie sur le fond. Par contre, on y trouve des micro-fossiles planctoniques venant des eaux de surface.
- Ces eaux étaient anoxiques, pauvres en O2 dissout. Il y a eu aussi une très forte montée du niveau marin (+250 mètres par rapport au niveau actuel). Les teneurs en 18O2 (indicateurs de la température des eaux) indiquent que ces eaux étaient chaudes.
C Interprétation de l’arrivée de CO2 magmatique.
A la fin du cénomanien, il y a eu une production exceptionnelle de croûte océanique. Il y a donc arrivée d’une grande quantité de CO2 magmatique. Les eaux se sont chargées en CO2, sont devenues plus lourdes et sont restées au fond. Le niveau de la mer va monter : transgression. Plus d’eau est donc soumise au rayonnement solaire ( la température augmente).
la température augmente).
 Finalement, on obtient un système d’eau stratifiée : il n’y a plus de brassage des eaux, donc pas d’oxygénation possible des fonds et les organismes benthiques sont les premiers éliminés.
Finalement, on obtient un système d’eau stratifiée : il n’y a plus de brassage des eaux, donc pas d’oxygénation possible des fonds et les organismes benthiques sont les premiers éliminés.
Par contre, la matière organique est conservée sur le fond car il n’y a pas d’oxydation.
 C’est une crise biologique en relation avec la tectonique des plaques.
C’est une crise biologique en relation avec la tectonique des plaques.
III La crise de la limite crétacé/tertiaire. (-65 MA)
A Caractéristiques biologiques.
C’est une crise spectaculaire qui affecte tous les milieux.
1 Le milieu marin.
15% des familles, 45% des genres et 76% des espèces disparaissent. En moyenne, 80% du plancton est détruit (tout le reste de la chaîne trophique en souffre). Les ammonites, les bélemnites, les rudistes et les reptiles marins vont disparaître ou fortement diminuer.
Il y a extinction de nombreux genres de brachiopodes, de foraminifères qui s’éteignent.
Seuls les peuplements des grands fonds ne sont pas touchés.
2 Le milieu continental.
Il n’y a pas de changement majeur dans la végétation. Tous les dinosaures et reptiles volants disparaissent. Les autres vertébrés sont touchés dans des proportions variables.
Les organismes d’eau douce sont les moins touchés.
3 Deux types d’extinction.
• Extinction graduelle :
Cette extinction a lieu sur 2 millions d’années, durant le maastrichien supérieur (dernier étage du crétacé) : c’est la fin pour des rudistes et des ammonites. Pour les dinosaures, ça se discute.
• Extinction brutale :
Là, l’extinction est catastrophique, exactement à la limite entre le crétacé et le tertiaire.
B Evènements géologiques.
On observe une régression marine se reproduisant à la fin du crétacé. A –67 et –65 millions d’années, on a deux baisses. La première est plus importante que la seconde.
 La géographie change avec une extension plus faible des mers épicontinentales.
La géographie change avec une extension plus faible des mers épicontinentales.
Si les mers se retirent, les eaux se refroidissent (ici, perte de 5°C en moyenne).
On a relevé les traces d’un intense volcanisme : les trapps du Deccan (essentiellement situé en Indes). Ces trapps sont un empilement de basaltes sur deux kilomètres d’épaisseur. Ce volcanisme a duré 600.000 ans.
On trouve, exactement à la limite crétacé-tertiaire (K/T), un niveau riche en iridium ainsi que la présence de quartz choqués et de magnétites nickélifères qui sont toujours d’origine extraterrestre. On peut aussi trouver des microtectites qui sont des gouttelettes de verre résultant de la mise en fusion de la croûte terrestre.
 Ces indices sont sur toutes la surface du globe : il y a donc eu un impact météoritique. Au Mexique, on a le cratère de Chixulub d’un diamètre de 250 kilomètres.
Ces indices sont sur toutes la surface du globe : il y a donc eu un impact météoritique. Au Mexique, on a le cratère de Chixulub d’un diamètre de 250 kilomètres.
C Interprétation : trois causes néfastes.
1 La régression marine.
Au cours du maastrichien supérieur, il y a diminution du taux d’expansion océanique qui provoque une régression marine, un retrait des mers avec donc, des eaux plus froides et un climat plus continental.
Les organismes adaptés aux eaux chaudes vont périr (rudistes) alors que les organismes adaptés à un climat plus contrasté survivront.
2 Les trapps du Deccan.
La mise en place du point chaud qui est à l’origine des trapps du Deccan va entraîner la production de grandes éruptions volcaniques qui vont éliminer la luminosité et provoquer des pluies acides.
3 L’impact météoritique.
Une météorite d’un diamètre compris entre 15 et 20 kilomètres est venue s’écraser sur Terre. Elle est venue se désagréger sur une couche d’anhydrite et a provoqué un dégorgement d’acide sulfurique : 600 milliards de tonnes d’H2SO4 ont été expulsées.
Au moment de l’impact, la collision a créé un choc thermique qui a apporté brutalement un échauffement et provoqué des incendies. De plus l’impact a rejeté dans l’atmosphère une grande quantité de poussières qui ont arrêté les rayons lumineux  Absence de photosynthèse.
Absence de photosynthèse.
Pendant plusieurs dizaines de milliers d’années, il est resté un anneau de poussières autour de la Terre  « hiver » par absence de rayons solaires arrivant au sol.
« hiver » par absence de rayons solaires arrivant au sol.
 La température baisse de plusieurs degrés.
La température baisse de plusieurs degrés.
Ces perturbations sont fatales aux organismes en déclin (aux organismes spécialisés comme les rudistes).
Les deux premières causes sont liées à la dynamique terrestre et créent des extinctions graduelles.
La dernière cause est d’origine extraterrestre : extinction catastrophique.
IV La crise de la limite permien/trias.(-230 MA)
A Caractéristiques biologiques.
Cette crise touche tous les peuplements marins et continentaux.
1 En milieu marin.
En milieu marin, les trilobites, tabulés, tétracoralliaires et certains foraminifères disparaissent. Les ammonoïdés sont décimés (-98% des espèces). 90% des genres de brachiopodes disparaissent et 98% des familles d’échinodermes meurent. 75% des familles de bryozoaires sont éliminées.
 Au total, le pourcentage maximum de disparition en milieu marin a été de 83% des genres et 96% des espèces.
Au total, le pourcentage maximum de disparition en milieu marin a été de 83% des genres et 96% des espèces.
2 En milieu continental.
Les gymnospermes diminuent fortement. Au dessus de la limite, il y a prolifération des mycètes associée à un taux élevé de débris végétaux.
 C’est « l’événement fongique » d’une durée de 50.000 ans.
C’est « l’événement fongique » d’une durée de 50.000 ans.
Les vertébrés sont fortement touchés : perte de 75% des familles. 63% des familles d’insectes sont perdues.
Ces extinctions se déroulent à la fois : par étape (4 épisodes chez les vertébrés au permien supérieur) et graduelles (céphalopodes et échinodermes).
L’événement fongique fait penser à un événement catastrophique.
B Evènements géologiques.
Au permien, un continent unique (la Pangée) est formé de deux branches :
- Au sud : le Gondwana.
- Au nord : la Laurasia.
Sur ce continent unique, cinq évènements se succèdent.
1 Changement climatique global.
Au permien inférieur, on a un climat de glaciations. On passe au trias inférieur sans glaciation  cela se traduit par des argiles noires et du charbon.
cela se traduit par des argiles noires et du charbon.
Au permien supérieur et au trias, on a des couches détritiques rouges (typiques des climats désertiques) ainsi que des évaporites.
La tendance à l’aridité s’accentue, surtout entre le permien et le trias : le climat bascule, devient plus chaud et moins contrasté entre les pôles et l’équateur. Les déserts se développent et notamment, la zone équatoriale humide devient plus aride.
Les causes de ce changement sont : un changement de l’orbite terrestre et le fait de n’avoir qu’un continent unique.
2 Régression marine au permien supérieur.
Durant le permien, le niveau des mers a chuté de 250 mètres. Cette baisse est due à un arrêt de l’expansion océanique  Il y a croissance de 6% du volume océanique.
Il y a croissance de 6% du volume océanique.
La régression va accentuer la continentalisation du climat. Elle réduit aussi la surface des mers épicontinentales.
 Il y a émersion des dépôts du carbonifère et du permien inférieur qui étaient riches en matière végétale. Le carbone organique va être oxydé, ce qui provoque la libération de CO2 dans l’atmosphère.
Il y a émersion des dépôts du carbonifère et du permien inférieur qui étaient riches en matière végétale. Le carbone organique va être oxydé, ce qui provoque la libération de CO2 dans l’atmosphère.
3 Baisse de la salinité marine.
Il y a un développement des mers fermées et notamment dans les zones climatiques chaudes. Les sels s’accumulent et donnent des mers sur salées.
Ce sel est prélevé du stock normalement dissout dans les océans.
La baisse de la salinité aurait été comprise entre 5 et 10 pour mille.
Conséquence : les organismes qui ne tolèrent pas des variations de la salinité sont décimés : coraux, céphalopodes, échinodermes.
4 Volcanisme intense.
Un volcanisme intense se produit en Sibérie, d’une épaisseur de plus de 3 kilomètres, sur une surface de 2,5.106km².
On a identifié 11 éruptions principales à la limite entre le permien et le trias, sur une durée inférieure à un million d’années. Ces éruptions amènent dans l’atmosphère du SO2, du CO2 et un obscurcissement du ciel.
5 Transgression brutale et considérable.
En quelques milliers d’années, le niveau remonte de 210 mètres grâce à la création de nouvelles zones d’expansion.
Les eaux arrivant sont chaudes et chargées en CO2, ce qui diminue la solubilité de l’O2 dans l’eau.
 C’est une eau mal oxygénée (dysoxique) qui va transgresser sur les continents.
C’est une eau mal oxygénée (dysoxique) qui va transgresser sur les continents.
C Interprétation.
Au permien supérieur se développement des conditions défavorables à la vie (changements climatiques, régression marine avec diminution du milieu marin et baisse de la salinité).
A la limite permien/trias s’ajoute une nouvelle condition défavorable : le volcanisme intense qui perturbe la végétation. C’est un de ces phénomènes volcaniques qui est à la base de l’événement fongique.
Sur cette biosphère affaiblie, s’abat une nouvelle épreuve, à la base du trias : la transgression d’eau mal oxygénée.
Aucun de ces facteurs, seul ; ne pouvait provoquer une extinction importante. C’est la conjonction des divers facteurs qui a provoqué la plus grande crise biologique.
Dans cette crise, c’est la dynamique interne de la Terre qui joue un rôle majeur.
La dynamique du système solaire, la variation de l’orbite terrestre aurait pu influencer le climat.
V Conclusions
• Les fossiles enregistrent le comportement de la Terre et de l’univers : c’est à dire que le principal moteur de l’évolution biologique est externe aux organismes.
• Les extinctions sont dues : à des changements de la dynamique terrestre (climat, niveau des mers, chimie de eaux), à des évènements extraterrestres (climat et rayonnement solaire).
• Les grandes crises sont dues à la conjonction de plusieurs causes néfastes.
• Il y a une périodicité dans les crises qui pourrait être due au fait que l’orbite de la Terre traverse une ceinture d’astéroïdes (nuage d’Oort).
• Si l’on regarde ce qu’il se passe depuis que l’Homme est sur la Terre, on voit :
- La disparition de nombreuses espèces.
- La transformation d’espèces.
 L’Homme peut créer une crise biologique.
L’Homme peut créer une crise biologique.
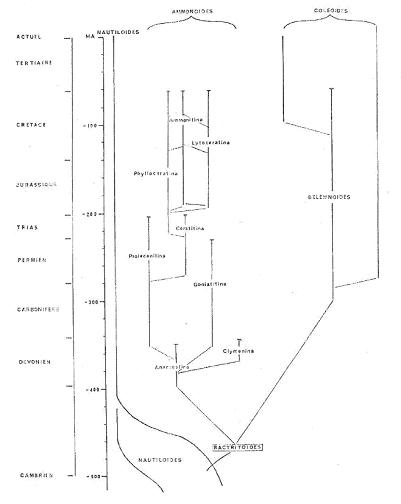
Principales phases de la macroévolution des céphalopodes.
Les céphalopodes correspondent à une classe qui appartient à l’embranchement des mollusques. Ils sont caractérisés par un mode de vie marin et un régime carnivore : ce sont des prédateurs.
Il existe quatre sous-classes :
- Nautiloïdés (tétrabranchiaux). Ils ont une coquille externe et sont les derniers représentants actuels de ce cas (coquille externe).
- Coléoïdea (dibranchiaux). On trouve dans ce groupe la seiche à coquille interne.
- Ammonoïdés (fossiles). Ils étaient à coquille externe.
- Bactritoïdés (fossiles). Ils étaient à coquille externe.
I Les premiers céphalopodes : les nautiloïdea.
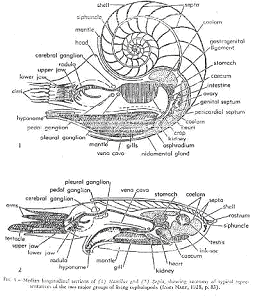
A Caractères généraux.
Leur position de vie est avec l’ouverture en bas.
Ils sont connus depuis le cambrien. Leur coquille est externe et ils vivent dans la dernière loge ou chambre d’habitation.
La coquille est divisée par des cloisons concaves vers l’avant, traversées par un siphon (liaison à la loge initiale) qui est soit marginal, soit central et il traverse la cloison par un goulot siphonnal tourné vers l’arrière ou rétrosiphonné.
L’intersection entre la cloison et la coquille entraîne la formation de la « ligne de suture », rectiligne ou légèrement sinueuse.
B Les formes souches : ellesmocerida.
Ces formes sont caractérisées par une coquille droite et légèrement courbe. La suture est rectiligne. Il y a une absence d’ornementation sur la coquille. Cette dernière est de petite taille (1 à 2 cm de long).
C La diversification au paléozoïque.
Dès l’ordovicien, les ellesmocerida donnent naissance à différentes lignées : diversification, épanouissement et dispersion géographique. On peut observer cinq tendances évolutives qui apparaissent.
1 L’augmentation de la taille par allongement d’une coquille droite (jusqu’à 2 mètres de long).
Les orthocerida.
2 L’augmentation de taille par enroulement de la coquille : les Nautilida.
La coquille qui était initialement protectrice devient un organe de suspension et maintien le centre de gravité près du corps.
3 La complexification de la ligne de suture.
Elle devient sinueuse, avec un enroulement de la coquille. Les replis des cloisons entraînent un renforcement de l’architecture de la coquille (augmentation de la surface d’attachement).
4 Développement de l’ornementation avec l’apparition de cotes et de tubercules.
Ces développements permettent un renforcement de la coquille et de « camoufler » l’animal.
5 L’apparition de remplissage internes de calcite.
Ces remplissages apparaissent autour du siphon et dans les loges. On trouve ce cas chez Endocerida et Actinocerida. Le remplissage a pour rôle de lester la coquille, pour que la position soit plus horizontale.
D La persistance des Nautilida.
La majorité de nautiloïdés ne dépassent pas le trias. Seuls les nautilida franchissent les crises majeures de la fin du permien, de la fin du trias et de la fin du crétacé : ce sont les formes les mieux adaptées à la nage (coquille légère, enroulée en spirale).
Ils sont maintenant en pleine régression : plus qu’un genre et deux espèces (Nautilus)  ce sont des exemples de fossiles vivants.
ce sont des exemples de fossiles vivants.
II Un groupe charnière : les bactritoïdea.
Les bactritoïdea sont au carrefour de tous les céphalopodes. Ils apparaissent à l’ordovicien et sont surtout représentés au paléozoïque supérieur avec des caractères des « formes-souches » :
- Petites tailles : 2 à 5cm.
- Une structure simple, droite ou légèrement courbe, sans dépôt interne, à ornementation faible.
 Ils possèdent à la fois des caractères :
Ils possèdent à la fois des caractères :
- De nautiloïdés (cloisons concaves vers l’avant à goulot rétrosiphonné).
- De coléoïdés : siphon ventral et surtout, certaines espèces possèdent une coquille avec une couche externe faite de calcite rayonnante.
- D’ammonoïdés : suture peu plissée possédant un lobe ventral.
On estime que les bactritoïdés dérivent de Nautiloïdés à siphon marginal, avec une innovation  Apparition du lobe ventral. Ils sont ensuite divisés en deux lignées :
Apparition du lobe ventral. Ils sont ensuite divisés en deux lignées :
- Bactritidae : apogée au dévonien et qui auraient donné naissance aux ammonoïdés par un enroulement de la coquille et la modification de la forme des cloisons (convexes vers l’avant).
- Probactritidae : apogée au carbonifère et au permien. Ils auraient donné les bélemnites par : une migration du manteau à l’extérieur de la coquille, une adjonction de pièces complémentaires (rostre) et d’importantes modifications du corps mou (on passe de quatre branchies à deux branchies et de quatre reins à deux reins). Toutefois, aucun intermédiaire n’est connu entre les bactritoïdés et les bélemnites.
Les bactritoïdés s’éteignent à la fin du permien mais après avoir donné naissance à tous les céphalopodes évolués.
III Céphalopodes dominants au paléozoïque supérieur et mésozoïque : les ammonoïdea.
A Caractères généraux.
1 Les cloisons.
Les cloisons sont convexes vers l’avant.
2 La ligne de suture.
La suture devient complexe et débute toujours par un lobe ventral.
3 Le siphon.
Le siphon devient marginal et, la plupart du temps, est ventral (=externe).
B Les formes souches : les anarcestida.
Ces anarcestida descendent des bactritoïdea. Ils sont caractérisés par un enroulement planispiralé, une petite taille, une ornementation faible et une suture simple et peu découpée (en général, ils ont trois lobes).
C Les ammonoïdés du paléozoïque supérieur.
Dès le dévonien moyen, les anarcestida donnent trois lignées :
- Les clyméniida : le siphon est dorsal (interne). C’est un dispositif original qui n’aura pas de suite.
- Les goniatitida : leur taille est moyenne (environ 40cm), leur ornementation est plus forte (persillée) mais ont plus de 3 lobes, le goulot siphonnal est tourné vers l’avant (ou prosiphonné).
- Les prolecanitida : leur coquille est de taille moyenne, avec un mélange de caractères évolués (ligne de suture avec de nombreux replis). Chez certaines espèces, des lobes sont denticulés (ou persillés). Par contre, ils présentent des caractères archaïques comme un goulot rétrosiphonné.
 C’est une évolution mosaïque.
C’est une évolution mosaïque.
D Epanouissement au permo-trias : les ceratitida.
Les ceratitida descendent des prolecanitida (analogie de la ligne de suture). Ils en diffèrent par un goulot siphonnal prosiphonné.
Les ceratitida achèveront l’évolution des ammonoïdés du paléozoïque avec une grande diversité :
- Diversité de forme : à côté des coquilles en spirale, on voit apparaître des coquilles déroulées ou en spires hélicoïdales : des coquilles hétéromorphes. Ce sont des adaptations à des modes de vie particuliers.
- Diversité d’ornementation : très peu ornementée ou très ornementée  Adaptation aux différentes profondeurs d’eau.
Adaptation aux différentes profondeurs d’eau.
- Diversité de taille : les ammonoïdés peuvent faire jusqu’à un mètre de diamètre. Les plus petits, les nanites, font moins de un centimètre de diamètre.
- Diversité de lignes de suture : les trois types de ligne de suture sont présents (goniatites, cératites, ammonites).
 A la fin du trias, toutes les cératites disparaissent.
A la fin du trias, toutes les cératites disparaissent.
E Les ammonoïdés du jurassique-crétacé : ammonites évoluées.
La suture est complexe, le goulot est prosiphonné et leur taille varie de moyenne à grande (jusqu’à deux mètres de diamètre). Ces ammonites forment trois ensembles.
1 Les phyllocératida.
Les phyllocératida descendent des cératitidae. Cela se voit par le dessin de la ligne de suture qui présente une réticulation en forme de spatule.
Leur coquille est mince, à section ogivale : coquilles platycônes. L’ornementation est faible.
Ce sont des adaptations à la vie sur les plateaux continentaux.
2 Les lytocératida.
La coquille a une section circulaire, ornée de fines côtes transversales : coquille serpenticône. La suture est composée d’éléments peu nombreux. Ce sont des adaptations à la vie au large.
Au crétacé, elles vont donner naissance aux ammonites hétéromorphes.
 Adaptation à une vie en suspension dans l’eau et passive.
Adaptation à une vie en suspension dans l’eau et passive.
3 Les ammonotida.
Les coquilles sont épaisses, très ornées, avec une suture complexe : coquilles sphérocônes. Les coquilles sont résistantes à de hautes pressions, pour une vie en milieu profond.
Au crétacé supérieur, elles ont donné naissance à des ammonites aplaties, peu ornées, avec une ligne de suture de type cératite.
 La fin du crétacé marque la disparition de tous les ammonoïdés.
La fin du crétacé marque la disparition de tous les ammonoïdés.
IV Les coleoïdea : bélemnites et céphalopodes modernes.
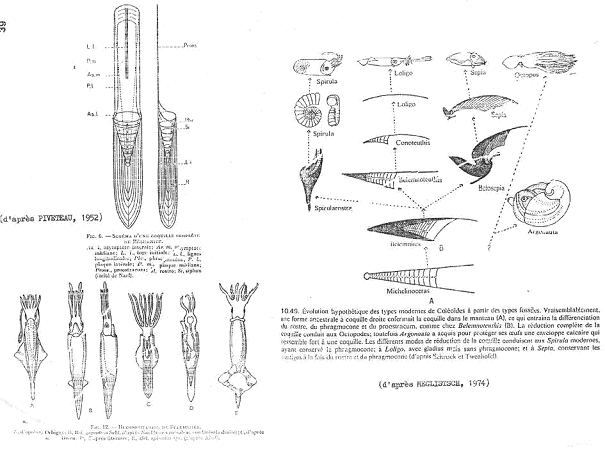
A Les bélemnitida.
Leur coquille est interne, en trois parties.
1 Le phragmocône.
Ce phragmocône correspond à la coquille des nautiloïdés et des bactritidés. Les cloisons sont concaves vers l’avant, rétrosiphonnées.
2 Le pro-ostracum.
Ce pro-ostracum est une pièce dorsale, cornée (l’os de seiche) qui est rarement fossilisé.
3 Le rostre.
Le rostre est une pièce de calcite située à l’arrière et dans laquelle s’emboîte le phragmocône. Le rostre a un rôle important de contre-poids et peut servir d’éperon.
4 Evolution.
Les premières bélemnites sont caractérisées par un grand phragmocône et un rostre de petite taille.
Au cours de l’évolution, le phragmocône devient de plus en plus petit alors que le rostre et le pro-ostracum se développent.
A la fin du crétacé, les bélemnites disparaissent.
B Les céphalopodes modernes.
Tous les céphalopodes modernes descendent des bélemnites et sont caractérisés par la réduction ou la disparition du squelette (c’est surtout le pro-ostracum qui peut rester).
La seiche a un pro-ostracum et un résidu de rostre.
Le calamar n’a que le pro-ostracum.
Le poulpe n’a plus de coquille interne.
La spirule perd le pro-ostracum et le rostre mais le phragmocône reste et s’enroule en spirale à l’intérieur.
V Conclusion.
L’évolution passe toujours par deux étapes :
- Des formes souches, de petite taille à structure simple.
- Une diversification et un épanouissement : adaptation à des milieux (modes) de vie variés : c’est la « radiation adaptative ».
Les formes souches (qui relancent l’évolution) permettent de mettre en place de nouveaux dispositifs. Ces formes succèdent à des crises biologiques qui rythment l’évolution.
On trouve deux modèles d’adaptation à la vie carnassière et à la nage qui sont successivement essayés. :
- 1er modèle : complexification de la coquille externe.
- 2ème modèle : allègement d’une coquille interne.
Il existe des groupes intermédiaires qui maintiennent une continuité dans l’évolution.
Exemples d’évolution intra spécifique et trans-spécifique :
La Microévolution.
I L’évolution graduelle.
A Principe.
Dans ce processus, les populations se modifient au cours des temps, de manière continue (graduelle), généralement lente, par l’accumulation de changements minimes, triés et orientés par la sélection naturelle.
De génération en génération, le pourcentage des formes dérivées (sélectionnées) augmente et il détermine la modification progressive d’une lignée.
B Exemples.
1 Les Kosmoceras de l’oxfordien (jurassique supérieur).
On peut observer deux rangées de tubercules de chaque côté. A Petersborough, une coupe de 13 mètres de haut a été réalisée.
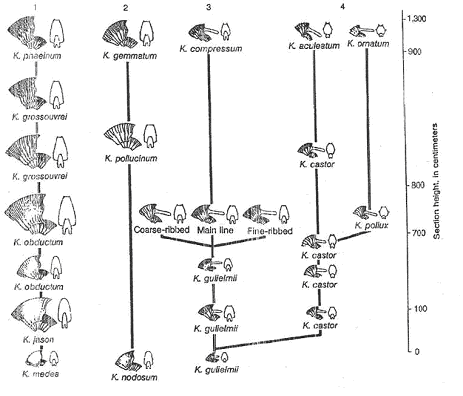
De la base au sommet, on a une accentuation progressive de l’ornementation : les côtes sont de plus en plus fortes et les externes sont plus nombreuses. Cette même évolution est présente dans quatre lignées. En fait, on a deux lignées femelles (1 et 2) et deux lignées mâles (3 et 4), mais les noms sont différents entre les mâles et les femelles.
Tous les intermédiaires existent dans les diverses formes. Malgré tout, un saut brusque apparaît à 10 mètres 93,5cm de la base de la coupe.
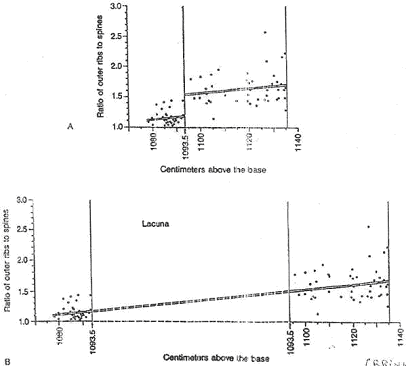
Figure A :
Sur cette figure, un point représente un individu. Ces points sont placés en fonction du rapport nombre de côtes sur nombre de tubercules. Les points représentatifs des individus s’alignent sur deux droites de régression. Ce saut est interprété comme correspondant à une lacune de sédimentation (arrêt de la sédimentation).
Figure B :
Sur cette figure, on insère du temps pour que les deux droites soient dans le même prolongement : cette lacune correspondrait à la durée de temps nécessaire pour une accumulation de 80cm de sédiments compactés.
- Le genre Kosmoceras se transforme au cours des temps, à l’intérieur de diverses lignées : chaque lignée est une « lignée évolutive ».
- Il y a deux lignées qui évoluent en même temps et de la même manière : c’est une « évolution parallèle ».
- Les discontinuités qui apparaissent dans l’évolution sont considérées comme des discontinuités de sédimentation.
En domaine marin de plate-forme, la sédimentation est un phénomène très discontinu. Il est donc très difficile d’observer l’évolution continue d’un groupe (ou lignée).
2 Les alvéolines (foraminifères benthiques) de l’éocène.
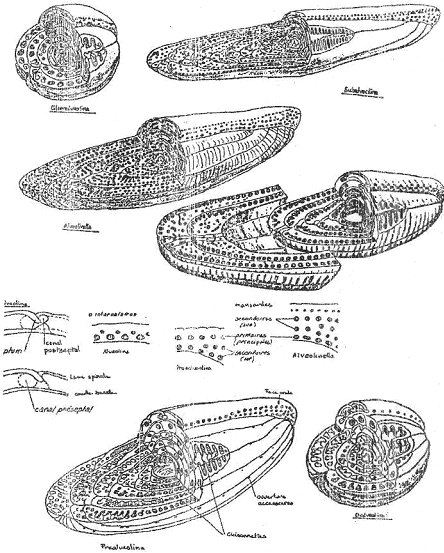
Les alvéolines comprennent plusieurs lignées.
Ici, on voit différentes lignées (ou groupe, dans ce cas) qui se distinguent les unes des autres, par des dépôts calcaires plus ou moins développés et par des pôles plus ou moins aigus.
Deux tendances évolutives apparaissent, elles sont opposées à cause de la spécialisation au milieu.
La première tendance est une évolution vers un allongement axial (majorité des lignées), ce qui est une adaptation à la vie dans les sédiments et à des milieux relativement agités.
La seconde tendance est une évolution vers un raccourcissement axial : la forme est de plus en plus globuleuse. C’est une adaptation à la vie sur les plantes et à des eaux calmes.
On connaît, dans les différentes lignées, tous les stades intermédiaires et la population est toujours homogène (courbe de Gauss unimodale). Au cours des temps, cette courbe se déplace dans le sens du rapport longueur sur largeur (L/l).
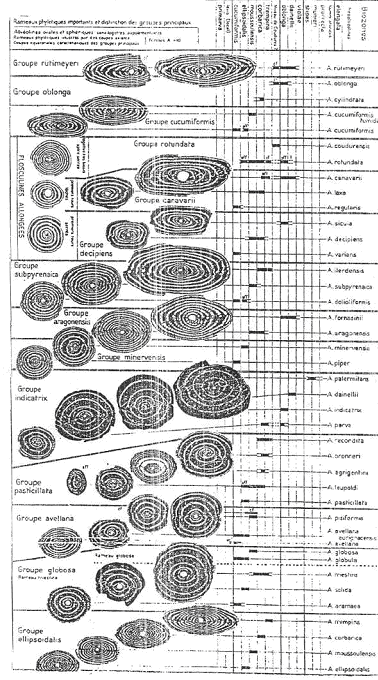
 L’évolution porte donc sur la forme, mais aussi sur la taille. Cette taille augmente au cours du temps. L’évolution tend vers cet accroissement de taille, c’est la « loi » de Cape.
L’évolution porte donc sur la forme, mais aussi sur la taille. Cette taille augmente au cours du temps. L’évolution tend vers cet accroissement de taille, c’est la « loi » de Cape.
 Ici aussi on trouve des évolutions parallèles. On en déduit que le hasard n’intervient pas seul dans l’évolution.
Ici aussi on trouve des évolutions parallèles. On en déduit que le hasard n’intervient pas seul dans l’évolution.
 La même tendance évolutive apparaît sur l’échelle des genres et sur un intervalle beaucoup plus long (macroévolution).
La même tendance évolutive apparaît sur l’échelle des genres et sur un intervalle beaucoup plus long (macroévolution).
Au crétacé, Ovalveolina  Préalveolina
Préalveolina  Subalveolina.
Subalveolina.
A l’éocène, Globalveoline  Alveolina
Alveolina  Alveolinella.
Alveolinella.
A l’échelle de la macroévolution, on passe d’un genre à l’autre sans intermédiaire.
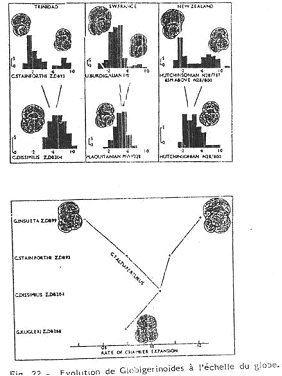
3 Les globigérinoïdés (foraminifères planctoniques) du miocène inférieur (–20 à –11 MA).
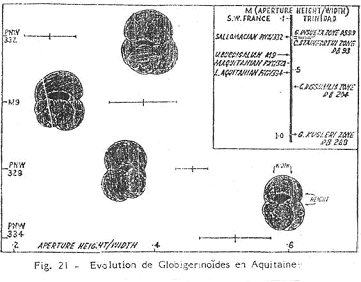
Les globigérinoïdés sont dans les mers chaudes.
Ici, l’évolution porte sur la forme de l’ouverture. Dans la lignée de Trilobas, l’ouverture est de plus en plus aplatie. Sur la lignée d’Altiaperturgus, la tendance est inverse et l’ouverture est de plus en plus haute.
Ces globigérinoïdés se retrouvent sur tout le globe. Cela semble être du à des changements du niveau marin.
C Conclusions.
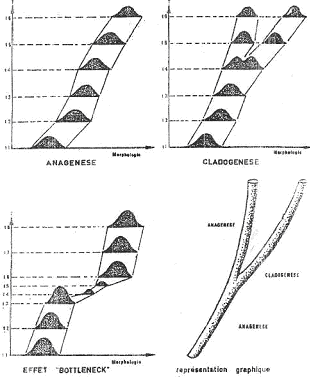
Cette évolution graduelle se fait selon deux modalités distinctes :
- L’anagenèse. C’est la transformation progressive, dans le temps, d’une seule lignée par la dérive morphologique de la population  la sélection joue au niveau des individus.
la sélection joue au niveau des individus.
- La cladogenèse. C’est l’éclatement d’une lignée en plusieurs rameaux qui sont généralement divergent. Les causes peuvent être des facteurs géographiques ou écologiques. On peut citer l’exemple des coquilles St Jacques. Jusqu’à il y a 5 millions d’années, il n’y avait pas Panama qui rattachait l’Amérique du nord à l’Amérique du sud et ces coquilles St Jacques étaient partout les mêmes. Quand l’isthme s’est créé, il y a eu évolution différente des espèces Atlantiques et Pacifiques.
II L’évolution quantique.
A Principe.
L’évolution passe par une alternance de longues phases d’équilibre (stases), pendant lesquelles une espèce ne montre pas de changements notables, et de phases de crises, brèves et qui modifient brutalement une lignée.
L’évolution est réalisée par des sauts successifs, sans individu ni étape intermédiaire. Les discontinuités morphologiques font parti intégrante de l’évolution quantique.
Pour le paléontologiste, une espèce apparaît brutalement puis reste inchangée sur de longues périodes avant d’être remplacée par une autre espèce.
B Exemple : les phacops (trilobites) du dévonien en Amérique du nord.
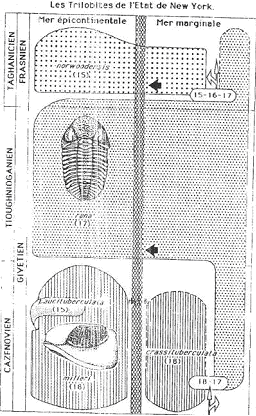
Les trilobites ont des yeux à facettes qui sont disposés en files. Le nombre de files de facettes est un caractère distinctif des facettes et aussi un caractère évolutif.
Dans les trois étages successifs, on a trois populations différentes. Dans chacune d’elle, tous les individus ont le même nombre de files de facette et il n’y a aucune modification sur la durée de l’étage.
III L’évolution itérative.
L’évolution itérative est la répétition durant les temps géologiques du même motif évolutif.
A L’anagenèse itérative.
1 Exemple de Lépidocyclina (orbitoïdés) du tertiaire.
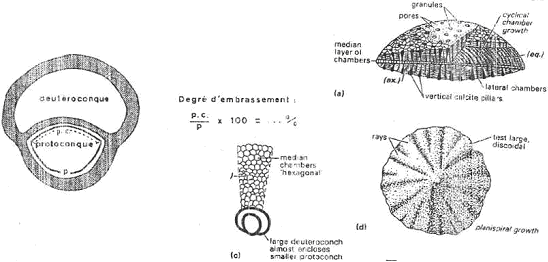
Ce sont des foraminifères benthiques. Cette évolution porte sur l’embryon qui est formé de deux loges appelées protoconque et deutéroconque. L’évolution correspond à l’embrassement progressif de la protoconque par la deutéroconque. Ce paramètre peut être quantifié et exprimé en degrés d’embrassement.
2 Exemple d’évolution.
L’évolution s’accompagne d’un accroissement de la taille de l’embryon. Cela permet une augmentation des possibilités de dispersion. La même évolution a été observée en Amérique, en Asie et en Australie mais, ces mêmes tendances évolutives apparaissent avec de forts décalages chronologiques.
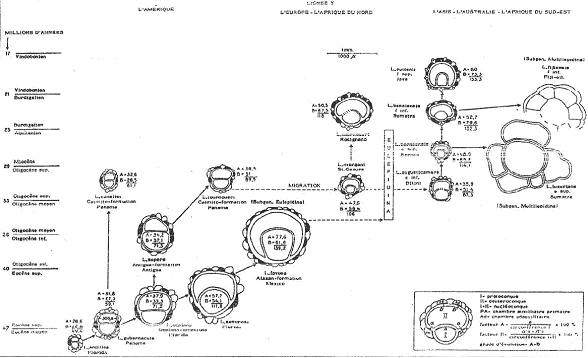
Aux Etats-Unis, on trouve une valeur de 49,4 vers 50 millions d’années et 139,2 vers 32 millions d’années. En Asie, on trouve 87,3 vers 30 millions d’années et 132 vers 24 millions d’années. Cette évolution se fait dans des domaines géographiques distincts. On peut trouver des anagenèses itératives dans une même région, soit par des adaptations plus ou moins rapides au même biotope, soit par le relais de lignées successives.
Cette évolution se fait dans des domaines géographiques distincts. On peut trouver des anagenèses itératives dans une même région, soit par des adaptations plus ou moins rapides au même biotope, soit par le relais de lignées successives.
B Cladogenèse itérative.
L’exemple des foraminifères planctoniques du tertiaire.
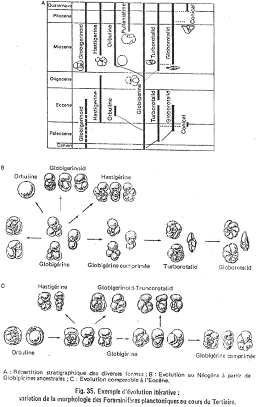
Attention, cet exemple porte sur des genres différents, c’est donc plutôt de la macroévolution.
On peut distinguer deux grandes crises biologiques : la crise crétacé-tertiaire et la crise de la limite éocène-oligocène. On observe deux fois le même modèle évolutif. On part d’un type de base, non spécialisé : Globigérine. A partir de là, plusieurs lignées se différencient (ce sont des adaptations aux profondeurs d’eau) :
- Type Orbuline : c’est une sphère, adaptée à la surface.
- Forme carénée et conique : Globorotalid, adaptée à la profondeur.
Le seconde alvéole est plus accomplie que la première.
Cette diversification, liée à la spécialisation à des environnements différents est appelée « radiations adaptatives ». Elles peuvent se répéter plusieurs fois au cours des temps.
C Conclusion.
Ces exemples d’évolution itérative prouvent qu’il y a une certaine orientation dans l’évolution : c’est « l’orthogenèse ».
On observe cette direction car l’évolution est un compromis entre les potentialités des organismes et les contraintes mécaniques de l’environnement : « prédétermination de l’évolution ».
La spécialisation dans un milieu demande un certain type d’évolution car il n’y a pas de nombreuses solutions.
Les modalités de la spéciation.
La spéciation est la création d’espèces.
Il existe différents modèles théoriques en fonction des conditions géographiques.
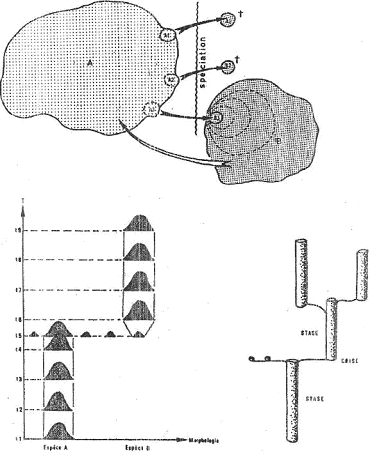
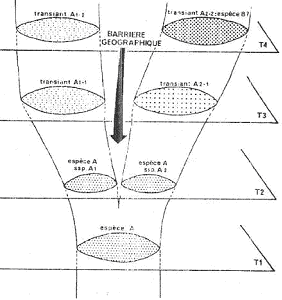
• La spéciation péripatrique.
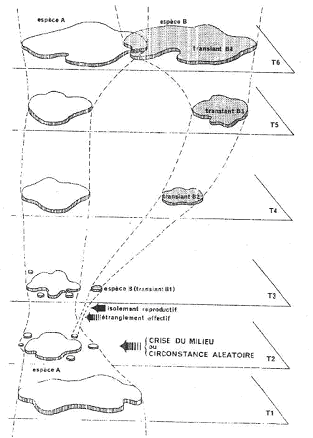
Dans ce cas, la création d’une nouvelle espèce se fait par isolement d’une population périphérique dans l’aire de peuplement de la population initiale.
• La spéciation allopatrique.
C’est la création d’une nouvelle espèce par migration d’une population ou par une division géographique de la population en deux espèces.
• Spéciation sympatrique.
Il y a création d’une nouvelle espèce, sur place.
I Spéciation péripatrique.
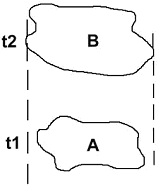
Ce type de spéciation est le plus fréquent. La création de la nouvelle espèce passe par trois phases principales.
A Phase de désorganisation du pool génétique.
Voir t2 du premier schéma du chapitre.
De petites populations sont séparées par des circonstances exceptionnelles ou aléatoires, ou par des modifications générales du milieu.
La population se trouve très réduite (un microdème) et ne renferme qu’une petite partie du patrimoine génétique. Ces populations sont en général déstabilisées puis s’éteignent.
Parfois, elles parviennent à survivre en se restructurant.
B Phase de restructuration et d’isolement reproductif.
La restructuration chez de petits effectifs est une propagation rapide dans cet effectif des modifications sur les populations.
La restructuration a surtout lieu au niveau génétique, par mutation et recombinaison sur des gènes structuraux ou régulateurs, ou bien, au niveau chromosomique (fusion, fission, inversion).
Ces changements ont des implications au niveau biochimique, physiologique (métabolique) et du développement (ontogénétique).
D’autres implications, externes, au niveau écologique, ou au niveau éthologique (comportement).
Ces modifications entraînent l’isolement reproductif. Cette étape est très brève et porte sur des microdèmes.
En conséquence, on ne trouvera pas de témoignage fossile.
C Phase de réorganisation après l’isolement reproductif.
La réorganisation peut se poursuivre avec des changements morphologiques importants, alors que se régénèrent des populations à gros effectifs, des macrodèmes. L’isolement géographique n’est plus nécessaire.
La durée de cette phase est très variable :
- Elle est inexistante chez les espèces jumelles.
- Elle est longue dans certains cas et c’est alors une évolution graduelle (anagenèse) qui adapte progressivement la nouvelle espèce à son milieu.
Cette phase serait essentiellement contrôlée par les déplacements au cours des temps des différents stades de croissance. C’est cette phase que l’on observe généralement en paléontologie.
L’espèce va avoir trois devenirs possibles :
- L’environnement est stable. L’espèce est en équilibre avec son milieu, il n’y a pas d'évolution (stase).
- L’environnement change modérément. Il n’y aura pas de grande diminution des effectifs. On a alors une nouvelle anagenèse sans isolement reproductif.
- Le milieu subit des changements importants. Il va y avoir isolement de petites populations, c’est un nouveau cycle qui commence. On a de nouveaux microdèmes qui subiront une nouvelle phase de spéciation.
II La spéciation allopatrique.
Ce type de spéciation affecte les macrodèmes.
A Contrôle en haltère.
Une espèce à grande répartition géographique va se scinder en deux ensembles par création d’une barrière géographique. Les échanges de gènes vont être interrompus. Si les conditions de milieu sont différentes pour les deux groupes, on passe directement à la phase 3 (réorganisation et restructuration). Les deux populations vont diverger graduellement en faisant une cladogenèse. On obtiendra alors des sous-espèces différentes (ou races géographiques) mais à la longue, on pourra obtenir des espèces différentes qui ne peuvent plus se croiser.
B Le modèle de chaîne des sous-espèces.
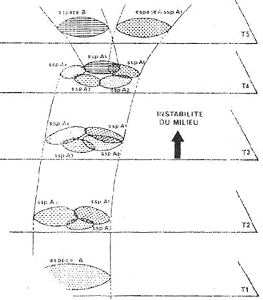
Dans une espèce, se crée, par des migrations et par des étapes successives, des sous-espèces à effectifs comparables.
Ces sous-espèces ont des petites différences génétiques. Avec le temps, les différences s’accumulent et, à la longue, elles peuvent aboutir à la disparition de l’interfécondité dans un des groupes qui devient alors une espèce distincte.
III La spéciation sympatrique.
A L’anagenèse.
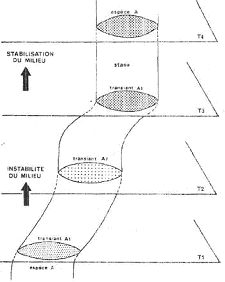
On a une lignée ou un milieu qui devient instable. Si les effectifs ne se divisent pas, on a directement la phase 3 de réorganisation jusqu’à ce que l’espèce retrouve une nouvel équilibre.
 C’est une évolution graduelle.
C’est une évolution graduelle.
B La spéciation par étranglement.
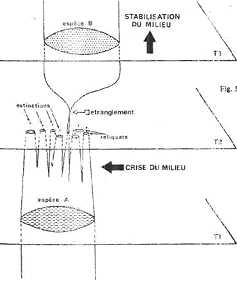
Le milieu subit une crise importante qui crée une fragmentation brutale en plusieurs microdèmes résiduels. Généralement, ils disparaissent tous au bout d’un moment.
Parfois, une des populations donne naissance à une nouvelle espèce par l’enchaînement des trois phases de la spéciation.
 C’est l’évolution quantique.
C’est l’évolution quantique.
IV Conclusion.
La spéciation comprend fondamentalement trois phases (A, B, C). Cette séquence implique :
- Une variation des effectifs (faibles en 1 et 2 ; forts en 3).
- Des durées variables (courtes en 1 et 2 ; longue en 3).
Ces variations sont contrôlées par le milieu extérieur qui détermine les modalités de la spéciation.
Les processus ontogénétiques dans l’évolution.
Ces processus forment un lien entre le développement de l’individu et la lignée phylogénique.
I Ontogenèse et phylogenèse.
A La coquille d’un céphalopode actuel.
Exemple : le nautile.
Le nautile est un animal qui vit dans sa dernière loge (chambre d’habitation). L’avant-dernière est remplie d’eau et de gaz ; les autres sont remplies d’air.
Au stade embryonnaire, l’animal vit dans sa protoconque (première loge). En grandissant, il va créer sa coquille en sécrétant à l’arrière de son corps, des cloisons successives.
 Le nautile garde intactes, jusqu’à la fin de sa vie, toutes les phases de croissance de sa coquille. On peut y retrouver des stades embryonnaires, juvéniles, adultes et même séniles.
Le nautile garde intactes, jusqu’à la fin de sa vie, toutes les phases de croissance de sa coquille. On peut y retrouver des stades embryonnaires, juvéniles, adultes et même séniles.
Il en est de même pour les ammonoïdés.
B Les sutures des ammonoïdés.
Les sutures des ammonoïdés sont plissées. Elles sont toujours successives sur une même coquille.
Sur les formes les plus anciennes (agoniatites), on trouve trois lobes fondamentaux (les protolobes).
Chez les espèces un peu plus évoluées (koenenites), on voit qu’il apparaît au stade adulte, des lobes complémentaires (les métalobes) qui se développent au dépend de la selle (ombilicale, latérale). Lobes et selles sont simples.
Sur les prolecanitida, les métalobes se multiplient et commencent à être denticulés (suture type cératite).
Chez les ceratitida (permien-trias), les denticulations des lobes s’accentuent et peuvent même atteindre les selles.
Les ammonoïdés du jurassique et du crétacé présentent des lobes et des selles qui sont denticulés avec des éléments généralement nombreux.
Les koenenites présentent une seconde cloison qui n’a que les trois protolobes, identiques aux agoniatites adultes.
Chez lytocératidea (crétacé-jurassique), la seconde cloison a des lobes et des selles non découpées, à éléments peu nombreux : peu de protolobes et de métalobes. Sur la 9ème cloison, on constate que le lobe commence à se denticuler. Cette denticulation va gagner les lobes et toutes les selles.
 La coquille d’un individu reprend l’histoire de la suture des ammonoïdés.
La coquille d’un individu reprend l’histoire de la suture des ammonoïdés.
C Ontogenèse.
Chez les ammonoïdés primitifs, le goulot est rétrosiphonné. Chez les formes plus évoluées, le goulot est prosiphonné (vers l’avant).
On connaît au permo-trias, une ammonite (tropite) où le goulot est rétrosiphonné sur les premières cloisons et devient prosiphonné par la suite.
D Synthèse.
Il existe un parallélisme entre le développement d’un organisme à ses divers stades de croissance et les étapes successives de l’histoire d’une lignée.
Haeckel : « L’ontogenèse récapitule la phylogénie ». (Bof !)
 La phylogenèse correspond à la succession de séquences ontogénétiques.
La phylogenèse correspond à la succession de séquences ontogénétiques.
II Définition et identification de l’ontogenèse.
Ontogenèse : processus permettant le passage du génotype au phénotype jeune puis au phénotype adulte.
En paléontologie, on ne connaît pas le passage « génotype  phénotype jeune ». Toutefois, on connaît le passage « phénotype jeune
phénotype jeune ». Toutefois, on connaît le passage « phénotype jeune  phénotype adulte » et la succession des phénotypes au cours des temps géologiques.
phénotype adulte » et la succession des phénotypes au cours des temps géologiques.
On va analyser l’ontogenèse en comparant des jeunes et des adultes qui se succèdent au cours des temps.
Trois paramètres sont utilisés :
- Morphologie et taux de changement.
- Age biologique : intervalle entre la fécondation et la vie qui est étalonné par un événement comme la naissance, l’acquisition de la maturité sexuelle et la fin de la croissance.
- Taille et taux de croissance. En général, la taille est étroitement corrélée avec l’âge : évolution de l’âge relatif.
On étudie l’ontogenèse en analysant les modifications au cours des temps entre la taille et la morphologie.
III Modification ontogénétique et rôle dans l’évolution.
A Le nanisme et le gigantisme.
Nanisme et gigantisme sont deux modifications du taux d’accroissement de la taille : réduction ou augmentation du volume corporel maximal sans modification de l’âge et de la forme. (la maturité sexuelle arrive au même moment).
Exemple : Leithera, cerf de Crête.
Durant le quaternaire, dans les îles de la méditerranée par rapport aux animaux continentaux, les petits mammifères sont plus grands et les grands mammifères de ces îles sont plus petits que les grands mammifères continentaux.
Le cerf de Crête est deux fois plus petit mais il a aussi une forme différente.
B Les hétérochronies du développement.
Les hétérochronies de ce type sont des décalages qui altèrent la séquence ontogénétique d’un descendant par rapport à son ancêtre. Si un groupe de gènes entre en action à un moment différent de l’ontogenèse, le phénotype sera modifié. Une hétérochronie se manifeste par un déplacement ou l’apparition d’un caractère entre l’ancêtre et les descendants.
De tels mécanismes peuvent provoquer de manière quasi-instantanée des transformations morphologiques importantes avec de petites mutations génétiques.
1 L’accélération et la néotémie.
Dans le cas d’une accélération ou de néotémie, il y a uniquement une modification du taux de changements de forme. La taille adulte est la même que chez l’adulte ascendant. La fin de la croissance se fait sûrement au même âge biologique. Le développement somatique va être accéléré ou ralenti.
Une accélération provoque un développement plus rapide. L’ensemble des étapes de croissance de l’ancêtre est condensé en un stade du développement du descendant.
En fin de développement, on observe alors une morphologie nouvelle.
Exemple : Infulaster/Hagenovia.
Globalement, l’animal a la même taille. A volume égal, c’est la morphologie qui change.
La néotémie : c’est le développement somatique qui est ralenti. Les stades juvéniles d’ancêtres restent à l’état adulte des descendants  les derniers stades du développement vont disparaître.
les derniers stades du développement vont disparaître.
Exemple : Actinodon/Gerrothorax.
Actinodon, au stade adulte, a un crâne qui devient allongé. Le descendant (Gerrothorax), au stade adulte, a son crâne qui est élargi.
2 L’hypermorphose et la progenèse.
Hypermorphose et progenèse sont des hétérochronies qui affectent l’âge. Le moment de la maturité sexuelle et la fin de la croissance sont décalés (chez les descendants).
Ici, il y a retardement : la taille atteinte par l’adulte descendant est plus grande que celle des ancêtres.
La progenèse : la maturité sexuelle est avancée : l’adulte descendant sera plus petit que l’adulte ancestral.
L’hypermorphose provoque une augmentation de la croissance et un allongement de la vie.
La progenèse va entraîner une diminution de croissance accompagnée d’une diminution de la durée de vie.
Ces deux phénomènes ont respectivement :
- Les mêmes effets sur la morphologie que l’accélération et la néotémie.
- La corrélation taille/forme est inchangée pour accélération et néotémie alors que pour l’hypermorphose et la progenèse, le changement de forme s’accompagne d’un changement de taille.
Exemple d’hypermorphose : Captorhinus/Moradisaurus (reptiles du permien).
Au permien inférieur, on trouve captorhinus, reptile de petite taille avec 3 à 4 rangées de dents sur les maxillaires supérieurs.
Au permien supérieur, son descendant est Moradisaurus qui a une plus grande taille et une dizaine de dents sur les maxillaires supérieurs.
On constate que chez Captorhinus, la durée de vie est plus courte (ossification incomplète). Chez Moradisaurus, cette ossification est plus complète : sa vie est donc plus longue.
 L’augmentation de la durée de vie est réalisée avec l’apparition d’une ou plusieurs tranches supplémentaires d’ontogenèse.
L’augmentation de la durée de vie est réalisée avec l’apparition d’une ou plusieurs tranches supplémentaires d’ontogenèse.
Exemple de progenèse : oursins, Clypeasteroïdés.
Ces oursins descendent des cossiduloïdés (mésozoïque) à vie enfouie (sédiments vaseux), sans mâchoire à l’état adulte. Le premier représentant des clypeasteroïdés est un petit oursin (identique à un jeune casiduloïdé) pourvu de dents à l’état adulte. L’évolution les fait ensuite vivre sur les sédiments.
Ces quatre hétérochronies peuvent être regroupées en deux modes :
• La péramorphose.
La maturité sexuelle et l’arrêt de la croissance apparaissent à des stades plus tardifs du développement somatique. On aboutit à des « hyper adultes ». La séquence ontogénétique du descendant récapitule la phylogenèse : c’est dans le descendant juvénile que l’on trouvera l’image de l’ancêtre adulte. Ce mode correspond à des évolutions à long terme (très fréquentes) et qui réalisent progressivement les potentialités d’une lignée.
• La pédomorphose.
La maturité sexuelle arrive à des stades plus précoces du développement somatique. La séquence ontogénétique de la forme ancestrale annonce les étapes futures de la phylogenèse. Le descendant adulte donne l’image de l’ancêtre juvénile : « récapitulation inverse ». Cette évolution ne joue que sur un court terme. Elle peut permettre de relancer l’évolution par une spéciation dans une autre direction.
3 Les associations d’hétérochronies.
Toutes ces hétérochronies peuvent se combiner du fait de l’indépendance possible du développement germinal par rapport au développement somatique. On a quatre combinaisons possibles :
- Progenèse néotémique. On associe la plus grande précocité de la maturité sexuelle à un développement somatique ralenti.
- Hypermorphose accélérée. On associe un retard de la maturité sexuelle à une accélération des diverses phases de développement.
 Ces deux combinaisons ont un effet amplificateur.
Ces deux combinaisons ont un effet amplificateur.
Exemple d’hypermorphose accélérée : Aegoceras.
L’ancêtre a une coquille à côtes simples. Les descendants ont une ornementation plus complexe (tubercules et côtes subdivisés).
- Progenèse accélérée. La plus grande précocité de la maturité sexuelle (diminution de l’âge) est associée à un raccourcissement des diverses phases de développement du corps.
- Hypermorphose néotémique. On prolonge l’âge biologique par un retard de la maturité sexuelle et on l’associe à un développement somatique ralenti.
Exemple d’hypermorphose néotémique : évolution des primates.
Le jeune chimpanzé et l’australopithèque ont un crâne arrondi avec un os frontal redressé et des mandibules de petite taille. Au cours de la croissance, le crâne devient de plus en plus anguleux avec la mandibule de plus en plus forte.
Chez l’Homme, la morphologie du crâne ne se modifie pas : l’état adulte rappelle la morphologie juvénile de « l’ancêtre ».  C’est une néotémie.
C’est une néotémie.
Toutefois, il se produit parallèlement chez l’Homme, une augmentation générale de la taille, due à une croissance prolongée et un retard de la maturité sexuelle (et un allongement de la durée de vie).
4 Les innovations.
Les innovations correspondent à l’apparition, chez les descendants, de caractères morphologiques nouveaux, qui n’étaient pas connus chez l’ancêtre et qui supplantent les caractères ancestraux d’une des phases du développement.
Les causes peuvent être :
- La traduction sur le génotype d’une modification du génotype.
- Le réveil d’un caractère génotypique masqué.
 Innovation précoce.
Innovation précoce.
Dans ce cas, un caractère nouveau apparaît au début du développement.
Exemple : Liparoceras, Beaniceras.
Liparoceras est une ammonite avec des tubercules et des côtes subdivisées, et ceci, à tous les stades du développement. Il en descend le genre baeniceras.
Dans les premiers tours, les côtes sont simples (juvéniles) et au stade adulte, apparaît une ornementation plus complexe.
 Innovation tardive.
Innovation tardive.
Le nouveau caractère apparaît à la fin de la croissance.
Exemple : Oistoceras (ammonite).
L’ancêtre possède des côtes simples qui se continuent sur le bord externe.
Chez certains descendant, on voit chez les adultes, un redoublement des côtes et l’ébauche d’une carène.
5 Les associations : innovations-hétérochronies.
Les hétérochronies peuvent atténuer les effets des innovations. Cela se produit dans le cas où l’on associe une accélération avec une innovation précoce et une néotémie avec une innovation tardive. Les effets d’accentuation sont obtenus dans le cas : d’une néotémie associée avec une innovation précoce ou d’une accélération avec une innovation tardive.
 Néotémie + innovation précoce.
Néotémie + innovation précoce.
Exemple : Liparoceras/Aegoceras.
L’innovation des côtes simples gagne sur l’ensemble de la coquille dans le genre Aegoceras.
 Accélération + innovation tardive.
Accélération + innovation tardive.
Le raccourcissement des premiers stades de l’ontogenèse permet à l’innovation tardive de s’étendre jusqu’à des stades précoces du développement.
Exemple : Oisteras/Amaltéhus.
Les côtes sont dédoublées et gagnent sur toute la coquille.
6 Hétérochronies et rythmes d’évolution.
Les accélérations, les hypermorphoses et les néotémies s’enchaînent de manière continue et donnent des évolutions graduelles (ou adaptatives).
La progenèse a lieu dans des cas d’évènements isolés, accidentels, qui coïncident avec des crises à partir desquelles vont se développer d’autres tendances : évolution quantique. Ce sont les causes des changements fondamentaux et elles sont à la souche des grandes lignées.  Evolution narratrice.
Evolution narratrice.
Synthèse : Evolution et Milieu.
L’évolution est la réponse de la vie, avec des essais avortés ou réussis, à la pression du milieu. Dans le milieu, on distingue deux aspects :
- L’aspect d’un milieu extérieur à l’espèce : milieu physico-chimique et biotique.
- L’aspect d’un milieu intérieur à l’espèce : la concurrence entre les individus crée la sélection naturelle.
Si le milieu est stable, la population est stable (stase) où elle subit une pression orientée (auto-sélection) qui va créer une anagenèse.
Si le milieu est instable, on a des crises, des évolutions irrégulières et des cladogenèses.
I Evolution et mode de vie.
• Le plancton.
En milieu marin, le plancton a une évolution continue, régulière où il vit avec une masse d’eau ayant des caractéristiques physico-chimiques constantes en se déplaçant avec elle.  Le plancton est placé de manière favorable pour avoir une évolution régulière et continue.
Le plancton est placé de manière favorable pour avoir une évolution régulière et continue.
• Le necton.
Le necton a une évolution continue, régulière. Il est susceptible de partirà la recherche d’environnements propices. Il montre effectivement le type d’évolution annoncée.
• Le benthos de plate-forme.
Le benthos de plate-forme présente une évolution irrégulière et saccadée. Il est soumis à un milieu changeant.
• Les peuplements bathyaux ou abyssaux.
Ces peuplements ont une évolution faible ou nulle. Les changements de milieu sont quasi-inexistants. Le milieu est donc très stable avec une faible densité de population. Le taux d’évolution est faible ou nul.
II Evolution et stratégie de vie.
Pour survivre, les organismes peuvent adopter deux types de stratégies de vie.
A Stratégie « r ».
- Les formes non-spécialisées,
- Le taux de fécondité élevé,
- Rapide renouvellement des générations (maturité sexuelle précoce, courte durée de vie),
- Petite taille.
 Espèces opportunistes à stratégie de gaspillage, créée par la progenèse.
Espèces opportunistes à stratégie de gaspillage, créée par la progenèse.
B Stratégie « K ».
Cette stratégie correspond à une exploitation optimale du milieu. Les formes spécialisées ont :
- Des effectifs réduits,
- Un faible taux de fécondité,
- Un renouvellement lent des générations,
- Une maturité sexuelle tardive et une longue durée de vie,
- De grande taille.
 Ce sont des espèces d’équilibre. Elles sont créées par hypermorphose (retardement de la maturité sexuelle).
Ce sont des espèces d’équilibre. Elles sont créées par hypermorphose (retardement de la maturité sexuelle).
C Les changements de stratégie.
Les types « r » et « K » sont extrêmes mais il existe tous les intermédiaires et un groupe peut changer de stratégie dans l’espace et le temps pour assurer sa survie.
1 Changements au cours des temps.
Au niveau de la macroévolution ou de la microévolution, on passe progressivement d’une stratégie « r » à une stratégie « K » : c’est ce qui donne les lois classique de l’évolution.  Loi d’accroissement de la taille, loi de la spécialisation croissante. C’est le cas des céphalopodes, des alvéolines.
Loi d’accroissement de la taille, loi de la spécialisation croissante. C’est le cas des céphalopodes, des alvéolines.
2 Changements dans l’espace.
Pour une espèce donnée, les milieux qui sont les plus favorables sont occupés par des individus à tendance « K » (= population centrale). Les milieux peu propices sont généralement occupés par des populations à tendance « r » (= population marginale).
Ce sont les stratégies « r » qui permettent les évolutions de l’espèce.
3 Changements circonstanciels.
Pendant une période favorable avec un environnement stable, une population favorise la stratégie « K » pour mieux utiliser le milieu.
S’il se produit une crise, c’est à ce moment que la lignée tend alors à adopter la stratégie « r ». L’intérêt de cette stratégie « r » est qu’elle supprime la spécialisation et, en multipliant les générations, elle accroît les possibilités d’innovation et donc, les chances de trouver une bonne réponse aux nouvelles conditions.
III Organismes et crises.
Les diverses stratégies sont bien exprimées au moment des crises qui rythment l’évolution : on a alors trois types de comportements :
- Les exterminées : ce sont toutes les populations qui sont éliminées (population de stratégie « K »).
- Les profiteurs : ils sont rares mais exceptionnellement adaptés aux conditions survenues lors de la crise. Toutefois, ils ne survivent pas à la crise.
- Les survivants : ce type présente aussi trois divisions :
• Les pré-adaptés : ils avaient un caractère leur permettant de franchir la crise (exemple : endothermie des mammifères, stratégie « K »).
• Les généralistes écologiques : ils vivent dans n’importe quelles conditions (stratégie « r »).
• Les taxons « Lazare » : ces organismes ont apparemment disparus lors de la crise. Il y a deux possibilités à leur survie. - Les formes de stratégie « K » ont trouvé localement un refuge qui leur a permis de laisser passer la crise (cas des coraux madréporaires pendant la crise K/T). - Les formes ayant persisté en petit nombre en adoptant la stratégie « r » par la progenèse : ce sont les géniteurs qui sont les plus importants d’un point de vue évolutif car ils créent des lignées nouvelles en reprenant progressivement une stratégie « K ».
Introduction.
Introduction.
La paléontologie est la science qui étudie les êtres vivants disparus mais aussi les restes de ces êtres vivants. On peut rencontrer différents types de fossiles.
A Restes de l’organisme.
1 Conservation des parties molles.
- Organismes congelés (exemple : mammouth).
- Organismes dans de la résine.
- Inclusions d’organismes dans des cristaux de sel (bactéries).
- Peaux minéralisées.
- Momies dans des tourbières.
- Momies dans des bitumes.
2 Conservation des parties dures.
- Squelettes.
- Dents.
- Coquilles.
- Carapaces.
- Tests.
3 Empreintes, moules intérieur/extérieur des parties dures et/ou molles.
- Plumes.
- Ecailles.
- Feuilles.
4 Conservation de cuticule et de chitine.
5 Organismes visibles aux rayons X.
6 Moulages et coupes sériées d’organismes.
 Anatomie comparée.
Anatomie comparée.
B Traces d’activité d’organisme fossiles.
- Traces de logement et de déplacement (figures de turbation). Exemple : terrier, tube, galerie, pistes, pas.
- Empreintes de départ d’organismes sur le fond (méduse d’Ediacara).
- Fossilisation d’excréments (coprolithes) : de crustacés, de vertébrés (continentaux : hyènes).
- Coups de griffe de carnivores sur des os.
- Traces de nutrition (perforation d’éponge).
- Traces de protection (lithophages : pholades).
- Pontes fossiles et stades larvaires.
- Fabrications humaines (outils, …).
C Nomenclature et catégories taxonomiques (en latin).
Exemple : Homo sapiens.
Homo est le genre et sapiens l’espèce. Ces deux mots sont suivis du nom de l’auteur et de l’année de la description. Si le nom est entre parenthèse, c’est que le genre a été changé.
Un taxon est un groupe d’organismes qui constituent une unité de la classification des êtres vivants.
Dans l’ordre, on trouve : le Règne, l’Embranchement (ou phylum), la Classe, l’Ordre, la Famille, le Genre et puis l’Espèce.
Les monères (virus, bactéries, cyanophycées) sont des procaryotes.
Les protistes sont des eucaryotes unicellulaires.
Les animaux, mycètes et végétaux sont des eucaryotes pluricellulaires.
Evolution phylogénique du développement
des caractères ontosomatiques
chez les êtres vivants.
On peut créer une grande subdivision entre les procaryotes et les eucaryotes. Les eucaryotes n’ont pas de noyau, l’ADN est libre et fait de 0 à 20µm. Les eucaryotes ont un noyau différencié.
Les procaryotes sont apparus vers –3,8 milliards d’années ; les premiers eucaryotes sont arrivés, eux, il y a 1,5 milliards d’années. La Terre est âgée de 4,6 milliards d’années et l’O2 est apparu en quantité sur le globe il y a 2 milliards d’années.
1 Les virus.
Les virus sont les êtres vivants les plus élémentaires. Ils sont composés d’un fragment d’ADN ou d’ARN protégé par une membrane.
2 Les procaryotes.
Les procaryotes sont des êtres primitifs dont la taille est inférieure à 40µm. Leur noyau est non différencié et ils tirent généralement leur énergie de la fermentation.
Parmi eux, on trouve les cyanophycées.
3 Les eucaryotes.
Les eucaryotes sont les plus évolués. Leur taille est supérieure à 40µm. Leur noyau est différencié. Ils comportent des organites. Leur processus métabolique central est la respiration. Ils présentent les premières mitoses et méioses.
 Protistes monoblastiques.
Protistes monoblastiques.
Ces espèces ne présentent qu’un feuillet. Leur niveau d’organisation est de type « morula). Il y aurait quelques fossiles.
 Les diploblastiques.
Les diploblastiques.
Les diploblastiques sont constitués de deux feuillets : ectoderme et endoderme. Ces deux feuillets sont séparés par la mésoglée qui contient des cellules digestives, musculaires…
Le blastopore donnera l’anus chez l’adulte.
Parmi les diploblastiques, on trouve les spongiaires et les cœlentérés (coraux).
 Les triploblastiques.
Les triploblastiques.
Chez les triploblastiques, il y a apparition du mésoderme et le début de la céphalisation.
A Les protostomiens.
Le blastopore donne toujours l’anus. Le système est en chaîne ganglionnaire. On distingue plusieurs familles :
- Les acœlomates : mésoblaste non creusé.
- Les cœlomates : mésoblaste creusé. Le cœlome coïncide avec la métamérie (exemple : mollusque, arthropodes, brachiopodes).
B Les deutérostomiens.
• Les épithélioneuriens. Le système nerveux est dorsal, non indépendant (échinoderme).
• Les cordés. Il y a apparition de la corde dorsale qui permet l’apparition d’un système nerveux en tube.
I Caractéristiques générales.
Les protozoaires sont entourés par un test. Ce dernier est de nature variable, aussi bien que la forme. Sa dimension peut aller de quelques millimètres à 10 centimètres.
Les loges communiquent entre elles par le foramen. La forme de l’ouverture extérieure du test est variable.
On distingue trois types de tests :
- Les chitiniques : pas de fossile.
- Les agglutinés arénacés : ils récupèrent des fragments de l’environnement avec du calcaire comme ciment.
- Les calcitiques : la calcite est synthétisée par l’animal. On trouve ici plusieurs groupes : - les microgranuleux qui sont gris, avec des cristaux de calcite de diamètre inférieur à 5µm ; - les porcelanés de couleur de porcelaine (blanc) avec de la calcite crypto-cristalline ; - les hyalins, à gros cristaux, de couleur miel (brun luisant). Souvent, la muraille est perforée de pores qui permettent la sortie des pseudopodes (distinction entre les perforés et les imperforés).
II Les foraminifères benthiques.
A Le groupe des Lituolidae (foraminifères benthiques à test agglutiné).

Ils sont millimétriques, à test libre, généralement aplati et spiralé. Ils peuvent être déroulés et montrent une ouverture en bande.
Ils vivent en milieu marin de haute énergie, de médio à cercalittoral mais aussi dans les eaux saumâtres.
On les trouve du carbonifère à l’actuel.
B Le groupe des Miliolidae (foraminifères benthiques à test porcelané).

Leur coquille est millimétrique, porcelanée, libre, multiloculaire et globuleuse.
Il y a formation d’une lame calcaire qui s’enroule selon un axe. Les cloisons sont formées parallèlement à l’axe. On obtient alors une grande loge découpée en logettes par des cloisons. La communication, possible, est réalisée par des pores.
Les miliolidae sont originaires des mers chaudes, peu profondes, de milieu infralittoral restreint.
Ce sont des marqueurs du tertiaire et existent du crétacé à l’actuel.
C Le groupe des Nummulitidae.
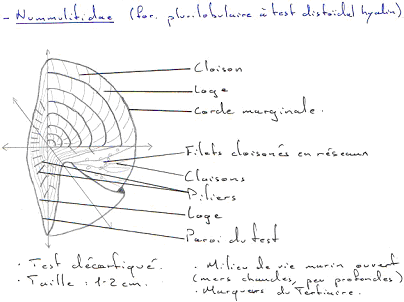
Les Nummulitidae sont plurilobulaires à test distoïdal hyalin. Leur enroulement est le même que celui des Miliolidae mais la spirale est très haute  la lame est subdivisée par des cloisons et le test est renforcé par des piliers.
la lame est subdivisée par des cloisons et le test est renforcé par des piliers.
Leur milieu de vie est marin ouvert et on les trouve dans des mers chaudes, peu profondes.
Ils sont des marqueurs stratigraphiques du tertiaire.
III Les foraminifères planctoniques.
Le test de ces foraminifères est hyalin, perforé ou non, libre, pluriloculaire. L’enroulement est trocospiralé. La forme extérieure est variable.
Il y a apparition de côtes (de carènes) au nombre de 1 ou 2 par loge. La face qui présente l’ouverture est la face ombilicale.
On les trouve dans un milieu marin ouvert océanique planctonique.
On distingue deux familles.
A Globotruncanidae.

Le test est trocospiralé, les chambres sont angulaires ou pétaloïdes. Cette espèce présente des carènes. L’ouverture est sur la face ombilicale.
Ce sont de bons marqueurs stratigraphiques du crétacé supérieur. Ils disparaissent il y a 65 millions d’années (crise KT).
B Globigerinidae.

Le test est trocospiralé ou lobulaire. Les chambres sont sphériques ou ovales. L’ouverture est grande, le test perforé.
Ils apparaissent à la fin du crétacé et durent jusqu’à l’actuel.
I Morphologie.
Les spongiaires sont les plus simples des pluricellulaires. Ce sont des diblastiques de taille comprise entre 1mm et 1-2 mètres. Leur forme est extrêmement variable : croûte (substrat), érigé, coupe, éventail.
Ils ne possèdent ni tissu, ni organe, ni symétrie. Leur croissance est fonction du substrat, de la place disponible et du courant.
On peut dire que les spongiaires sont un sac traversé par un courant d’eau continu. L’endoderme est constitué de choanocytes : cils qui entretiennent un courant d’eau qui rentre par le pore inhalant et qui sort par l’oscule (différent du pore exhalant).
L’ectoderme est constitué par des cellules épithéliales avec un remplissage par une matière colloïdale inerte : la spongine.
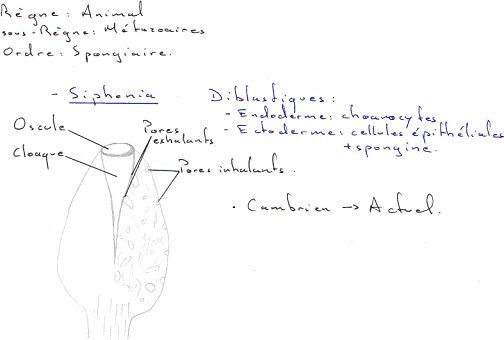
II Les types structuraux.
On distingue trois types structuraux différents chez les spongiaires :
- Ascon : sac ouvert en haut par l’oscule.
- Sycon.
- Leucon : caractérisé par la réunion de plusieurs types sycon.
III Structures de soutien.
Les structures de soutien sont les spicules, de nature siliceuse ou calcaire. Elles peuvent être seules ou regroupées.
IV Classification simplifiée : cf. TP.
V Milieu de vie.
On trouve les spongiaires dans les eaux douces, marines, chaudes ou froides, de l’étage médiolittoral à l’abyssal et même, parfois, dans le milieu récifal.
VI Intérêt.
Les spongiaires apparaissent au cambrien et durent jusqu’à l’actuel. Ils ont quand même un intérêt stratigraphique.
I Morphologie générale.
Les cœlentérés sont des diblastiques. Leur cavité générale (cœlome) et cavité digestive sont confondues. On trouve une seule ouverture qui tient le rôle de bouche et d’anus.
Ils présentent une symétrie radiaire autour d’un axe qui passe par la bouche. Leurs tentacules sont en nombre variable. Ils sont subdivisés verticalement par des septes. Ils existent sous deux formes : polype et/ou méduse.
II Classification simplifiée.
Cf. TP.
III Différences morphologiques entre les tétracoralliaires, les hexacoralliaires et les tabulés.
A Les tétracoralliaires.

Les tétracoralliaires ont un squelette calcaire avec une symétrie de type 4. Le polypier est divisé intérieurement par des septes en nombre multiple de 4.
La face du côté du calice est appelée « face calicifère ». C’est une face bombée.
Parfois, le polypier est fermé par un opercule. Ils apparaissent au cambrien et disparaissent au permien. Les cloisons se supportent les unes aux autres.
B Les hexacoralliaires.
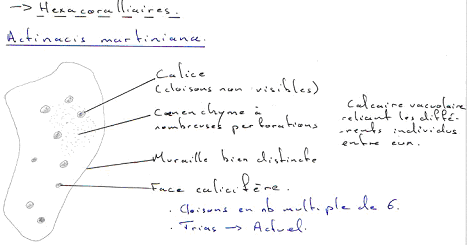
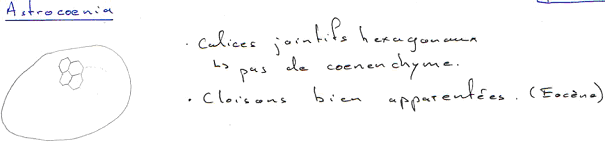
Le polypier est en forme de calice. La face supérieure est la « face calicifère ». L’intérieur est divisé par des septes en nombre multiple de 6. Ces hexacoralliaires vont former des colonies (en milieu récifal).
Au niveau de l’endoderme, il y a symbiose entre le polypier et des algues vertes (zooxanthelles).
Ils apparaissent au Trias et continuent jusqu’à l’actuel.
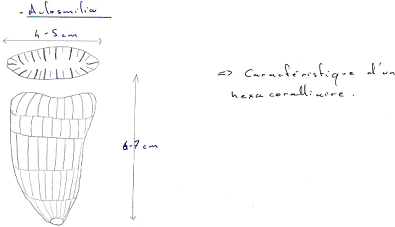
C Les tabulés.
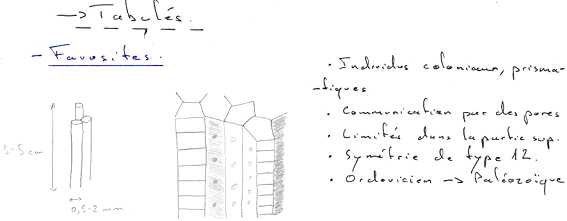
Les tabulés sont toujours coloniaux. Ce sont des individus prismatiques qui communiquent entre eux par des pores ou par des tubes. Ils sont limités dans la partie supérieure du tube.
Ils présentent une symétrie de type 12.
Ils apparaissent à l’Ordovicien et durent jusqu’à la fin du paléozoïque.
IV L’intérêt.
Les cœlentérés ont un intérêt paléoécologique important : ils montrent la variation des niveaux marins.
A Morphologie.
Les brachiopodes sont des bivalves, inéquivalves. La ligne de jonction est appelée ligne de commissure. Les valves sont sécrétées par le manteau. L’eau rentre par la parie frontale. Le lophophore sert à la respiration, la nutrition, l’excrétion, le stockage des graisses et de poche incubatrice.
Formes des valves et squelette du lophophore : voir TP.
Le plan de symétrie est perpendiculaire au plan de commissure.
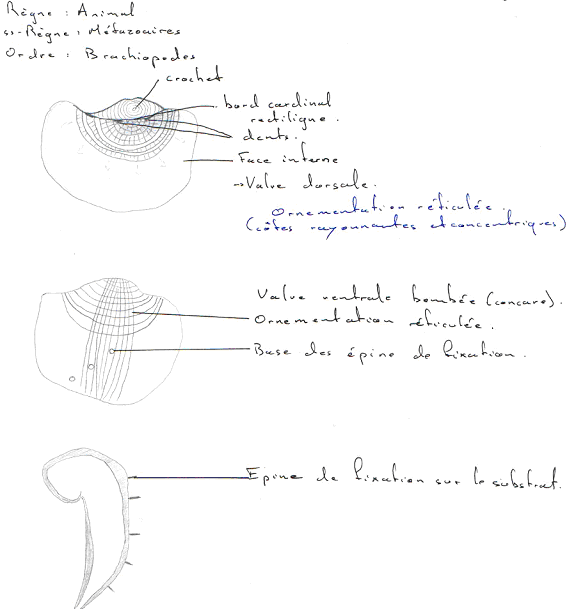
B Vue interne : forme du brachidium.
La charnière est constituée de deux dents sur la valve ventrale qui s’insèrent dans les deux alvéoles (ou fossettes) de la valve dorsale. La coquille s’ouvre grâce aux muscles aducteurs et se ferme grâce aux muscles diducteurs.
On trouve un bourrelet sur la valve dorsale et un sinus sur la valve ventrale.

C Milieu de vie.
Les brachiopodes sont marins, benthiques, épidiontes (rarement endobiontes). Ils occupent tous les habitats présents entre 0 en 200 mètres de profondeur. Actuellement, on trouve certaines formes présentes à –6500 mètres. Ils sont présents sous toutes les températures, sur des milieux sableux, caillouteux.
Leur vie larvaire est planctonique.
D Intérêt.
Les brachiopodes sont connus depuis le cambrien moyen. Ils ont un intérêt stratigraphique pour dater le paléozoïque et le jurassique.
I) Généralités
A) Terminologie
B) Définition
C) Histoire
D) Mode de vie
E) Capacité d'enroulement
II) Description
A) Nomenclature
B) Le céphalon
1) La forme du céphalon
2) La glabelle
3) Les lignes de sutures
4) Les yeux
C) Le thorax
D) Le pygidium
III) L'ontogenèse
A) Définition
B) Représentation graphique théorique
C) Représentation graphique pratique, exemples
Références bibliographiques
Retour à la page d'accueil
Retour à la page des chapitres sur les Trilobites
I) Généralités
A) Terminologie
‘Trilobite' provient de ‘Trilobita' défini par Walch en 1771. Ce nom est tiré du latin « tri » signifiant « trois » et « lobus » qui signifie « lobe ».
B) Définition
Il s'agit d'un groupe d'Arthropode fossiles marins dont le corps était protégé par une carapace divisée longitudinalement en trois lobes : un lobe médian, le rachis, et deux lobes latéraux, les lobes pleuraux (Hupé, 1953) . Les Trilobites sont des organismes exclusivement paléozoïques, bien que la complexité morphologique et la biodiversité au Cambrien laisse supposer une origine au Précambien (faune édiacarienne), mais sans la minéralisation de la carapace (fig.1) (McMenamim, 2000). Leur vaste répartition géographique, ainsi que leur abondance et leur diversification rapide, en font de bons fossiles stratigraphiques et permettent, par leur localisation, de définir des provinces et d'apporter des éléments en paléogéographie (Henry, 1989 ; Pillola, 1996 ).

Fig. 1 : trilobitoïde Spriggina (faune édiacarienne).
C) Histoire
La biodiversité des Trilobites a subi plusieurs phases d'évolution successives durant le paléozoïque (fig. 2). C'est au Cambrien que cette diversité est la plus importante, les Trilobites occupent des niches écologiques très variées, mais à la fin du Cambrien une crise va considérablement la faire diminuer. Une seconde crise à la fin de l'Ordovicien, puis une baisse accélérée de la diversité à la fin du Dévonien se succèdent et amorcent le déclin continu lors du Carbonifère et du Permien, jusqu'à l'extinction à la fin du Paléozoïque. Ces crises successives peuvent avoir plusieurs origines : apparition de prédateurs, destruction d'habitats, concurrence.

Fig.2: variation de la biodiversité des Trilobites au cours du Paléozoïque .
Haut de la page
D) Modes de vie
Les Trilobites semblent avoir occupé un grand nombre de niches écologique (Lebrun, 2002) . Si quelques espèces étaient pélagiques, la grande majorité apparaît comme vivant sur ou à proximité des fonds marins (benthos épibionte), avec pour beaucoup d'entre eux la capacité de s'enfouir en totalité ou partiellement (benthos endobionte).
E) Capacité d'enroulement
Les Trilobites, surtout chez les Calyménidae et Phacopidae, possédaient la capacité de s'enrouler (fig. 3) comme certains Crustacés (Isopodes), Insectes (Blattes) et Myriapodes (Glomérides). Cette capacité pourrait traduire un comportement anti-prédation ayant pour but la protection de la face ventrale (Hupé, 1953), ou une réaction liée à une toxicité du milieu de vie. D'autres théories existent, mais ce sont les deux plus probables . La faculté de s'enrouler s'appelle également la capacité de volvation.

Fig. 3: exemple d'enroulement chez un Calymenidae. Trait = 1mm.
Haut de la page
II) Description
A) Nomenclature
La taille est en moyenne de 2 à 10 cm, bien que les plus grands spécimens peuvent atteindre plusieurs dizaines de centimètres et les stades juvéniles seulement quelques millimètres. Le corps, de forme généralement ovalaire, comprend trois régions légèrement articulées entre elles (fig. 4) . De la partie antérieure à postérieure, on distingue : la tête, ou céphalon, à segments coalescents montrant couramment deux yeux composés situés de part et d'autre d'un renflement axial (glabelle), et la présence de lignes de sutures suivant lesquelles la carapace peut se fendre lors de la mue ; une deuxième région appelée thorax, formé de segments articulés composés par un anneau axial et des plèvres ; la dernière région, le pygidium à segments soudés (Hupé, 1953) .

Fig. 4: nomenclature utilisée pour la description des Trilobites illustrée sur un Eodalmanitina henryi henryi .
Remarque : librigènes = joues libres ; fixigènes = joues fixes ; cranidium = céphalon – joues libres.
B) Le céphalon
Les différents éléments du céphalon, c'est-à-dire glabelle, suture faciale, yeux, anneau occipital, pointes génales et autres, peuvent être de forme ou de taille variable, voir pour certains éléments totalement absent chez certaines espèces. L'ornementation est également très variable selon les espèces, genres ou familles. Dans certaines conditions de fossilisation, il est possible d'observer des antennes.
1) La forme du céphalon
Elle peut avoir plusieurs formes, par exemple, plus ou moins en forme de demi cercle (fig. 5).

Fig. 5 : représentation de la variabilité de la forme du céphalon chez Ectillaenus giganteus (A), Eodalmanitina destombesi destombesi (B) et Eodalmanitina henryi henryi (C).
Haut de la page
2) La glabelle
Elle peut également avoir plusieurs formes entre deux extrêmes : une glabelle dilatée vers l'arrière et rétrécie en avant, ou l'inverse. Les sillons glabellaires et lobes glabellaires sont plus ou moins marqués, en nombres variables, et parfois absents ( fig. 6 ).

Fig. 6 : variation de la forme de la glabelle chez les Dalmanitidae (1 à 5), Calymenidae (6 à 9) et Homalonotidae (10). 1) Crozonaspis kerfornei ; 2) Crozonaspis incerta ; 3) Eodalmanitina aff. macrophtalma ; 4) Dalmanitina aff. actua ; 5) Zeliszkella torrubiae ; 6) Neseuretus tristani ; 7) Platycoryphe heberti ;  Salterocoryphe salteri ; 9) Salterocoryphe salteri salteri ; 10) Kerfornella brevicaudata .
Salterocoryphe salteri ; 9) Salterocoryphe salteri salteri ; 10) Kerfornella brevicaudata .
3) Les lignes de sutures
Il s'agit d'une zone de moindre résistance séparant les joues libres du cranidium (cranidium = céphalon – joues libres). Elles peuvent avoir différentes positions ou être absente chez les spécimens aveugles (fig. 7).

Fig. 7: positions des lignes de sutures: 1) opisthopaire; 2) gonatopaire; 3) propaire; 4) marginale; a) hypostome; b) rostrum.
Remarque : L'hypostome est la pièce qui cachait la bouche de l'individu.
Haut de la page
4) Les yeux
Il existe trois types d'œil : l'oeil abathochroal, holochroal, et schizochroal. Les yeux de types holochroal sont constitués d'un grand nombre d'yeux simples appelés ‘ocelles' (comme celles des insectes) et disposées en forme de nid d'abeille (fig.  . Il s'agirait d'une forme primitive. Le type schizochroal (uniquement chez les Phacopida) semble mieux adapté et plus performant par la présence d'ocelles différentes. Le type abathochroal semble être intermédiaire entre les deux précédents et le nombre d'ocelle plus faible. Attention, il ne s'agit là que d'une définition très simplifiée, il existe d'autres différences, mais un peu plus pointues.
. Il s'agirait d'une forme primitive. Le type schizochroal (uniquement chez les Phacopida) semble mieux adapté et plus performant par la présence d'ocelles différentes. Le type abathochroal semble être intermédiaire entre les deux précédents et le nombre d'ocelle plus faible. Attention, il ne s'agit là que d'une définition très simplifiée, il existe d'autres différences, mais un peu plus pointues.

Fig. 8 : œil d'un Dalmanitidae en gros plan pris au MEB (Microscope Electronique à Balayage). Ocelles visibles sur la surface visuelle. Trait = 2mm.
Remarque : sur cette photo nous pouvons voir la suture faciale propaire et observer une pointe génale cassée en bas à droite.
Les yeux peuvent être de taille variable, ils sont plus ou moins grands (fig. 9).

Fig. 9 : variabilité de la taille des yeux. 1) Illaenidae; 2) Dalmanitidae. Taille du trait = 2mm.
Haut de la page
C) Le thorax
Le thorax est divisé en plusieurs segments thoraciques selon le stade ontogénétique de l'individu. A chaque stade, un nouvel anneau thoracique et deux plèvres sont ajoutés au thorax (fig. 10).

Fig. 10 : représentation du thorax en vue dorsale.
Du côté ventral le thorax abritait les exopodites (branchies) et endopodites (utilisé pour la locomotion).
Haut de la page
D) Le pygidium
Les pygidium peuvent également présenter différentes formes : par exemple, sur la figure 11 celle du Illaenidae (B) est circulaire, tandis que celle du Dalmanitidae (C) est plutôt triangulaire. De même, ils sont plus ou moins complexes : le pygidium de l'individu B est un des plus épuré que nous pouvons observer, il ne possède pas de côte, pas de sillon axial, pleural et interpleural. Il n'a aucune ornementation ni pointe terminale, le rachis n'est même pas clairement délimité. Le pygidium de A, C et D sont plus marqués et présentent plus d'éléments. L'épine terminale visible sur le spécimen D et deviné sur le A, n'est pas présente chez tous les trilobites et peut être de taille variable selon les espèces qui en possèdent une.

Fig. 11 : représentation de la variabilité de la forme et de la complexité du pygidium. A) Dalmanitidae ; B) Illaenidae ; C) Dalmanitidae, D) Dalmanitidae.
III) L'ontogenèse
A) Définition
L'ontogenèse des Trilobites se fait de manière discontinue, par mues successives (mues ou exuvies). Elles peuvent être effectuées à partir de plusieurs zones de moindre résistance comme les sutures faciales ou la jonction céphalo-thoracique. Ces périodes de mues sont très importantes car elles représentent une période pendant laquelle le trilobite est d'avantage exposé aux prédateurs. Avant le stade adulte, lors de chaque mue, un segment thoracique est libéré par le pygidium et contribue à la croissance de l'organisme. (Lebrun, 2002, Hupé, 1953).
Le développement des Trilobites est divisé en trois grandes phases :
Stade protaspide (ou protaspis) : il concerne les premiers degrés de développement, c'est-à-dire de l'éclosion jusqu'à l'apparition d'une articulation transversale, la carapace est alors séparée en deux boucliers, un céphalon et un pygidium primitifs.
Stade méraspide (ou meraspis) : phase de développement débutant à l'apparition de l'articulation céphalo-pygidiale et se terminant lorsque tous les segments thoraciques sont acquis. Ce stade est divisé en plusieurs degrés correspondant au nombre de segments thoraciques que possède le spécimen. Exemple : un individu comportant 3 éléments thoraciques sur 11 possibles sera noté M3 pour « méraspis stade 3 » (fig. 12).
Stade holaspide (ou holaspis) : lorsque le nombre de segments thoraciques propre à l'espèce est atteint, l'organisme entre en phase adulte et ne développe plus sa forme mais uniquement sa taille par exuviation, c'est-à-dire par mue (Hupé, 1953).

Fig. 12 : illustration du développement par ajout de segments thoraciques à chaque mues. Exemple d'une espèce à 11 segments.
Remarque : il est important de bien comprendre que le stade adulte (Holaspis) est atteint à un nombre variable de segments thoraciques suivant les espèces. Par exemple l'espèce Ectillaenus giganteus adulte ne possède que 10 segments thoraciques, Eodalmanitina chillonensis 11, alors que Neseuretus tristani adulte en possède 13.
Haut de la page
B) Représentation graphique théorique
La croissance post embryonnaire discontinue par mues successives aboutit à l'isolement des divers stades ontogéniques. De ce fait, lorsque l'on reporte sur un diagramme bivarié deux dimensions morphologiques, telle que la largeur d'un sclérite en fonction de sa longueur, la courbe de croissance est discontinue (fig. 13), les individus se regroupent suivant des classes dimensionnelles distinctes ( Dodd & Stanton, 1990 ).

Fig. 13. Représentation théorique d'une analyse bivariée. H = holaspide, M = méraspide, P = protaspide, n = nombre maximum de segments thoraciques.
Dans cet exemple, la représentation des mesures de la longueur du champ préglabellaire et la longueur totale du cranidium permet de visualiser trois espèces (1, 2 et 3) se différenciant au cours des stades ontogénétiques représentés par les paquets de points.
Haut de la page
C) Représentation graphique pratique, exemples
D'un point de vue pratique, cette répartition est parfois moins évidente. Sur la figure 14, nous pouvons observer une inversion des stades M6 et M7. Ce problème peut avoir deux origines : tout d'abord le fait que le nombre d'individus par stade ontogénétique est faible ou unique, deuxièmement cette inversion pourrait être causée par la présence de deux valeurs extrêmes, c'est-à-dire un stade M7 légèrement plus petit que la moyenne et un méraspide M6 plus grand que la moyenne. Globalement la séparation des stades est observée, excepté les valeurs extrêmes (vu précédemment) ou une déformation trop importante des fossiles qui fausserait les données.

Fig. 14: représentation de la répartition des différents stades ontogéniques chez Ectillaenus giganteus .
Ce type de graphique peut conduire à la construction de la droite de développement (droite de régression) de l'espèce, du genre ou de la famille. Par exemple, lors de mon stage de DEA j'ai pu définir les caractéristiques de la croissance de 4 familles grâce à de nombreux stades de croissance conservés dans des terrains bretons et normands (fig. 15).

Fig. 15 : diagramme de dispersion des séries ontogénétiques des familles (134 individus).
Ainsi, si les Calymenidae et Dalmanitidae ont des rapports de taille assez similaires durant l'ontogenèse (même si les tailles des adultes sont différentes), alors que ceux des Illaenidae et Homalonotidae se démarquent.
Le mode de croissance des trilobites pose toutefois, deux problèmes :
Premièrement il convient de connaître le nombre de segments thoraciques maximum, propre à l'espèce, qui marque le passage du stade méraspis au stade holaspis.
Deuxièmement, un problème majeur intervient lorsque le thorax est cassé, déformé ou absent. En effet, comment définir le stade ontogénétique de l'individu lorsque seul le céphalon est présent. Durant mon stage, sur 134 individus, 56 ne présentaient que le céphalon et ne pouvaient être rapportés à un stade ontogénétique précis. Pour estimer le stade de développement de ces fossiles, les individus complets d'une même espèce mais de stade ontogéniques différents ainsi que les céphalons isolés ont été représentés sur un graphique bivarié, ce qui permet de comparer les tailles. Cependant, il n'est pas possible sans la présence de quelques spécimens complets, d'attribuer un stade ontogénétique précis à partir de ces deux seuls paramètres. Il s'agissait là simplement d'essayer de définir si nous étions en présence d'un stade méraspide ou d'un stade holaspide.
Références bibliographiques
Dodd, J. R. & Stanton, R. J. Jr., 1990. Paleoecology. Concepts and applications. John Wiley & Sons, New York.
Henry, J.-L., 1989. Paléoenvironnements et dynamique de faunes de trilobites dans l'Ordovicien (Llanvirn supérieur – Caradoc basal) du Massif armoricain (France). Palaeogeogr . Palaeoclim . Palaeoecol ., 73 :139-153.
Hupé, P., 1953. Classe des Trilobites (Trilobita Walch 1771). In : Traitéde Paléontologie (dir. J. Piveteau), 3 : 44-246. Paris, Masson édit.
Lebrun, P., 2002. Trilobite de France, généralités sur les trilobites, Massif armoricain (Bretagne, Normandie, Vendée). Min. Foss., h.-s., 14. pp : 7-81.
McMenamim, M., Juillet 2000 hors série. La valse des espèces. La multiplication des espèces animales. Pour la science. pp : 42-47.
Techniques de nage des ichtyosaures au Jurassique
Merci à mon amie CATHY JOANNE pour ce document
Introduction
I) Critères généraux définissant le style de nage
A) Morphologie et rigidité
1) Classification morphologique
2) Mouvements de l’axe vertébral
3) Spécificités des morphologies principales
B) Amélioration de l'hydrodynamisme
1) Membres antérieurs
2) La nageoire caudale
3) La morphologie générale
C) Amélioration des enjeux physiques
1) Dépenses d’énergie
2) Importance de la longueur d’onde
3) Diminution de la résistance au mouvement
II) Caractéristiques axiales dont dépendent les styles de nage
A) Ostéologie précaudale
1) Le rôle des côtes et des épines neurales
2) Rôle des vertèbres cervicales
3) Les membres postérieurs
B) Spécifités de la colonne vertébrale
1) Compte vertébral
2) Forme des épines neurales
3) Caractéristiques du centrum
4) Précisions sur la queue et la nageoire caudale
III) Continuum fonctionnel et ses conséquences sur le mode de vie
A) Extrémité primitive du continuum
1) Caractères externes généraux
2) Ostéologie
3) Conclusions et extension aux conséquences sur le mode de vie
B) Des formes intermédiaires
1) Eurhinosaurus
2) Ichtyosaurus
3) Mode de vie
C) Domaine évolué du continuum
1) Morphologie générale
2) Ostéologie
3) Conclusions et extension aux conséquences sur le mode de vie
Conclusion
Références bibliographiques
Haut de la page
Retour à la page d'accueil
Résumé
La compréhension des styles de nage des ichtyosaures implique l’étude détaillée de leurs fossiles et l’utilisation éclairée de l’anatomie comparée. Cette dernière peut être effectuée à partir d’animaux marins actuels dont le schéma adaptatif suit approximativement le même modèle que celui des ichtyosaures (par exemple, celui des mammifères marins). Etudes de lois physiques, calculs de rapports de longueur et modélisations mathématiques confèrent à ces observations un caractère plus concret.
La diversité morphologique des ichtyosaures, basée essentiellement sur les variations dans le degré de rigidité des caractères axiaux, amène une variabilité importante dans leurs styles de nage et leur permet de conquérir un domaine marin vaste et varié. L’acquisition progressive d’une morphologie pisciforme, de la forme d’anguille à celle de thon, témoigne de la spécificité et de l’efficacité des modifications anatomiques successives telles que la transformation de membres trapus en nageoires ou l’apparition d’une nageoire caudale de conformation identique à celle des poissons.
Les études morphologiques et ostéologiques permettent d’établir une certaine logique évolutive traduisant :
-une adaptation efficace à la chasse en milieu marin
-une spécialisation anatomique progressive à la vie en milieu marin profond.
Les ichtyosaures, reptiles marins prédateurs les plus rapides que les océans aient connu, disparaissent au milieu du Crétacé, victimes sans doute d’une concurrence grandissante de groupes de poissons Téléostéens. Il y a 65MA, la crise K-T met fin à la domination des reptiles marins. Les niches écologiques libérées sont alors envahies par des animaux qui connaîtront une succession d’adaptations au moins aussi efficace que celle des ichtyosaures : les mammifères marins.
Introduction
Jurassique, il y a 180 MA. Les dinosaures détiennent un pouvoir absolu sur les continents. Les ichtyosaures, quant à eux, règnent désormais sur les océans. Ils y demeureront du début du Trias jusqu’à la fin du Crétacé inférieur.
Cuvier les avait décrit de la façon suivante : «Un museau de dauphin, des dents de crocodile, une tête et un sternum de lézard, des pattes de Cétacé mais au nombre de quatre, enfin des vertèbres de poisson. ». Cette description, assez complète, bien qu’imprécise, illustre la complexité de l’assemblage des caractères anatomiques des ichtyosaures (ou ichthyosaures). Des caractères grâce auxquels ces animaux conquirent l’ensemble des océans de la planète.
Une telle conquête est indissociable d’une spécialisation toujours croissante dans les techniques de nage ; spécialisation d’autant plus originale que les ichtyosaures descendent d’animaux terrestres : les reptiles. Broom les rattacha finalement au groupe des reptiles parapsides en 1924, après qu’ils aient successivement été classés parmi les poissons, les salamandres puis les mammifères.
La présente synthèse permettra d’expliquer les différents styles de nage des ichtyosaures au Jurassique en tentant de définir successivement : les caractères influençant la nage, les caractéristiques axiales dont elle dépend et un continuum fonctionnel typique dont l’étude sera étendue aux conséquences sur le mode de vie des ichtyosaures.
I) Critères généraux définissant le style de nage
Qu’ils soient anatomiques ou physiques, certains caractères de base déterminent directement le style de nage des ichtyosaures.
A) Morphologie et rigidité
Les études de la morphologie et de la rigidité anatomique des ichtyosaures sont dépendantes l’une de l’autre. Elles sont essentielles à la compréhension des techniques de nage.
1) Classification morphologique
Pour commencer, on peut classer, de manière très schématique, les ichtyosaures selon leur morphologie, de la même façon que les poissons :
-forme d’anguille : longs, fins et souples
-forme de morue
-forme de maquereau
-forme de thon : trapus, épais et rigides
(Remarque : les nuances des deux formes intermédiaires seront peu utilisées pendant cette synthèse.)
Cette classification est illustrée par le document suivant (fig.1):

Fig.1 (d’après Lindsey, 1978). 1) Anguille. 2) Morue. 3) Maquereau. 4) Thon.
Haut de la page
2) Mouvements de l’axe vertébral
On pourra distinguer principalement les ichtyosaures à forme d’anguille qui nagent en ondulant la totalité de leur corps, des ichtyosaures à forme de thon, qui nagent en n’oscillant que la nageoire caudale.
Ces mouvements ondulatoires et oscillatoires s’effectuent le long d’un propulseur mobile : l’axe vertébral. Cet axe peut être totalement ou partiellement raidi par des modifications touchant les disques intervertébraux, la morphologie des vertèbres ou des côtes (ceci pourra être largement développé ultérieurement dans la synthèse). La musculature, les tissus connectifs et la peau jouent également un rôle dans la rigidification du corps.
3) Spécificités des morphologies principales
Chez les ichtyosaures en forme d’anguille, l’ondulation, permise par la souplesse de la colonne vertébrale, constitue le mouvement principal. Ce mouvement, s’il permet une certaine agilité et une bonne manœuvrabilité, provoque une importante dépense d’énergie qui empêche l’animal de parcourir de longues distances à une vitesse soutenue. Les ichtyosaures possédant cette morphologie ne sont donc pas spécialisés dans des nages rapides.
Chez les ichtyosaures en forme de thon, le mouvement propulseur dépend des oscillations de la nageoire caudale. La seule zone nécessairement souple dans le corps de l’animal correspond donc à l’ensemble des vertèbres postérieures terminales de la queue et des vertèbres antérieures de la nageoire caudale de façon à permettre le battement de cette nageoire. L’énergie dépensée est donc réduite et la rigidité du corps en limite les frottements sur l’eau. Les ichtyosaures de ce type sont spécialisés dans la nage rapide.
Le document suivant (fig.2) montre d’une part le lien entre le diamètre vertébral et la souplesse de la colonne et d’autre part la grande différence de mouvement entre les deux ichtyosaures.
Remarque : Le chaohusaurus est un ichtyosaure du Trias mais sa nage et sa morphologie sont assez comparables à celles des ichtyosaures peu évolués du début du Jurassique.

Fig.2 (d’après M. Ryosuke, 2001)
Haut de la page
B) Amélioration de l’hydrodynamisme
1) Membres antérieurs
L’une des transformations les plus remarquables ayant caractérisé le passage d’une morphologie reptilienne à une morphologie pisciforme est celle de l’évolution des pattes vers des nageoires. Les os des membres antérieurs caractéristiques des animaux terrestres tétrapodes sont allongés et:
-irrégulièrement arrondis au poignet
-cylindriques au niveau de la paume
-nettement séparés au niveau des doigts. (cf. fig.3)
Chez les ichtyosaures plutôt pisciformes du Jurassique, les os du membre antérieur sont plus larges que longs et moins différenciés que ceux des tétrapodes terrestres. (cf. fig.3)
Entre ces deux étapes, le rapprochement progressif des doigts permet leur réunion dans une même enveloppe de tissus mous. Cette importante transformation conduit à l’apparition d’une nageoire qui permet une amélioration considérable de l’hydrodynamisme en offrant à l’animal un profil compromis par des doigts séparés.
La nageoire évolue progressivement vers plus de rigidité au cours du Jurassique par un raccourcissement et un élargissement, pendant que les éléments osseux se différencient par leur taille et leur mode d’articulation. Il résulte de cette différenciation un accroissement de la flexibilité du membre depuis la zone supérieure vers la zone inférieure et du bord antérieur vers le bord postérieur. Selon les études effectuées par E. Oemichen, ces caractéristiques correspondent aux meilleures conditions hydrodynamiques et font de ce membre antérieur un propulseur efficace.
Le document suivant (fig.3) montre l’évolution du membre antérieur gauche, depuis le reptile terrestre jusqu’à l’ichtyosaure évolué (ici, l’ophtalmosaurus) :

Fig.3
L’étude de la ceinture scapulaire semble indiquer la capacité de l’ichtyosaure à effectuer des mouvements de grande amplitude. Grâce à ses membres antérieurs, l’ichtyosaure peut donc soulever son corps dans l’eau sans dépenser une grande quantité d’énergie.
Haut de la page
2) La nageoire caudale
La nageoire caudale correspond à l’organe propulseur chez la plupart des animaux marins pélagiques et constitue donc le principal élément dynamique de leur corps. Le développement d’une nageoire caudale de plus en plus spécialisée est par conséquent nécessaire à l’amélioration de l’hydrodynamisme des ichtyosaures. D’après les modélisations mathématiques du chercheur canadien R. Motani, une nageoire caudale de grande envergure contribue largement à cette amélioration et permet l’obtention d’une vitesse de croisière élevée. D’après lui, un sténoptérygius (ichtyosaure à nageoire caudale de grande envergure) d’environ deux mètres de long pouvait atteindre des vitesses de 1,8 m/s (vitesse comparable à celle des thons actuels).
La morphologie de la nageoire caudale est donc essentielle : elle doit être caractérisée par une surface faible mais une grande envergure. C’est une « forme en croissant » telle que celle de l’ophtalmosaurus (identique à celle du thon) qui permet d’atteindre des vitesses maximales.
Le document suivant (fig.4) montre la forme comparable des deux nageoires caudales citées précédemment :

Fig. 4: comparaison des nageoires caudales.
Haut de la page
3) La morphologie générale
Les aspects morphologiques suivants, relevés chez les ichtyosaures pisciformes les plus évolués du Jurassique, illustrent clairement le fort degré de spécialisation et d’adaptation au milieu océanique profond dont ils sont caractérisés.
-La forme générale en fuseau et le caractère rigide de la colonne vertébrale offrent à l’animal le meilleur profil pour un glissement efficace de l’eau sur le corps et diminuent ainsi la résistance produite par ses frottements.
-Un rostre long et effilé permet une pénétration efficace dans l’eau, offrant un minimum de surface de frottement lors de la nage.
-Une nageoire dorsale, quasi-identique à celle des poissons ou des dauphins, constitue un organe améliorant l’hydrodynamisme par l’acquisition d’un équilibre essentiel pendant la nage.
-Des membres antérieurs (vus précédemment) profilés et ayant acquis une certaine flexibilité jouent un rôle dans la manœuvre.
-Des membres postérieurs réduits (caractère adaptatif très comparable au modèle d’évolution des mammifères marins) obtiennent un rôle de gouvernail et permettent une réduction des frottements de l’eau.
C) Amélioration des enjeux physiques
L’augmentation de la vitesse et l’amélioration de l’hydrodynamisme impliquent la mise en œuvre de certaines lois de la physique.
1) Dépenses d’énergie
L’énergie dépensée par les ichtyosaures pour se maintenir à la surface est minimale. En effet, en émettant l’hypothèse que les quatre membres effectuent des mouvements synchrones, la résultante des forces de soulèvement doit passer par le centre de gravité. Ainsi, l’ichtyosaure est hydrodynamiquement centré et son corps n’est soulevé d’avantage ni vers l’avant, ni vers l’arrière. La position naturelle de l’animal étant par conséquent horizontale, il peut se maintenir facilement à la surface de l’eau, notamment pour reprendre sa respiration (les ichtyosaures étant privés de branchies par leur condition de reptiles).
La figure suivante (fig.5) représente un Euryptérygius burgundiae en position naturelle d’émersion. (La ligne en traits et points représente la direction approximative de la colonne vertébrale.) :

Fig.5 (d’après Oemichen)
En revanche, l’animal doit dépenser une grande quantité d’énergie pour plonger à cause de deux caractéristiques :
•D’une part la conformation de sa nageoire caudale par sa position caudale et son caractère hétéricerque à grand lobe inférieur. Ces deux aspects morphologiques obligent l’animal à courber le lobe inférieur de sa queue afin de créer une force propulsive suffisante pour soulever la région postérieure de son corps et pouvoir ainsi basculer sous l’eau. Contrairement aux cétacés actuels qui créent cette force de soulèvement facilement en battant leur nageoire caudale horizontale sur l’eau. (cf. fig.6)
•D’autre part, en raison de la ligne de flottaison assez haute de l’animal (liée à sa position horizontale naturelle expliquée précédemment) qui correspond à une horizontale passant sous les narines et sous l’œil (cf.fig.5), et laisse ainsi la moitié du corps de l’animal au-dessus de la surface (contrairement aux Cétacés dont seule une faible proportion du corps est laissée au-dehors de l’eau lors d’une remontée). Ceci explique la nécessité d’une force propulsive d’autant plus importante pour plonger.
La figure suivante (fig.6) compare les départs de plongée d’un Cétacé et d’un ichtyosaure :

Fig.6 (d’après Oemichen, 1991)
Haut de la page
Cette figure illustre l’efficacité de la force propulsive verticale imposée par la nageoire caudale de la baleine par rapport à la force oblique imposée par celle de l’ichtyosaure.
L’énergie dépensée pendant la nage diminuera sans cesse pendant l’évolution des ichtyosaures. Cette dépense dépend de nombreux facteurs, notamment :
-du rapport entre le volume et la surface totale de l’animal, qui augmente pour diminuer l’énergie dépensée en limitant les frottements
-du rapport entre le volume et la surface de la nageoire caudale, qui augmente avec les mêmes effets. (Ce second rapport a été plus largement expliqué dans la partie concernant les modifications de la nageoire caudale en faveur de l’hydrodynamisme).
2) Importance de la longueur d’onde
Les nageurs aux corps longs et souples effectuent des mouvements de longueur d’onde relativement courte (plus courtes que la longueur de leur corps).
Les nageurs aux corps trapus et rigides nagent avec des mouvements de grande longueur d’onde (plus grande que la longueur de leur corps).
D’après la relation h=V/v, on peut établir que, pour une fréquence v donnée (en mvts/s), la vitesse V (en m/s) augmente proportionnellement à la longueur d’onde. C’est pourquoi les ichtyosaures plus souples et plus longs sont supposés plus lents que les ichtyosaures pisciformes.
L’augmentation de la longueur d’onde est associée à l’augmentation de la vitesse de nage chez tous les groupes.
Haut de la page
3) Diminution de la résistance au mouvement
Chez les ichtyosaures peu évolués, l’ondulation importante du corps pendant la nage provoque :
-de nombreux frottements sur l’eau
-un mouvement de recul lié aux déplacements latéraux brusques.
Ces causes de ralentissement de la nage ne sont pas compensées par une nageoire caudale de grande envergure et rendent donc le déplacement assez lent.
Si chez les ichtyosaures trapus plus évolués la surface corporelle en contact avec l’eau augmente, le volume, parallèlement, s’accroît suffisamment pour obtenir un rapport volume/surface élevé, permettant ainsi une résistance au mouvement minimum. De plus, une pénétration nette dans l’eau (sans ondulation) permet d’en diminuer les frottements. Enfin, leur tronc épais et la présence d’une nageoire dorsale augmentent l’inertie de la partie antérieure du corps, minimisant ainsi la force de recul qui accompagne les faibles mouvements d’ondulation du corps. La nageoire caudale de grande envergure achève de réduire l’influence des différentes forces de résistance.
II) Les caractéristiques axiales dont dépendent les styles de nage
L’étude des caractères morphologiques axiaux des ichtyosaures du Jurassique permet de définir les meilleures conditions ostéologiques nécessaires à une nage rapide et économique sur le plan énergétique, notamment en établissant les critères essentiels à l’amélioration de la rigidité du corps des ichtyosaures.
Cette partie a pour but de définir le rôle et l’importance des caractères axiaux principaux.
Haut de la page
A) Ostéologie précaudale
Le tronc ne tient pas de rôle essentiel dans les fonctions de propulsion mais intervient néanmoins de façon importante dans différents aspects de la locomotion :
-la morphologie générale et l’hydrodynamisme de l’animal,
-l’apport essentiel de sites d’attache à la puissante musculature de la queue,
-le port de membres certainement utiles à la locomotion et la manœuvre.
1) Le rôle des côtes et des épines neurales
Les côtes tiennent un rôle important dans la morphologie et donc dans le type de nage de ces animaux. En effet, plus elles sont longues, plus elles épaississent le tronc et plus le corps est trapu et donc rigide. Le degré de courbure des côtes donnait à la forme en fuseau de l’animal un caractère plus ou moins renflé.
De longues côtes courbes se trouvent donc sur les fossiles d’ichtyosaures évolués, à nage rapide.
Les épines neurales influent de la même façon que les côtes sur la nage : leur longueur fait varier l’épaisseur du tronc qui influe sur la rigidité du corps. Les mêmes conséquences sont observées.
De plus, les épines neurales très hautes indiquent la présence d’une masse musculaire suffisante pour augmenter encore la rigidité du corps de l’animal.
2) Rôle des vertèbres cervicales
Les vertèbres cervicales ont pour rôles le support et la rotation de la tête. Une faible longueur permet un raccourcissement et un raidissement du cou et donc une stabilisation de la tête et une amélioration de l’hydrodynamisme.
Des vertèbres cervicales courtes sont donc essentiellement observées chez les nageurs rapides tels que l’ophtalmosaurus. On observe d’ailleurs la fusion ou la disparition de certaines vertèbres cervicales chez les espèces plus évoluées.
Haut de la page
3) Les membres postérieurs
Chez les ichtyosaures les plus souples, les membres postérieurs sont encore de grande taille et remplissent sans doute des fonctions locomotrices et directionnelles. Chez les ichtyosaures les plus évolués, la réduction structurale des éléments de la région pelvienne a fortement diminué la taille de ces membres qui ne peuvent alors guère plus tenir qu’un rôle de gouvernail, bien que celui-ci soit sans doute superflu pour des animaux aussi rapides qu’ophtalmosaurus.
On notera que la réduction ostéologique de la région pelvienne a abouti à la disparition totale de ces membres postérieurs chez les baleines et les veaux marins.
La figure suivante (fig.7) illustre ces différents éléments chez ophtalmosaurus :

Fig.7 (d’après Andrews)
B) Spécificités de la colonne vertébrale
La forme et la taille des vertèbres définissent les conditions ostéologiques susceptibles d’optimiser ou non la qualité de nage des ichtyosaures.
1) Compte vertébral
Le nombre total de vertèbres définit la longueur et la flexibilité de la colonne.
Un nombre de vertèbres élevé implique une grande quantité de joints intervertébraux et, par conséquent une incurvation plus aisée de la colonne.
On trouvera donc relativement moins de vertèbres chez les ichtyosaures capables d’une nage rapide car pourvus d’une colonne vertébrale plus rigide.
Haut de la page
2) Forme des épines neurales
Celle-ci influence beaucoup le degré de rigidité de la colonne vertébrale.
Les épines rectangulaires et carrées offrent, entre deux épines adjacentes, un contact sur la quasi-totalité de leur hauteur. Le champ de mouvement est donc très réduit et la colonne est plus rigide.
Les épines polygonales et en baguettes n’offrent qu’un contact minimum entre deux épines voisines et le champ de mouvement élevé permet alors une souplesse accrue.
Bien qu’ils s’effectuent toujours dans le même ordre, les changements de forme de l’épine neurale interviennent à différents endroits de la colonne vertébrale selon le degré d’évolution de l’ichtyosaure concerné. La souplesse associée à l’arrivée des vertèbres à épine neurale polygonale s’effectue en position plus postérieure chez les ichtyosaures à nage rapide, lesquels n’ont besoin d’une plus grande flexibilité qu’à la base de la nageoire caudale.
3) Caractéristiques du centrum
La taille du centrum influe de la même façon que l’épine neurale sur la rigidité de la colonne.
Quand les centra sont discoïdes, les aires de contact intervertébral sont importantes et la rigidité est accrue.
Quand les centra sont cylindriques, les aires de contact intervertébral sont plus faibles et la souplesse est plus importante.
Les angles arrondis des centra autorisent un certain mouvement des vertèbres et interviennent également dans l’assouplissement de la colonne.
Chez les ichtyosaures les plus évolués (comme Ophtalmosaurus), les centra ne deviennent cylindriques et les angles ne s’arrondissent que dans la partie postérieure de la queue et la partie antérieure de la nageoire caudale. La base de celle-ci est l’unique zone réellement souple de l’animal. C’est dans cette partie restreinte que s’effectue la majorité du mouvement de la colonne.
Haut de la page
4) Précisions sur la queue et la nageoire caudale
Selon E.A.Buchholtz, « La fonction de la queue est la clé de l’interprétation de la nage des ichtyosaures. »
La queue se divise distinctement en deux sous-unités chez les espèces les plus évoluées.
Les centra des vertèbres de la partie antérieure de la queue sont volumineux : hauts et larges. Ces vertèbres sont les plus discoïdes de la colonne et des angles assez francs provoquent un contact important, qui limite le champ de mouvement, entre vertèbres adjacentes. Les vertèbres de la partie antérieure de la queue améliorent :
-le support par leur taille
-la rigidité par leur forme.
Dans la partie postérieure de la queue, la hauteur du centrum diminue de façon conséquente tandis que la largeur est modestement réduite d’où l’apparition d’une compression dorso-ventrale et d’un assouplissement à la base de la nageoire caudale. De plus, les centra deviennent plus arrondis et les possibilités de mouvement entre les vertèbres sont accrues. Ce type de vertèbres permet une bonne souplesse à la base de la nageoire.
III) Continuum fonctionnel et ses conséquences sur le mode de vie
Au cours de leur évolution, les ichtyosaures s’adaptent au milieu marin en adoptant progressivement une morphologie pisciforme. Et même si tous les ichtyosaures jurassiques étudiés ici ont déjà acquis des caractères pisciformes tels que l’aileron dorsal et un lobe dorsal sur la nageoire caudale, et sont donc sans doute plus proches du thon que de l’anguille, certains possèdent encore une anatomie assez proche de celle des reptiles. C’est pourquoi les six espèces étudiées par E. Buchholtz illustrent clairement cette succession de modifications en s’inscrivant dans une évolution anatomique traduisant un continuum fonctionnel dans le style de nage.
Il est intéressant d’utiliser cette étude pour interpréter les conséquences de l’évolution des styles de nage sur le mode de vie des ichtyosaures.
Haut de la page
A) Extrémité primitive du continuum
L’extrémité primitive du continuum évoqué chez ces ichtyosaures du Jurassique est représentée par le Suevoleviathan disinteger (Sd) et le Temnodontosaurus trigonodon (Tt).
1) Caractères externes généraux
Ces animaux appartiennent au groupe d’ichtyosaures à forme d’anguille : à corps fin, long et souple.
Ils possèdent une queue et une nageoire caudale longues en rapport à la longueur précaudale. (cf.fig.8)

Fig.8 (d’après E.Buchholtz)
On peut calculer des rapports (longueur queue + nageoire) / (longueur totale de la colonne) =R, qui illustrent la longueur de la partie morphologique propulsive par rapport à la longueur totale de la colonne :
-Chez Suevoleviathan, R = 1.92 / 3 = 0,64
-Chez Temnodotonsaurus, R = 3,5 / 5,5 = 0,64
Chez ces deux ichtyosaures peu évolués, la longueur de cette zone est nettement supérieure à la longueur totale de l’animal.
De plus, ces deux reptiles possèdent de grands membres postérieurs, qui attestent du faible degré d’avancement de la réduction des éléments de la région pelvienne. Ces membres postérieurs se rapprochent d’ailleurs sans doute plus de membres trapus que de véritables nageoires et inscrivent donc bien les deux animaux au début du continuum morphologique jurassique.
Haut de la page
2) Ostéologie
Des observations morphologiques axiales effectuées sur les squelettes de Suevoleviathan et Temnodontosaurus permettent de les situer avec certitude au début du continuum :
•un grand nombre de vertèbres : 187 chez Sd et 179 chez Tt au total, déterminant un corps long ;
•des vertèbres de faible diamètre, déterminant une colonne vertébrale fine et flexible ;
•une faible différenciation anatomique régionale au niveau des vertèbres qui détermine une faible régionalisation, et donc spécialisation des différentes zones du corps:
- diminution assez constante de la longueur du centrum le long de la colonne, sans stabilisations spécifiques aux différentes zones,
- la hauteur du centrum ne chute que de 38mm dans la région essentielle de la partie postérieure de la queue ;
•des côtes assez courtes et peu courbées et des épines neurales de petite taille accentuant la finesse du corps ;
•des espaces intervertébraux autorisant un mouvement assez important entre les vertèbres et amplifiant la capacité d’ondulation du corps.
Haut de la page
3) Conclusions et extension aux conséquences sur le mode de vie
Les caractères anatomiques externes et l’ostéologie de ces animaux traduisent une morphologie encore assez reptilienne, une flexibilité importante de la colonne vertébrale et donc une nage ondulante, à la manière des anguilles.
Ces deux reptiles sont donc très souples, peu spécialisés et par conséquent relativement lents. Ils doivent en revanche être dotés d’une agilité assez importante par rapport à leurs contemporains.
Une telle nage confère une bonne combinaison manœuvrabilité-accélération, mieux adaptée aux eaux peu profondes du plateau continental où les proies sont toujours abondantes. L’agilité de ces ichtyosaures leur permet sûrement de chasser efficacement bien qu’ils ne puissent sans doute pas poursuivre leurs proies sur de longues distances à cause d’une importante dépense d’énergie liée aux mouvements d’ondulation.
B) Des formes intermédiaires
Deux spécimens semblent constituer des maillons évolutifs intermédiaires : l’Eurhinosaurus longirostris (El) et l’Ichthyosaurus communis (Ic).
1) Eurhinosaurus
Celui-ci se rapproche d’avantage des ichtyosaures les moins évolués du Jurassique avec :
• une longue colonne vertébrale,
• de longs membres antérieurs et postérieurs,
• une longue queue et une longue nageoire caudale,
• des côtes et des épines neurales assez courtes ;
autant de caractères traduisant un corps fin et souple, plutôt anguilliforme.
Mais on note également chez lui une différenciation nette des parties antérieure et postérieure de la queue, ce qui constitue un élément rapprochant cet animal des ichtyosaures mieux différenciés et donc plus évolués.
2) Ichtyosaurus
On observe chez cet animal de nombreux indicateurs d’une rigidité corporelle et d’un degré évolutif assez élevés :
• des côtes et épines neurales assez longues, traduisant l’épaisseur du tronc,
• des membres postérieurs assez petits traduisant le degré moyen de réduction de la zone pelvienne,
• une queue et une nageoire dorsale assez courtes
En revanche, on note un caractère typique des premiers ichtyosaures du Jurassique : une queue peu différenciée avec des sous-unités ondulatoires, traduisant une région postérieure assez souple.
Haut de la page
3) Mode de vie
Ces ichtyosaures, anatomiquement dans un degré intermédiaire d’évolution, doivent commencer à s’adapter à un mode de vie marin plus profond.
Grâce aux nouvelles caractéristiques de son anatomie, l’Ichtyosaurus peut nager plus rapidement, mais sa queue, encore trop souple, ne lui permet pas de plonger à de grandes profondeurs. On peut penser qu’il s’est adapté à un mode de vie épipélagique et peut donc s’"aventurer" au-delà du plateau continental.
L’amélioration de l’anatomie de sa queue a sans doute permis à Eurhinosaurus d’augmenter sa vitesse de chasse mais son allure encore très reptilienne lui interdit sûrement de plonger en profondeur.
Les deux animaux sont contemporains et vivent certainement dans le même type de milieu, mais leur grande différence de taille empêche une concurrence directe en ce qui concerne les proies convoitées.
C) Domaine évolué du continuum
L’extrémité la plus évoluée du continuum est représentée par le Stenopterygius quadriscissus (Sq) et l’Ophtalmosaurus icenicus (Oi).
1) Morphologie générale
Celle-ci s’apparente réellement à celle des thons, avec un corps épais, trapu et rigide.
Ces deux animaux sont caractérisés par une queue et une nageoire caudale courtes par rapport à la longueur précaudale (cf.fig.9) :

Fig.9 (d’après E.Buchholtz)
Les rapports de longueur expliqués dans la partie A sont calculés ici également :
-Chez Stenopterygius, R = 0,9 / 1,75 = 0,51
-Chez Ophtalmosaurus, R = 1,1 / 2,1 =0,52
On constate que chez ces animaux, la longueur "queue + nageoire caudale" est à peu près équivalente à la longueur précaudale.
De plus, ces reptiles sont dotés de nageoires postérieures très réduites, ce qui témoigne de l’avancement de la réduction de leur région pelvienne. Ces membres n’ont alors plus de réelle fonction locomotrice et ressemblent désormais d’avantage à des nageoires. On peut penser que ces membres sont appelés à être éliminés par l’évolution.
Haut de la page
2) Ostéologie
Certaines modifications intervenues dans le squelette permettent de situer avec certitude Sq et Oi à la fin du continuum anatomique (du Jurassique) :
•un nombre total de vertèbres relativement faible : 155 chez Sq et approximativement 130 chez Oi, déterminant un corps assez court ;
•une différenciation anatomique régionale des vertèbres assez nette, notamment en ce qui concerne la longueur du centrum, avec :
- des changements brutaux de celle-ci le long de la colonne avec une relative stabilisation des valeurs au niveau de chaque région spécifique,
- chute de 50mm de la hauteur du centrum dans la partie postérieure de la queue, ce qui indique une forte différenciation des parties antérieure et postérieure ;
•une réduction des membres postérieurs ;
•un allongement des côtes (de plus en plus courbes) et des épines neurales de grande taille, augmentant l’épaisseur du tronc de l’animal ;
•un arrondissement des angles des vertèbres à la base de la nageoire caudale, lui permettant un battement large et puissant ;
•une augmentation de la surface de contact intervertébral qui diminue les possibilités de torsion de la colonne et augmente donc la rigidité ;
•la fusion de l’atlas et de l’axis (respectivement première et deuxième vertèbres cervicales), permettant un raidissement du cou et la stabilisation de la tête.
3) Conclusions et extension aux conséquences sur le mode de vie
Les caractères anatomiques externes et ostéologiques traduisent une morphologie pisciforme chez ces deux derniers reptiles qui sont donc plus rigides, plus trapus et disposent de régions anatomiques suffisamment spécialisées pour améliorer efficacement la technique de nage.
Il s’agit donc ici d’animaux rapides et endurants (grâce à des économies d’énergie pendant la nage). Ces modifications essentielles permettent à ces ichtyosaures de plonger beaucoup plus profondément et de chasser en haute mer malgré une respiration aérienne.
Les chercheurs ont collecté diverses preuves permettant de conclure à la chasse en profondeur de ces derniers ichtyosaures du Jurassique :
•Ils possèdent des dents plus grandes, indiquant que ces animaux chassent des proies plus grosses, et certainement plus rapides.
•Ils disposent d’un diamètre oculaire très important : 23cm chez l’Ophtalmosaurus, soit des yeux 1 fois et demi plus gros que ceux de la baleine bleue, pourtant au moins deux fois plus grande que cet ichtyosaure (cf.fig.10). Au-delà de cette constatation, l’étude des anneaux sclérotiques (os de l’orbite oculaire) révèle que l’Ophtalmosaurus a les plus grands yeux du monde vivant actuel ou disparu par rapport à la taille du corps. On estime que cet énorme diamètre oculaire pouvait lui permettre de voir à plus de 500m de profondeur.
•Ils sont caractérisés par un volume corporel important et donc une masse musculaire élevée qui leur permet de stocker une grande quantité d’oxygène. En comparant ce volume à celui d’animaux plongeurs actuels tels que la baleine, qui peut plonger environ 30 minutes, on peut estimer le temps de plongée dont était capable un Ophtalmosaurus à environ 20 minutes. Grâce aux vitesses de croisière élevées qu’il est capable d’atteindre, ce temps lui permet de rejoindre des profondeurs de près de 600m.
•L’étude de leur contenu stomacal fossilisé montre la présence de proies telles que des pieuvres, des calamars, des seiches… En plus de témoigner des talents de chasseur carnassier des ichtyosaures, ces restes d’animaux hémipélagiques indiquent que les dernières espèces du Jurassique ont su développer une chasse de poursuite en profondeur.

Fig.10 (d’après R. Motani)
Haut de la page
Conclusion
Les ichtyosaures fascinent les scientifiques, chercheurs ou amateurs, depuis près de deux siècles par l’étrangeté de l’assemblage morphologique dont ils sont caractérisés. En réalité, cet assemblage témoigne à la fois de leurs origines reptiliennes (que Cuvier avait traduit par «des dents de crocodile, une tête et un sternum de lézard ») et de leurs très bonnes capacités d’adaptation à leur milieu (« un museau de dauphin,(…) des pattes de cétacé,(…) des vertèbres de poisson »). Cette réunion originale de caractères communs fait de ces ichtyosauriens des êtres uniques aussi bien sur un plan morphologique que sur un plan adaptatif.
La succession d’adaptations morphologiques et anatomiques au milieu marin des ichtyosaures et l’évolution des styles de nage qui en est issue, leur a permis de conquérir progressivement un terrain de chasse océanique très étendu et de plus en plus profond.
En 1988, le scientifique Massare compare les styles de nage des principaux reptiles marins du Mésozoïque (ichtyosaures, plésiosaures et mosasaures). Il en ressort que les ichtyosaures étaient les reptiles chasseurs marins les plus rapides de cette époque. Ils disparaîtront pourtant les premiers des océans du Crétacé. Une disparition certainement liée à une compétition grandissante avec les téléostéens : poissons carnassiers spécialisés dans la poursuite, rapides et surtout dotés de branchies. Le règne des reptiles marins s’achèvera à la fin du Crétacé avec la disparition des derniers plésiosaures. Les niches écologiques ainsi désertées seront rapidement recolonisées par de nouveaux maîtres : les mammifères marins.
Retour à la page d'acceuil
Introduction :
Depuis quelques temps, le rythme des découvertes d’œufs fossiles, plus ou moins conservés, a tendance à accélérer. L’œuf de reptile le plus ancien date du Permien à Canyon Rattlesnake (Texas) et mesure 59 mm de longueur pour 36 mm de diamètre maximal. En 1925, une expédition américaine trouva des nids de Dinosaures datant du Crétacé dans le désert de Gobi (Mongolie). Ensuite ce fut en Argentine, puis dans le Montana où, sur quelques kilomètres carrés, les chercheurs ont mis à jour trois cents œufs. Il y eut beaucoup de lieux de découvertes (fig.1), permettant aux scientifiques d’explorer des nouveaux domaines d’études. Ce sont ces études (des exemples) qui seront traités ici, par deux gisements spécifiques et représentatifs : la France, pour l’abondance des œufs et les observations faites dessus, et le Portugal, avec ses exemples remarquables d’embryons fossiles.

Fig.:1 localisation des sites : Asie : 109 sites. Europe : 39 sites. Amérique Nord : 37 sites. Amérique Sud : 12 sites. Afrique : 2 sites.
I) Cas de la France
S’il est vrai que les œufs fossiles de Dinosauriens sont habituellement rares, nous avons la chance d’avoir une région particulièrement riche en France, il s’agit de la région d’Aix-en-Provence (Bouches du Rhône).En effet, ces fossiles y sont abondants dans des sédiments fluvio-lacustres âgés du Crétacé terminal. C’est le cas des différents sites provençaux, comme ceux du Languedoc et des Pyrénées, qui sont rattachés aux deux derniers étages : le Campanien (-83 millions d’années, -72 millions d’années) et le Maastrichtien (-72 millions d’années, -65 millions d’années).Ces deux étages furent eux même découpés en étages locaux : le Campagnien en Fuvélien et Bégudien, et le Maastrichtien en Rognacien. Les derniers niveaux contenant des œufs d’affinités dinosauriennes (type Megaloolithus mamillare ou apparenté) se trouvent dans des formations marno-gréseuses entre un conglomérat (nommé conglomérat de La Galante) et un calcaire (calcaire de Vitrolles), et les restes de Dinosaures de tout le Midi méditerranéen français sont datés depuis le Fuvélien jusqu’au sommet du Rognacien, ce qui représente une période d’environ 15 millions d’années (-80 à –65 millions d’années).
Haut de la page
A) Chronologie
1) Les découvertes
C’est le géologue Philippe Matheron qui a décrit pour la première fois des ossements de Dinosaures de Provence et découvert des œufs, et ce fut son collègue Paul Gervais qui utilisa les fragments de coquilles trouvés pour réaliser les premières lames minces.
C’est lors de travaux sur les dépôts fluvio-lacustres, auxquels il accorda une attention supplémentaire aux reptiles fossiles, qu’il trouva des fragments osseux d’Hypselosaure et des fragments d’œufs conservés dans les sédiments du crétacé : « …avec les fragments osseux dont je viens de parler, se trouvaient deux grands segments de sphère ou d’ellipsoïde, à l’examen desquels plusieurs paléontologistes ont souvent exercé leur patience. Tout bien considéré il paraîtrait que ce sont des fragments d’œufs. » (Matheron 1869). Bien entendu, on connaissait déjà l’existence d’œufs fossiles à cette époque, quelque uns ayant été découverts en Angleterre (Buckman 1860, Carruthers 1871).
Paul Gervais fut un des premiers à avoir l’idée de faire des coupes histologiques dans ces œufs fossiles : en 1876, il fait préparer des coupes dans les coquilles de Matheron qui suppose être un oeuf d’un oiseau gigantesque ou d’un Hypselosaure. Pour faire une comparaison en parallèle, il fait aussi préparer des coupes dans des œufs d’oiseaux, de tortues, de crocodiles et de gecko. Avec le peu de matériel de comparaison mis à sa disposition et une étude des lames minces en lumière naturelle et lumière polarisée, il conclut : « …que les grands œufs fossiles dans le terrain de Rognac n’ont pas appartenu à un oiseau, mais bien à un Reptile de classification indéterminée, ayant par la structure de la coquille de ses œufs une incontestable analogie avec ceux de certains Emydo-sauriens » (groupe de reptiles créé par Blainville et réunissant crocodiles et tortues).
Remarques : les lames minces ont été retrouvées dans les collections du Laboratoire d’Anatomie comparée grâce à monsieur Philippe Taquet.
On connaît aujourd’hui 12 types d’œufs fossiles rencontrés dans le crétacé supérieur de Provence (Vianey-Liaud et al 1994 ; Vianey-Liaud 1999 ; Garcia 2000 ; Garcia et al 2000a, b) et qu’il est impossible d’attribuer un type d’œuf à une espèce, à moins de trouver des restes de nouveau-nés associés aux coquilles (Horner et Makela 1979) ou d’embryons à l’intérieur d’un œuf (Horner et Weishampel 1988 ; weishampel et Horner 1994 ; Norell et al 1994 ; Mateus et al 1997), sans ces associations il est aléatoire de faire des rapprochements entre coquille et espèce. Pour remédier à ce problème de classification, les spécialistes ont créé une parataxonomie pour la dénomination des différents types de coquilles fossiles.
Haut de la page
2) La parataxonomie des œufs fossiles (veterovata, voir annexe)
C’est au XIXème siècle que remonte les premiers travaux (Buckman 1860 ; Meyer 1867 ; Carruthers 1871 ; Gervais 1877) et bien qu’à cette époque les connaissances sur ce sujet étaient limitées, Buckman fut le premier à utiliser des noms parataxonomiques pour deux types d’œufs fossiles pendant que la plupart des auteurs ne faisaient que des descriptions générales et brèves, et attribuaient l’appartenance des œufs à des espèces indéterminées. Buckman et Carruthers pensaient qu’il n’était pas plus insensé d’utiliser les caractères morphologiques des œufs, comme l’épaisseur de la coquille ou encore l’ornementation externe, que ceux observés sur les ossements pour établir les différents taxons dinosauriens. C’est au début du XXème siècle, après de nombreuses découvertes d’œufs de Dinosaures, que le besoin d’une classification parataxonomique se fit de plus en plus sentir. Différents caractères furent alors utilisés :
• Van Straelen (1928) utilisa l’épaisseur, l’ornementation, et la morphologie des canaux aérifères (pores) pour les œufs du désert de Gobi.
• Young (1954) utilisa des caractères macrostructuraux pour séparer les œufs de Laiyang en Oolithes sphéroïdes et O.elongatus.
• Sochava (1969) utilise les pores pour séparer les coquilles en type angusticanaliculé, prolatocanaliculé et multicanaliculé. Erben (1970) y rajoute le type tubocanaliculé et Nesov et Kaznyshkin (1986) les types foveocanaliculé et lagenosanaliculé.
• Chao et Chiang (1974) utilisent les variations microstructurales pour séparer O.sphéroïde en 5 ootypes différents.
• Penner (1985) utilise les unités cristallines de l’architecture de la coquille.
Dans les années 70, les classifications de type parataxonomique sont établies pour harmoniser et classer les informations collectées dans le monde :
En 1994, Zhao avait établi six « para-famille » d’œuf de dinosaures (Zhao 1975, Zhao et Ding 1976, Zhao 1979, Zhao etLi 1979), puis cinq familles furent établies par d’autres chercheurs (Zheng er Zhang 1979, Mikhailov 1991, Hirsch 1994, Kohring et Hirsch 1996) portant le nombre à 11 « para-familles », 28 « para-genres » et 65 « para-espèces » pour les œufs de dinosaures et d’oiseaux ratites. Cette classification a été unifiée par Mikhailov (1991, 1996). Elle prend en compte la forme de l’œuf, l’épaisseur, l’ornementation de la surface externe et la microstructure de la coquille, ainsi chaque œuf est désigné par un type générique avec un suffixe « Oolithus ». Voir annexes.
Haut de la page
B) Les pontes
1) Fossilisation
Ces fossilisations exceptionnelles sont dues aux conditions il y a70 millions d’années en Europe. En effet, à cette époque l’Europe formait un vaste archipel d’îles plus ou moins grandes, et le sud de la France ainsi que le nord-est de l’Espagne et une partie du Portugal étaient alors émergés, le paysage dominant était donc composé de vastes plaines alluviales parcourues par de grands fleuves. Ces conditions expliquent que les œufs fossiles se rencontrent souvent dans des marnes rouges ou bariolées qui correspondent aux sols latéritiques de ces plaines alluviales, et dans des grès ou des formations conglomératiques dues à un enfouissement dans des sédiments exondés formant le lit majeur de rivières ou de torrents. Pour ce qui concerne la bonne conservation des nids et des œufs, elle semble conforter l’idée d’un enfouissement des œufs qui sont simplement un peu déformés par le poids des sédiments.
Dans les différents gisements de bassin d’Aix-en-Provence, la conservation de la structure des nids est plus ou moins connue selon les types d’œufs, l’état des fossiles et la préservation des gisements. En effet, certains types d’œufs ne sont connus que par des fragments de coquilles isolés. La destruction de ces œufs et de ces nids peut s’expliquer par deux hypothèses :
• Une érosion de la tranche superficielle du sol dans laquelle les pontes étaient déposées.
• Une nidification sub-aérienne, les œufs étant déposés à la surface puis recouverts d’une faible épaisseur de végétaux. Ce serait le cas du type « ornithoïde » (Prismatoolithus et apparentés), ainsi que les œufs attribués à l’Hadrosaurien Maiasaura et à l’hypsilophondontidé Troodon retrouvés dans le Campanien de Willow Creek dans le Montana, et ceux de certaines espèces de dinosauriens du crétacé chinois s’apparenteraient à une nidification en faible profondeur, la partie superficielle de la coquille émergeant du sédiment.
Dans le bassin d’Aix-en-Provence deux types de nids sont attestés :
• Le premier type de nid présente des œufs entassés sur trois à cinq niveaux, avec régulièrement, une décroissance du nombre d’œufs du niveau supérieur au niveau inférieur de la ponte. Exemple : une ponte de 9 œufs entiers et probablement non éclos de Cairanoolithus dughii a été mise à jour dans le Rognacien inférieur du gisement de la Cairanne présente une disposition sur 4 niveaux. Le niveau A comportant 3 œufs, le niveau B (sous-jacent) 3 œufs également, le niveau C, 2 oeufs et le niveau D, 1 seul. L’interprétation de cette disposition suggère que la ponte ait été faite dans une excavation sub-conique de 0,80 à 1 mètre de profondeur et d’un diamètre de 1 mètre à l’ouverture, mais ce type de nidification ne semble être que pour les œufs de grande taille. De plus, le nombre d’œufs varie de 4 à 9 suivant le type d’œufs. Cette disposition a été aussi observée dans le Sénonien continental du Languedoc (Freytet 1960, Thaler 1965) et chez des reptiles actuels comme les crocodiliens (Greer 1970,1971, Campbell 1972), les chéloniens (Ewert 1985), et chez les oiseaux mégapodes actuels de l’aire Indo-pacifique (Fleay 1937, Frith 1959, 1962, Baltin 1969).
• Le deuxième type se présente sous forme de file disposée sur un ou deux niveaux. Ce type de disposition a été observé dans le Rognacien supérieur de la région de Rousset-sur-Arc (Bouches-du-Rhône) dans les gisements de Frigara et de La Cardeline présentant des pontes de 6 à 10 œufs de Megaloolithus mamillare et Megaloolithus sp. déposés sur une superficie de 0,70 à 1,50 m2 et sur un seul niveau, ainsi que dans le gisement de Roques-Hautes / les Grands-Creux (Dughi et Sirugue 1958) où a été découvert une file de 8 œufs de Megaloolithus mamillare sur une longueur de deux mètres. Pour cette disposition en file, l’hypothèse d’une nidification dans un monticule d’incubation semble être la plus appropriée, et en accord avec les calculs de conductance très élevée. Par actualisme, ces pontes n’ont pu être faites que par un reptile en position accroupie et avançant lentement pendant la ponte (Dughi et Sirugue 1976, Ginsburg 1980) et déposée à la surface du sol ou dans une litière végétale puis recouverte de terre. On retrouve ces pontes chez certains crocodiliens (Ogden 1978).
Ces différents types de nidations ne sont pas rares chez les reptiles. C’est pourquoi les travaux de Greer (1970, 1971) et de Campbell (1972) chez les crocodiliens actuels ont étudié les corrélations possibles entre les différents types de nids et l’environnement pédologique, thermique et hydrique. Ils en conclurent que les monticules d’incubation correspondaient à des populations nidifiant dans des zones de marécages et que les cavités creusées dans le sol se rapportaient à des espèces vivant sur des berges ou des plages. Mais ces conclusions ne font pas l’unanimité, car certains auteurs (Ogden 1978, Magnusson 1982) pensent que la morphologie du nid serait liée aux dangers représentés par l’eau, et que dans les zones de crues brutales, les monticules d’incubation permettraient aux œufs de survivre (Webb et al 1977, Joanen et al 1977, Magnusson 1982b). D’autres encore, dont Dughi et Sirugue (1976) soutenaient que « …les pontes n’ont pas été déposées dans la vase comme on l’a dit, mais à l’air libre… ». Pour ce faire, ils s’appuyaient sur l’argument que les stratifications entourant les pontes étaient planes et donc, que c’étaient lors de crues que des limons se déposaient et conservaient les œufs. Mais, même si l’argument semble bon, cette théorie n’est plus retenue aujourd’hui. En effet, il est difficile d’expliquer avec ce scénario que les œufs ne soient pas brisés et que la structure des nids soit conservée (Erben et al 1979, Kerourio 1981). De plus les études de conductance (voir ci-dessous) infirme l’hypothèse de la nidification aérienne.
Haut de la page
2) Etudes de la paléobiologie des œufs par la conductance à la vapeur d’eau de la coquille
La conductance à la vapeur d’eau (GH2O) pour un œuf actuel ou fossile est définie par :
GH2O = 23,42 x Ap x L-1
(Seymour 1990) en mg H2O torr / jour
L = longueur moyenne des canaux aérifères en cm
Ap = surface des pores totale en cm2
La conductance d’un œuf avien est définie par :
GH2O = 0,432 x 0,78 M
(Ar et al 1974)
M = masse de l’œuf.
Grâce à un matériel important de Megaloolithus aureliensis, Cairanoolithus dughii, M.siruguei, M.mamillare, Prismatoolithus matellensis et de trois ootypes inédits, soit 66 œufs entiers ou non, une équipe a révisé les résultats de Williams, Seymour et Kerourio. Les résultats de la conductance des œufs (fig. 2) sont entre 8 et 87 fois supérieurs à ceux calculés pour des œufs aviens de mêmes dimensions, ce qui confirment les données obtenues par Seymour (1980), Seymour et Ackerman (1980), et Seymour et Kerourio (1984).
|
Types d’oeufs
|
Megaloolithus aureliensis
|
Cairanoolithus dughii
|
Megaloolithus mamillare
|
Ootype inédit 1
|
Ootype inédit 2
|
Ootype inédit 3
|
|
Surface porale estimée (cm2)
|
20,4
|
14
|
16,1
|
79,1
|
9,81
|
53,2
|
|
Longueur moyenne d’un pore (en cm)
|
0,09
|
0,19
|
0,09
|
0,1
|
0,07
|
0,14
|
|
GH2O estimé (mg/torr/jour)
|
5137,2
|
1707,7
|
4236,6
|
18903,2
|
3429,1
|
8899,6
|
|
GH2O prédit avien
|
173,5
|
223
|
256,5
|
216,1
|
80,9
|
147,4
|
|
Rapport GH2O prédit à Gh2O avien
|
29,6
|
7,6
|
16,5
|
87,4
|
42,3
|
60,3
|
Fig. 2 : Tableau de conductance. http://www.geocities.com/phkerourio/
La très haute conductance de ces œufs s’explique par l’importante surface des pores (9 à 79 cm2) et du grand nombre de pores (100 000 à 600 000) soit 3 à 13 fois plus important que pour des œufs aviens calculé par l’équation suivante :
Nombre de pores = 1499 x masse de l’œuf (g) puissance 0,420
(Tullet et Board 1978)
Par comparaison, les œufs de reptiles actuels nidifiant en milieu très humide ont des conductances variant de 2 à 5,5 fois celles d’œufs aviens (toujours pour une même taille).
Ces résultats tendent à confirmer l’hypothèse, souvent controversée, selon laquelle les œufs retrouvés dans le Maastrichtien d’Aix-en-Provence auraient été incubés dans des conditions de haute humidité et dans un environnement probablement souterrain (Seymour 1980, Seymour et Ackerman 1980, Seymour et Kerourio 1984, Kerourio 1987). Donc, la nidification aérienne paraît fortement improbable sur un point de vue physiologique car dans ce milieu, la perméabilité de la coquille serait trop élevée et, même si l’embryon pouvait aisément respirer, il aurait subit une déshydratation rapide.
Haut de la page
C) Les œufs
Les œufs de ces reptiles fossiles disparus à la fin de l’ère Secondaire pouvaient être très gros, par exemple, de la taille d’un ballon de football. L’examen de la face interne de leur coquille peut permettre de déterminer si l’embryogenèse est parvenue à son terme et si l’œuf a éclos (fig. 3 et 4).

Fig. 3 : Un oeuf non éclos (Cairanoolithus nov. sp.). Section radiale en lumière naturelle de la couche mamillaire. L'extrémité des mamilles est encore insérée dans des vestiges de la membrane coquillière. Aucune dissolution de la substance minérale de l'oeuf par l'embryon n'est survenue. Gisement de La Cairanne, Colline des Chapeliers, commune de Rousset-sur-Arc (Bouches-du-Rhône), Rognacien inférieur, Maastrichtien supérieur. http://www.geocities.com/phkerourio/

Fig. 4 : Un oeuf éclos (Cairanoolithus dughii). Section radiale en lumière naturelle d'une partie de la couche mamillaire. La mamille visible sur la photographie montre, à sa base, un "cratère de résorption" indiquant la survenance d'un processus de dissolution des substances minérales présentes dans la coquille de l'oeuf et son utilisation pour la construction du squelette de l'embryon. Gisement de La Cairanne, Colline des Chapeliers, commune de Rousset-sur-Arc (Bouches-du-Rhône, bassin d'Aix-en-Provence), Rognacien inférieur (Maastrichtien supérieur). http://www.geocities.com/phkerourio/
L’examen de l’oeuf a aussi permis de voir que les œufs fossiles d’Aix-en-Provence portaient des stigmates de plusieurs pathologies se traduisant par des altérations morphologiques et / ou microstructurales de l’œuf.
Haut de la page
1) Les coquilles multistratifiées
Ce phénomène a été décrit pour la première fois par De Lapparent (1947) sur des fragments d’œufs appartenant à Megaloolithus mamillare du Rognacien supérieur du gisement Frigara (Rousset-sur-Arc, Bouches-du-Rhône). Cette pathologie se traduit par une formation répétitive de la coquille (« ovum in ovo » Schmidt 1968) qui peut s’expliquer par la rétention de l’œuf dans l’oviducte qui passe plusieurs fois entre l’oviducte et la glande coquillière, et se voit attribuer une seconde coquille, puis une troisième….(fig. 5). La cause est assez mal connue : ce phénomène pourrait être induit par un dysfonctionnement de l’hormone vasotocine (Erben 1970, Erben et al 1979), ou dû à une carence alimentaire (Ewert et al 1983). Par contre, si la cause est discutable, les différents auteurs sont d’accords pour la conséquence de cette pathologie, c’est à dire l’obstruction des canaux aérifères, l’altération des échanges gazeux et un épaississement de la coquille et donc, la mort de l’embryon à court terme (Erben 1970, Erben et al 1979). Les coquilles multistratifiées semblent caractériser des espèces reptiliennes qui pondent plus d’une portée par saison (Ewert et al 1983). En effet, cette pathologie se retrouve chez des oiseaux et des reptiles actuels (Asmundson 1933, Nierbele et Cors 1962, Sturkie 1965, Schmidt 1968, Tyler 1969, Erben 1970, Hirsch 1987) très fréquemment chez les chénoliens (Erben 1972, Jakayar et Spurway 1966, MacFarland et al 1974, Kirsche 1979, Ewert et al 1983). En 1943, Schmidt mentionne une coquille de Testudo graeca formée de 5 couches, et en 1972, Erben signale un phénomène identique chez un crocodilien.

Fig. 5 : Megaloolithus mamillare. Section radiale en lumière polarisée d'une coquille présentant une "bi-stratification" d'origine pathologique. On distingue très distinctement dans la partie de la coquille une bande claire correspondante à une interruption survenue dans le processus de croissance de la coquille suivie d'une reprise. Un tel phénomène, en occasionnant une oblitération des canaux aérifères, était très certainement fatal pour l'embryon. (Rognacien supérieur, Maastrichtien supérieur du gisement de La Cardeline, commune de Châteauneuf-le-Rouge, Bouches-du-Rhône). http://www.geocities.com/phkerourio/
Ce phénomène fut pendant un moment interprété comme un élément de l’extinction des Dinosaures à la fin du Crétacé (Dughi et Sirugue 1958 et 1976, Thaler 1965, Erben 1970, Erben et al 1979), car cette pathologie était de plus en plus importante dans le Rognacien supérieur. C’était une imprudence car cette théorie reposait sur une connaissance partielle, à cette époque, des gisements du Midi méditerranéen et des types d’œufs. Par la suite, une étude statistique sur la fréquence de ces coquilles a démontré l’invalidité de la théorie (Kerourio 1981, Penner 1983).
Dans le bassin d’Aix-en-Provence les statistiques sont les suivantes :
• Les oeufs bi-stratifiés sont les plus fréquents : 80 % des spécimens récoltés.
• Les oeufs à trois, quatre ou cinq coquilles sont plus rares : 10 %, 7 %et 2 %.
• Les œufs hepta-stratifiés sont exceptionnels : moins de 1 % (fig. 6)
• Deux spécimens ont été retrouvés présentant huit couches, dans le Rognacien inférieur des gisements de Basségat (Var) et du Mouton (Bouches-du-Rhône), soit une épaisseur totale de la coquille de 25 mm (Ootype Megaloolithus siruguei).

Fig. 6 : Un fragment de coquille d'oeuf multistratifiée. Cet exemplaire (Megaloolithus siruguei) présente 7 couches superposées. Une telle pathologie, fatale pour l'embryon, est tout à fait exceptionnelle. Rognacien inférieur (Maastrichtien supérieur) du gisement de Basségat (commune de Fox-Amphoux, Var). http://www.geocities.com/phkerourio/
Les études statistiques sur la fréquence des coquilles multistratifiées ont démontré que la fréquence de cette pathologie variait suivant le type d’œuf considéré et non pas en fonction du rapprochement ou de l’éloignement de la limite Crétacé-Tertiaire. On a découvert, par exemple, que Megaloolithus siruguei (Aix, Rognacien inférieur et moyen) était plus concerné par ce phénomène (60 % de 550 spécimens) que Megaloolithus mamillare, M. aureliensis, M. petralta et Cairannoolithus siruguei, et même quasi-inexistant chez Prismatoolithus matellensis et apparentés.
Remarque : cette pathologie a été observée sur des coquilles dans le Crétacé supérieur du désert de Gobi par Sochava en 1970 et Mierzejewska en 1981, ainsi que dans la Maastrichtien continental de Gujarat en Inde par Mohabey en 1984 et Srivastava et al en 1986.
Haut de la page
2) Le nanisme et le gigantisme des œufs
Un Musée d’Histoire Naturelle de France a dans ses collections paléontologiques un spécimen provenant de marne grise intercalé dans le calcaire de Rognac du gisement du Stade de Rousset en 1975. Ce spécimen s’apparente à un œuf de Megaloolithus siruguei et a pour particularité son volume faible : 558,7 cm3 alors que le volume moyen habituel est de 2890 cm3. Ce cas ressort comme un cas pathologique car les autres œufs du gisement sont de tailles normales.
Le nanisme des œufs a été observé chez les oiseaux actuels (Pearl et Curtis 1916, Kirkpatrick 1916, Romanoff et Romanoff 1949 p.257, fig. 143-145) et est fréquent chez les jeunes femelles. Il peut aussi résulter d’une infection de l’extrémité postérieure de l’oviducte ou de la partie antérieure de la région sécrétant l’albumen qui a pour conséquence une constriction incomplète de l’oviducte (Romanoff et Romanoff 1949). Le nanisme est aussi observable chez les crocodiliens actuels, qui pondent des œufs très petit et infertiles, aussi caractéristiques des pontes de jeunes femelles (Ferguson et Joanen 1983, Ferguson 1985).
Le phénomène inverse peut se produire. Des cas de gigantisme ont été observés chez l’ooespèce Megaloolithus mamillare. Un œuf entier isolé a été retrouvé (le reste de la ponte a été détruit par l’érosion) dans le Rognacien supérieur du gisement de La Cardeline (Bouches-du-Rhônes) ainsi qu’une ponte d’au moins quatre œufs dans le gisement Frigara du même âge. L’œuf isolé pèse 7052 g (soit un volume de 6470 cm3), les œufs de la ponte, 7864 g (soit un volume de 7050cm3), 4414 g (V = 4050 cm3) et 3531 g (V = 3240 cm3) le dernier étant trop déformé pour être mesuré, alors que la masse moyenne pour cet ooespèce est de 3597 g. Nous avons donc, deux cas flagrant de gigantisme.
Comme pour le nanisme, le gigantisme pathologique est fréquent chez les oiseaux actuels. Pour preuve, l’Institut Pasteur à Paris conserve un œuf de poule de 320 mg, soit 5,5 fois la masse moyenne d’un œuf normal (Romanoff et Romanoff 1949). Ce cas de figure a été aussi observé chez le canard avec des œufs de 100 à133 mg alors que la masse normale est de 67 mg (Bauer 1895, Sumulong 1925). Malheureusement et contrairement au nanisme, les causes de ce phénomène restent pour l’instant inconnues.
Haut de la page
3) Les œufs fracturés dans l’oviducte
Chez Megaloolithus aureliensis, M.siruguei, M.petralta, M.mamilare et Cairanoolithus Dughii (et d’autres ootypes non encore décrits) sont observées des fractures reconsolidées dans l’oviducte. Grâce à l’examen de la surface externe de la coquille, on observe la présence d’une « néo-formation » caractérisée par une croissance anormale et un développement anarchique de la coquille le long de la fracture.
Comme pour les autres pathologies, des cas de fractures de la coquille survenues durant sa formation dans l’utérus ont été rapportées chez les oiseaux actuels (Romanoff et Romanoff 1949, p 273, fig. 160). Ici, les fractures sont ressoudées par un matériel calcique additionnel, toutefois, la cicatrice reste bien visible. Comme pour le gigantisme, les causes restent pour le moment inconnues.
Les œufs fossiles de dinosauriens trouvés dans le bassin d’Aix-en-Provence ont révélé plusieurs pathologies. Une étude plus détaillée de ces phénomènes reste à faire pour compléter les connaissances sur la physiologie des dinosaures de la fin du Crétacé en Provence.
Haut de la page
II) Cas du Portugal
A) Chronologie et importance
1) Historique
Au Portugal, un œuf de Dinosaure fut découvert dès 1908 près d’Alfeizerão (à l’Est de Porto) dans des sédiments du Kimmerdgien-Portlandien. Cet oeuf était cassé par le milieu et de forme allongée (dimension 13 x 19 cm), il fut attribué au Stégosorien Omosaurus lennieri (De Lapparent et Zbyszewski 1957). Puis un peu plus récemment, la mine de Guimarota livra des fragments de coquilles dans des sédiments datés du Jurassique supérieur (Erve A. van et Mohr 1988). A Paimogo (à 60 kilomètres au N-NW de Lisbonne, près de Lourinhã dans le centre du Portugal) en 1993, des fragments furent trouvés sur le sol par Isabel Mateus. Ces coquilles se trouvaient dans des terrains du Kimmeridgien supérieur-Tithonien inférieur au sommet d’une falaise, découvert par l’érosion. En 1995 et 1996, plusieurs pontes constituées par des œufs bien conservés et abondants furent dégagés, tandis qu’un lavage des sédiments permis de récolter plusieurs restes osseux : des os de petites tailles provenant des œufs, des vertébrés contemporains des pontes, des dents isolées (de Théropodes) et un fragment de mandibule avec deux dents de mammifères.
Haut de la page
2) Généralité sur Lourinhã
La découverte de Lourinhã (fig. 7) est exceptionnelle pour plusieurs raisons :
Premièrement, les œufs dans les niveaux du Jurassique sont rares. Pour preuve, dans l’inventaire des gisements (Carpenter et Alf 1994) ne figurent que trois localités ayant livré des œufs fossiles datés du Bathonien et Oxfordien de Grande-Bretagne (dont rien ne prouve que ce soient des œufs de dinosauriens, même s’ils ont été attribués à des reptiles par Van Straelen en 1928) auxquels il faut ajouter celles du Colorado et d’Utah (Hirsch et al 1987, Hirsch 1989, Scheetz 1991, Young 1991 et Kirkland 1994) dans le Jurassique supérieur, et celle d’Afrique du Sud (Kitching 1979, Grine et Kitching 1987) pour le Jurassique inférieur.
Remarque : les œufs de Paimogo ressemblent le plus aux œufs du Colorado.
Deuxièmement, la conservation du gisement est remarquable car les pontes sont extrêmement bien préservées. Sur le terrain, trois pontes ont été récoltées mais une seule a été dégagée (en 1997) comportant 34 œufs conservés en totalité ou partiellement.
Troisièmement, l’œuf n°10 présente des restes osseux en connexions et donc témoigne de la présence d’embryons dans certains œufs. Les os retrouvés aux alentours des œufs y sont comparables, ils appartiennent donc aussi à des Théropodes. C’est le point le plus remarquable de ce gisement, car il permet aux chercheurs d’associer avec certitude, un morphotype de coquille d’œuf à des restes squelettiques de dinosaures Théropodes. L’espèce de Théropode ayant pondu ces œufs n’est pas connue, mais de nombreux restes trouvés proches du gisement dans le Kimméridgien seraient attribués à Megalosaurus insignis ou Megalosaurus pombali (de Lapparent et Zbyszewski 1957).

Fig. 7: Localisation géographique du gisement de Lourinhã
Haut de la page
B) Pontes et œufs
Les longues et minutieuses fouilles ont permis de séparer le gisement en 6 grands blocs de 75 x 78 cm à 24 x 30 cm, chaque bloc renfermant des dizaines et dizaines d’œufs plus ou moins bien préservés.
Le bloc 1 a été bien étudié (fig.  :
:

Fig. 8: Ponte de 34 œufs en partie dégagée. A gauche, vue de la ponte et à droite, position des œufs.
Son sommet comprend 34 œufs serrés dont quatre (n°10, 45 48 et 56) comportent visiblement des os de membres et de vertèbres. Malheureusement la taille des œufs ne peut être obtenue que par une moyenne, car leur taille actuelle varie selon l’écrasement qu’ils ont subi, exemple :
| Œuf |
Longueur |
largeur |
| n°10 |
130 mm |
80 mm |
| n°27 |
137 mm |
88 mm |
| n°28 |
117 mm |
100 mm |
| n°29 |
125 mm |
96 mm |
| n°37 |
137 mm |
87 mm |
Les caractéristiques des œufs sont les suivantes :
La coquille est noire, d’épaisseur faible (0,6 à 0,7 mm), et possède de larges pores répartis irrégulièrement mais en moyenne distant de 2,5 à 3,5 mm. Si la face externe est lisse (fig. 9 haut), donc sans ornementation, la face interne présente un guillochage caractéristique (fig. 9 bas), certainement dû à une dissolution qui se produit chez les oiseaux actuels lorsque le squelette de l’embryon utilise les substances minérales de sa coquille.

Fig. 9 : en haut, vue externe d’une coquille montrant les pores. En bas, vue interne montrant la couche basale en partie dissoute. Barre = 1mm.
Pour étudier ces œufs, une série de lames minces de coupes radiales furent effectuées. Elles montrent une organisation relativement simple : des prismes de calcite verticaux et une couche basale très fine. Il faut prendre en compte le phénomène de dissolution expliqué ci-dessus qui a certainement aminci cette couche basale.
Les pores de grandes tailles (0,3 à 0,35 mm, soit la moitié de l’épaisseur de la coquille) sont généralement droits mais une des lames minces en montre un oblique (fig. 10), ce qui rapprocherait la coquille à celle d’un type dinosauroïd-prismatic et du morphotype d’obliquiprismatic décrit par Hirsch (1994, fig. 10.3. C-E). Hirsch plaça cette coquille dans les Prismatoolithidae, espèce Prismatoolithus coloradensis, caractérisée par :
o une coquille 0,7 à 1mm d’épaisseur.
o une surface externe lisse.
o un œuf elliptique de 110 x 60 mm.
o une extrémité légèrement pointue.
o des pores simples irrégulièrement disposés.

Fig. 10 :Coupe radiale dans la coquille au niveau d’un pore, en lumière polarisée. La surface externe est en haut sur la photo (x 50). En haut, pore légèrement oblique. En bas, pore vertical.
Haut de la page
C) Les embryons
1) Attributions des restes
Aux alentours et à la surface de certains œufs fracturés ont été découverts des dizaines de petits os. Le plus représentatif est l’œuf n°10 (fig.11), car il montre des os de membres et une vertèbre en place, ainsi qu’un fragment de coquille portant une vertèbre sur sa face interne (fig.11).

Fig. 11 : A gauche, l’œuf n°10 avec restes osseux d’embryon. A droite, vertèbre sur une coquille.
Les os récoltés sont très petits, exemple :
• une tête de fémur = 5 mm de large.
• l’extrémité distale d’un autre fémur = 5 mm d’épaisseur et 6 mm de largeur.
• les vertèbres (60aine) ne mesurent que quelques millimètres.
De plus, l’arc neural des vertèbres est séparé de leur centrum, et la surface des os est rugueuse alors que pour les adultes, elle est lisse, ce qui traduit l’état juvénile de ces ossements.
Grâce à ces os retrouvés (vertèbres, os de membres, métapodes et fragments crâniens), ces œufs ont été attribués à des reptiles grâce à :
• l’épaisseur des parois osseuses.
• la solidité des parois osseuses.
Puis à des dinosaures, grâce à :
• la forme des extrémités.
• l’allure rectiligne des diaphyses des fémurs et des tibias.
Et pour finir, à des dinosaures Théropodes (dinosaures carnivores), grâce :
• à la forme de la tête fémorale (fig.12 A).
• à la forme du petit trochanter.
• aux deux condyles bien développé à l’extrémité distale du fémur avec la forme caractéristique du condyle médial et du condyle latéral (fig. 12 B et C).
• à la forme du plateau tibial (fig. 12 D et E).
• à la diaphyse creuse des fémurs et des tibias.
Les autres pièces trouvées sont :
• Un fragment de crâne (fig.12 F) dont le condyle est reconnaissable.
• Une vertèbre dorsale antérieure comportant une cavité pleurocoele (fig.12 G).

Fig.12 : A, extrémité proximale d’un fémur droit en vue antérieure. B, extrémité distale de fémur en vue antérieure. C, extrémité distale de fémur gauche en vue distale. D, plateau tibial d’un tibia droit en vue proximale. E, extrémité proximale d’un tibia droit en vue latérale. F, fragment d’un plancher crânien en vue latéral avec le condyle occipital. G, vertèbre dorsale antérieure avec sa cavité pleurocoele en position antéro-dorsale.
Haut de la page
2) But de l’étude
Les restes retrouvés dans le gisement de Lourinhã offrent aux chercheurs une occasion inespérée d’analyser la paléobiologie dinosaurienne, et tout particulièrement l’histologie osseuse d’embryons in ovo de Théropodes du Jurassique supérieur. Ce matériel, qui peut être considéré en excellent état, permet de reculer dans le temps pour accroître les connaissances de l’ostéogenèse précoce et de l’acquisition de la forme, grâce à des analyses des croissances diamétrales et longitudinales dans les os retrouvés.
Ces études se font déjà depuis les dix dernières années, mais le manque de matériel et le manque de standardisation des techniques et du vocabulaire ont fait que l’avancement sur le sujet fut difficile. Toutefois, le nombre de découvertes d’embryons et de dinosaures juvéniles (donc de matériel in ovo) augmentant, la recherche peut se concentrer aujourd’hui sur les sujets de la croissance et sur les liens phylogénétiques (les Théropodes étant considérés comme étroitement liés avec la généalogie des oiseaux). Toutes ces découvertes ont stimulé les études sur des animaux actuels, tel que les oiseaux, pour obtenir les rapports entre les typologies de tissus osseux et leur taux de croissance permettant une extrapolation au matériel fossile.
Remarque : dans ces études il faut faire attention au terme d’embryon : ici le sens de ce mot est large car « l’embryon fossile » a passé l’étape embryonnaire réel et en est plutôt au stade « d’oisillon ».
Haut de la page
3) L’ossification périostique et la croissance des diaphyses
Les corticales des restes de Paimogo sont caractéristiques d’un os embryonnaire, de texture très lacunaire. En effet, le cortex, entièrement primaire, est constitué de minces rangées osseuses (apparaissant isotropes en lumière polarisée avec des grosses logettes périostéocytaires) séparées par de grands et nombreux espaces vacuolaires, portant la porosité à 50 % ou plus (Fig.13, 1 et 4). A ce stade il n’y a pas encore de dépôt ostéonal (fig.13, 1 et 4).

Fig. 13: 1, diaphyse d’un os long indéterminé en section transversale. L’os est déposé en fines travées irrégulières séparées par d’importants espaces vasculaires. Nombreuses logettes périostéocytaires, à réseau caniculaire bien développé. Pas de dépôt ostéonal. 4, diaphyse fémorale en section transversale. Observations des travées et des espaces vacuolaires.
Ces rangées osseuses peuvent êtres disposées de façons différentes d’un os à l’autre et parfois même, sur la même section :
• certains os, ou région osseuses, ont des rangées osseuses ayant régulièrement une orientation concentrique, induisant une organisation laminaire du cortex.
• d’autres ont des rangées osseuses disposées irrégulièrement, induisant une organisation réticulaire des tissus.
De nombreuses observations ont permis de mettre en évidence un phénomène de dérive latérale de la cavité médullaire. Cette dérive est en rapport avec la croissance différente entre les faces opposées de l’os, et cause un accroissement asymétrique du cortex pour la pallier. Souvent, la périphérie de la cavité médullaire montre des signes de résorption (lacune de Howship = accroissement au dépens du cortex profond). Certains os ne présentent pas de rangées osseuses (diaphyse tabulaire) et d’autres présentent une spongiosa formée de fines travées endostéales irrégulières.
Remarque importante : il a été observé que l’os périostique cortical est similaire à celui d’un oisillon au stade proche de l’éclosion. Il en a été déduit une vitesse d’ostéogenèse élevée et radiaire de 20 µm / jour ou plus.
Haut de la page
4) L’ossification enchondrale et croissance des épiphyses
Un cartilage calcifié, plus ou moins hypertrophié, constitue les extrémités des os longs, et peut être observé en îlots dans l’épaisseur des travées osseuses. Ce cartilage est en relation avec la cavité médullaire primitive ou avec la surface conservée de l’épiphyse par des séries de tubes allongés. Certains tubes ont pour origines la moelle osseuse et fonctionnent comme des baies d’érosion dans le cartilage en direction de l’épiphyse (leur paroi pouvant être associée à un dépôt d’os enchondral). Par contre, en direction diaphysaire, les baies d’érosion s’élargissent et se rejoignent pour former une structure en spongiosa.
En général, les observations faites ici, se retrouvent assez clairement chez les jeunes oiseaux en croissance. En effet, les tubes en position épiphysaire seraient comparables à des véritables canaux du cartilage chez les oiseaux, et non pas de simples baies d’érosion d’origine médullaire. Ceci serait confirmé par l’accroissement de ces canaux en direction de la surface épiphysaire, mais infirmé par la présence d’un mince dépôt enchondral à leur périphérie qui traduirait une colonisation du dépôt provenant de la moelle. Une grande lacune centrale dans la métaphyse est souvent occupée par des sédiments et quelques îlots de cartilage suggèrent l’existence d’un cône cartilagineux médullaire de type avien. Ce cartilage étant non calcifié, il ne serait pas fossilisé.
Haut de la page
5) Acquisition de la forme
Les différences anatomiques, comme la forme et la taille du squelette, sont des conséquences morphologiques des processus histogénétiques qui peuvent être observés par l’examen histologique. La différence morphologique entre os courts (vertèbres) et os longs (membres) apparaît en relation avec différents points :
• l’épaisseur du cartilage calcifié.
• la disposition des baies d’érosion.
• aux vitesses des ossifications périostiques et enchondrales.
On peut observer que la différenciation d’une tête fémorale excentrée est assurée par une région de résoption métaphysaire spécifique et les structures de l’extrémité du fût fémoral et du grand trochanter interne sont clairement différentiables. Nous pouvons aussi observer les détails histologiques responsables de la mise en place du trochanter interne (fig.14) et du quatrième trochanter.

Fig.14: région épiphysaire proximale d’un fémur en section transversale passant par le fût osseux principal (x) et par le trochanter interne (+). La cavité osseuse métaphysaire (x), probablement occupée in ovo par le cône cartilagineux médullaire, est entourée de travées enchondrales.
Haut de la page
D) Conclusion
Les types de tissus périostiques qui constituent les diaphyses des os longs et les parois des vertèbres sont typiques d’un os fœtal ou embryonnaire, et susceptibles d’être déposés à grande vitesse. D’un autre côté les observations faites sur les structures épiphysaires des os longs suggèrent une croissance longitudinale rapide.
Ces études tendent à rapprocher encore un peu plus les Théropodes et les oiseaux, par la présence probable de canaux du cartilage et d’un cône cartilagineux médullaire.
Pour conclure sur les Théropodes du gisement de Paimogo, il faut dire que l’observation la plus importante est que la forme semble se mettre en place précocement. En effet, la conservation remarquable des fossiles a permis de voir avec précision les détails anatomiques de chaque os, et même de chaque région de l’os, traduisant l’acquisition précoce de leur aspect. Ces petits détails ont été observés chez des Théropodes adultes, avec pour différence un facteur 100 en taille. Donc, il en ressort le maintient des caractéristiques morphologiques tout au long de la trajectoire ontogénique.
Conclusion :
Les découvertes d’œufs fossiles se font de plus en plus souvent, offrant aux scientifiques un matériel sans égal à étudier. Ces trouvailles conduisent à trois études principales : premièrement, étudier les pontes, deuxièmement, les œufs, et troisièmement, quand la chance s’y associe, l’études des embryons conservés dans ces œufs. Les observations sur les coquilles permettent une classification parataxonomique, et donnent des renseignements sur la paléobiologie (en relation avec les structures des pontes). Celles faites sur les embryons conduisent à étudier la morphogenèse, l’ontogénie (en comparant avec des formes adultes), et donnent parfois des arguments sur la phylogénie. Quant aux études simultanées des coquilles et des embryons, elles permettent d’associer un type de coquille (avec toutes ses caractéristiques) à une espèce (si et seulement si l’embryon a pu être attribué à une espèce). Bien entendu, beaucoup des observations engendrent, en parallèle, des études sur des animaux actuels (utilisation de l’actualisme).