- L’embryon a les mêmes organes que l’adulte.
- Le plan d’organisation est différent de celui de l’adulte (c’est le cas de la larve). Il faut une étape supplémentaire post-embryonnaire (métamorphose).
Chapitre 1 :
Le développement embryonnaire des amphibiens.
I Les œufs.
Comme chez tous les vertébrés, l'organogenèse est un phénomène discontinue. Après une phase de multiplication, les ovogonies deviennent des ovocytes primaires restant bloqués en prophase méiotique. Viennent ensuite les ovocytes secondaires qui, une fois libérés de l'ovule, sont captés par l'oviducte. Il y a lors fécondation. La rupture de l'ovaire et la fécondation, régulent l'ovogenèse.
En trois ans, l'ovocyte primaire augmente de taille : elle passe de cinquante micromètres à 2 millimètres. Ces ovocytes permettent le stockage de matériaux dans les ovaires. Les matériaux stockés sont de 2 types :
- nutritifs (vitellus).
- endogènes (ARN messagers, transcrits), ils permettent une multiplication nucléaire. Ils permettent aussi la transition blastuléenne par une traduction en protéines.
La transition blastuléenne : tous ces éléments sont traduits en protéines et il aura ensuite développement de l’œuf.
Dans l'ovaire, l'ovocyte primaire augmente considérablement de taille durant trois ans chez Rana esculenta, avant la ponte ovulaire. Le noyau constitue la vésicule germinative : le noyau est bloqué en prophase 1 de méiose.
Dans l'ovocyte primaire, il y a stockage de matériaux nutritionnels d'origine exogène apportés par la circulation maternelle. Il y a des protéines, des vitellogénines qui sont synthétisées par le foie de la mère et captées par les cellules folliculaires entourant l'ovocyte puis, transformées par l'ovocyte après déshydratation en complexes phosphoglycolipoprotéiques. Les phosphoglycolipoprotéines sont appelées plaquettes vitellines.
L'ovocyte primaire stocke aussi du matériel d'origine endogène permettant l'expression de l'information génétique. Il s'agit de ribosomes : on parle d'amplification de cistrons ribosomiques.
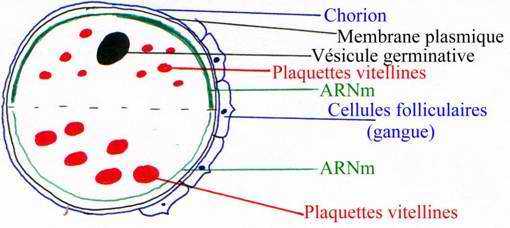
A maturité, cet ovocyte primaire a un noyau volumineux excentré vers le côté. Il se différencie en 2 hémisphères : un pigmenté qui représente le pôle animal et un autre, dépigmenté qui représente le pôle végétatif.

L'ovocyte va stocker des matériaux exogènes. Le précurseur est la vitellogénine (470 kDa). Celle-ci est synthétisée par le foie de la femelle, elle circule dans le sang et va être internalisée dans des endosomes puis dans des lysosomes et, elle sera enfin dégradée en phosphovitine et lipovitelline qui vont être déshydratées et qui vont donner les plaquettes vitellines (structure cristalline). Elles sont stockées en réserve puis dégradées par des enzymes le moment venu. Au pôle végétatif : les grosses plaquettes vitellines vont rester sur place. Au pôle animal, les petites plaquettes vitellines vont être transportées par des filaments d'actine vers le centre de la cellule : on obtient un gradient vitellin. On a alors une distribution symétrique des molécules.
Les matériaux endogènes : ont trouve du glycogène stocké autour des noyaux, des ribosomes, du réticulum endoplasmique et des lipides (tous sont répartis autour du noyau). On trouve de l'ARN de tous types qui est réparti d'une certaine manière. L'ARN est plus riche vers le pôle animal que vers le pôle ventral.
L’ARN messager Vg va coder pour la synthèse de facteurs de développement du pôle ventral dans l’induction du mésoderme. D’autres ARNm vont coder pour la synthèse de molécules adhésives, de catéine qui entraîne une localisation préférentielle des ARN au pôle animal ou ventral.
Sous la membrane plasmique, il y a des granules pigmentaires qui confèrent une couleur à l’œuf : on parle de calotte pigmentaire dans le cytoplasme cortical qui contient beaucoup de vitellus, de mitochondries, de granules corticaux.
La taille de l’ovocyte I est comprise entre 5 µm et 2 mm.
Cet ovocyte se libère de l’ovaire et sera émis dans l’oviducte femelle. Il y a alors reprise de la première division méiotique, métaphase I, avec production d’un globule polaire qui donnera un ovocyte II qui restera en métaphase II dans l’oviducte. Il sera ensuite émis dans l’eau puis, fécondé par le mâle.
Au moment où l’ovocyte I est émis, il achève sa première (sinèse) division méiotique et rejette le globule polaire qui se manifeste au pôle animal par une région dépigmentée : la tache de maturation.
Cet ovocyte s’entoure d’une gangue glycoprotéique (muqueuse) qui est sécrétée durant le transport dans l’oviducte. Elle a pour fonction de créer des conditions favorables pour la fécondation. Elle apporte des ions comme Ca2+ et Mg2+. Elle a aussi un rôle protecteur en empêchant les œufs de se déshydrater quand ils sont émis hors du cloaque. Cette gangue fait adhérer les cellules entre elles : ensemble cohésif.
II La fécondation.
Celle-ci est variable chez les amphibiens. On distingue deux types distincts : la fécondation des anoures et des urodèles.
A Les anoures. Exemple : le Xénope.
La fécondation est externe. Le mâle va chevaucher la femelle en répandant son sperme au moment où les œufs sont pondus.
La fécondation doit avoir lieu dès l’émission des ovocytes par la femelle. La gangue, hydrophile, gonfle au contact de l’eau et devient rapidement un obstacle à la pénétration des spermatozoïdes (fécondation).
B Les urodèles. Exemple le Triton (pleurodèle).
La fécondation a lieu au niveau du cloaque de la femelle ; il n’y a pas d’organe copulateur. Le mâle émet un spermatophore (formation mucilagineuse) au niveau duquel sont agglutinés les spermatozoïdes. Ce spermatophore va adhérer au substrat (caillou).
La fécondation est dite interne et se produit au niveau du cloaque (canal mixte urogénital et dont les lèvres viennent enserrer le spermatophore).
La pénétration des spermatozoïdes a lieu généralement au niveau du pôle animal car c’est là où il y a le moins d’encombrement.
Il y a monospermie chez les anoures (un seul spermatozoïde rentre) mais polyspermie chez les urodèles (5 ou 6 spermatozoïdes rentrent mais un seul va féconder le noyau). La fécondation va entraîner une activation dans l’ovocyte : deux types d’activation (interne et externe).
Dans le cas d’une activation interne, il y a reprise de la deuxième division méiotique avec émission d’un second globule polaire et la formation d’un pronucléus femelle.
Le spermatozoïde perd son flagelle. L’acrosome vient se fixer sur un récepteur, traverse la membrane vitelline et, au contact de la membrane plasmique, va produire une dépolarisation de la membrane en modifiant le potentiel de celle-ci. Cette dépolarisation de quelques minutes est suivie d’une repolarisation. Ce phénomène entraîne une libération de Ca2+ (Ca qui provient du réticulum endoplasmique lisse et des mitochondries) dans la région corticale de l’œuf. Ce Ca permet la polymérisation des filaments d’actine (allongement de la cellule), ce qui a pour effet d’amener à la surface des granules corticaux. Ces granules libèrent leur contenu en faisant fusionner leur membrane (exocytose). Ces granules corticaux contiennent trois composants :
- mucopolysaccharides qui vont être émis entre la membrane plasmique et la membrane de fécondation (vitelline), constituant ainsi un gel hydrophile amenant de l’eau entre ces membranes et les décollant.
- Enzymes participant à la désolidarisation des 2 membranes.
- Glycoprotéines épaississant la membrane vitelline (de fécondation) qui se décolle.
Le gel formé dans l’espace périvitellin permet la rotation de l’œuf dans la demi-heure : c’est le premier phénomène d’activation externe. On trouve la rotation d’équilibre. Les œufs vont tourner selon la gravité ; on aura un équilibre selon l’axe pôle animal/pôle ventral.
Remarque : les granules corticaux n’existent que chez les anoures.
Après un temps variable (de une à quatre heures) et selon les espèces, on assiste à un mouvement de bascule de la calotte pigmentaire d’un angle d’environ 30°.
Il va ainsi libérer une région légèrement dépigmentée, le croissant gris, qui donnera la future région dorsale de l’embryon.
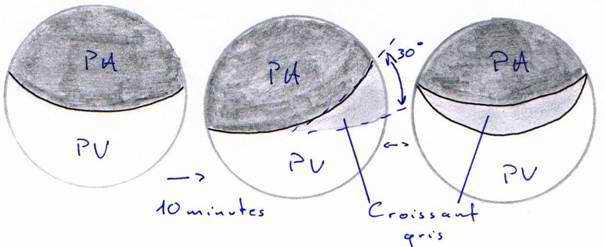
Remarque : chez les Urodèles, il y a un matériel visqueux entre la membrane plasmique et la paroi vitelline.
La région opposée au croissant gris donnera la région ventrale.
Le pôle animal et le pôle végétatif donnent respectivement la tête et la queue en formant l’axe antéropostérieur qui permettra la mise en place de l’axe dorso-ventral.
Cette rotation est appelée rotation de symétrisation et montre que l’embryon a délimité ses régions. Seule la région cytoplasmique tourne.
Lorsque la fécondation est monospermique, le croissant gris apparaît toujours diamétralement opposé au point de pénétration du spermatozoïde. Quand la fécondation est polyspermique, le croissant gris apparaît partout avec les mêmes potentialités.

La future face dorsale n’est pas une région très déterminée. Elle correspond à l’apparition d’une dissymétrie moléculaire qui entraîne une différence en un certain nombre d’acides nucléiques à cause de la rotation.
Le décollement de la membrane empêche la polyspermie. Le déplacement des molécules suppose l’initiation d’un mouvement et l’utilisation d’un support. Au cours de la rotation de symétrisation, on constate la formation d’un réseau de microtubules orientées parallèlement à la surface de l’œuf et servant de support au déplacement des déterminants moléculaires. Il y a aussi des molécules fournissant de l’énergie.
Tout ceci plaide en faveur d’une localisation moléculaire différentielle déterminant la future face dorsale de l’embryon. Du cytoplasme de la région du croissant gris qui est injecté sur la face ventrale d’un autre embryon va induire un deuxième embryon (siamois). Réciproquement, si l’on injecte du cytoplasme de la face ventrale, il ne se passe rien.
III La segmentation.
C’est une phase de divisions cellulaires : on passe d’un œuf unicellulaire à une blastula (6 à 10000 cellules). Cette segmentation implique de nombreux facteurs qui vont orienter les fuseaux.
Le premier plan de division passe par l’axe pôle animal/pôle végétatif, dit méridien et donne 2 blastomères égaux. Ce plan peut couper, ou non, le croissant gris.
Le deuxième plan de clivage est parallèle au premier et donne 2 méridiens égaux.
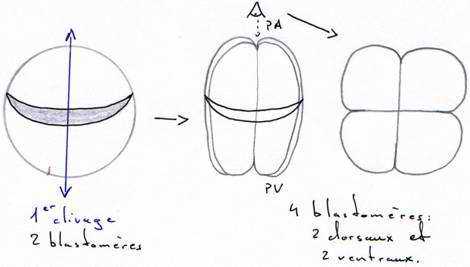
La segmentation est totale, et, pendant les deux premières divisions, elle est égale.
Au cours du troisième cycle cellulaire, la segmentation devient inégale (subéquatoriale) et donne 4 micromères au pôle animal et 4 macromères au pôle végétatif.
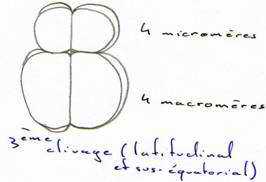
Les cycles cellulaires se poursuivent rapidement, sont synchrones jusqu’à la 10ème ou 12ème division puis, deviennent asynchrones. Ce cycle qui fait passer de la division synchrone à la division asynchrone est appelé transition blastuléenne.
Les cycles sont rapides jusqu’à la mi-blastula (pas de phase G1 ni G2).
Il y a une expression maternelle des gènes : toutes les protéines synthétisées le sont à partir d’ARN maternel stocké. Après la transition blastuléenne, les cycles s’allongent et apparaissent les phases G1 et G2 (G1, S, G2, M).
On a l’apparition d’un asynchronisme des divisions cellulaires. C’est une expression zygotique des gènes.
Au départ, on a un stade morula. Les cellules deviennent de plus en plus petites et vers la mi-segmentation, on aura le stade blastula.
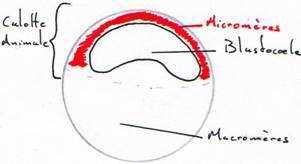
Il y a apparition d’une cavité de segmentation. Le stade blastula présente une cavité excentrée vers le pôle animal : c’est le blastocœle.
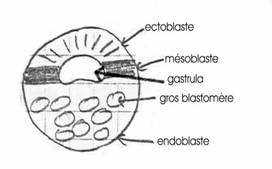
On a trois populations cellulaires qui se mettent en place pendant la gastrulation.
Cette blastula va synthétiser des molécules. A la fin de la segmentation, les micromères (du pôle animal) vont former la matrice extracellulaire qui permettra la suite des événements. Un des composants principaux est la fibronectine qui rendra possible la migration des cellules au cours de la gastrulation.
IV La gastrulation.
Il y a mise en place de trois feuillets :
- ectoblaste
- mésoblaste
- endoblaste
Ces trois feuillets vont migrer et s’emboîter pour former l’ectoderme, le mésoderme et l’endoderme. Ces formations sont réalisées grâce à des migrations cellulaires appelées mouvements morphogénétiques.
A Les phénomènes externes de la gastrulation.
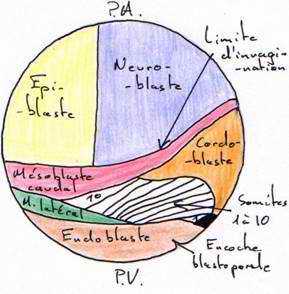
Il y a apparition d’une encoche blastoporale sous l’emplacement du croissant gris. Cette encoche résulte d’une invagination des cellules médiodorsales : c’est le stade grand bouchon vitellin.
Au stade petit bouchon vitellin, le blastopore devient petit.
A la fin de la gastrulation, il ne persiste qu’une fente : l’anus.
B Les phénomènes internes de la gastrulation.
L’analyse des mouvements morphogénétiques de la gastrulation a été rendue possible par l’utilisation de marqueurs colorés (ex : VOGT) : c’est l’aboutissement à la carte des territoires présomptifs.
- Les marques 1 à 4 : elles sont réparties dans la partie ventrale du système nerveux
- La marque 5 est dans le mésoderme caudal.
- La marque 6 est dans la corde dorsale.
- La marque 7 est dans le mésoderme précordal.
- Les marques 8 à 11 sont localisées dans la paroi ventrale du tube digestif.
Les mouvements de convergence, d’invagination, les mouvements cellulaires d’extension forment le processus d’épibolie.
Le mésoblaste donnera la musculature, la corde et des feuillets qui participent à l’emballage.
C Les mouvements morphogénétiques de la gastrulation.
A la partie inférieure médiane du croissant gris, un mouvement d’invagination se constitue, provoquant l’apparition d’une nouvelle cavité : l’archantéron.
Le blastocœle disparaît à la fin de la gastrulation.
Cette invagination intéresse un peu d’endoblaste, la plaque précordale (pharynx) puis le cordomésoblaste ainsi que le mésoblaste somitique et latéral. En fin de gastrulation, le blastocoele a complètement disparu et il est remplacé par l’archantéron qui est la future lumière du tube digestif.
Quand la gastrulation est terminée, les lames mésodermiques droite et gauche ne se sont pas encore rejointes. Elles ne le feront qu’au cours de la neuralation.
D’un germe à deux ensembles cellulaires (pôle animal et pôle végétatif), on passe progressivement, au cours de la gastrulation, à trois ensembles cellulaires qui s’emboîtent les uns dans les autres pour donner trois feuillets fondamentaux. En raison de la position respective de ces trois feuillets, on parlera d’ectoblaste à l’extérieur, de mésoblaste en position intermédiaire et d’endoblaste à l’intérieur.
On a différents types de mouvements :
- épibolie à allongement
- de convergence
- de divergence des lames latérales
- d’épibolie de l’ectoblaste pour compenser l’invagination du mésoblaste et de l’endoblaste
- d’extension au niveau du mésoderme somitique.
Tous ces mouvements entraînent les mouvements morphogénétiques de la gastrulation.
L’embryon, à la fin de la gastrulation, a toujours une forme cylindrique et le blastopore constituera toujours l’anus.
V La neurulation (mise en place de la plaque neurale).
Le processus d’induction neurale se fait lors de la gastrulation. Le cordomésoblaste vient au contact de l’ectoderme et induit celui-ci en plaque neurale (neurectoderme). Le cordomésoblaste va libérer des molécules qui permettent la différenciation et l’activation des gènes.
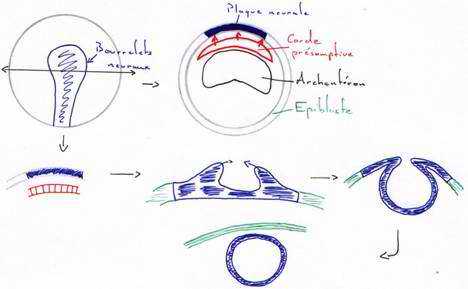
L’ectoblaste est compétent pour capter les signaux (moléculaires), mais cette compétence est transitoire.
Au début de la neurulation, il y a mise en place de la plaque neurale. On assiste en premier à des mouvements pigmentaires sur la face dorsale qui dessinent une aire en forme de raquette.
Ces traînées pigmentaires sont dues à un épaississement du neurectoderme en plaques neurales. Des bourrelets neuraux vont s’épaissir, se soulever puis se souder pour former le tube neural. La fermeture se fait d’abord dans la région du tronc puis dans celle de la queue (région caudale) et enfin, dans la région antérieure. Ce tube nerveux donnera l’encéphale et la moelle épinière. Ces cellules des crêtes neurales ont des capacités de migration importante grâce à la synthèse de matrice extracellulaire sur laquelle elles migrent.
Ces cellules qui vont migrer vont diffuser dans tout le corps et donner, des mélanophoresganglions spinaux (ou rachidiens), les systèmes sympathiques, les glandes endocrines (cellules sécrétant des pigments) qui donneront sa couleur a l’embryon, les (médullo-surrénales).
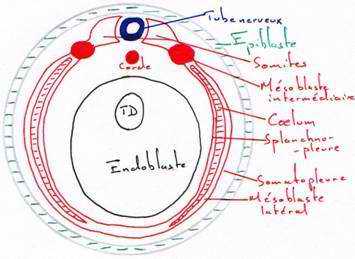
Pendant que se déroule la neurulation, on assiste à une régionalisation du mésoblaste en lame cellulaire pleine formant la voûte et les parois latérales de l’archantéron. Alors que les lames latérales se rejoignent ventralement, le mésoderme dorsal s’individualise, la corde s’isole et le mésoderme dorsal se métamérise en somites (blocs métamérisés). La région dorsale externe va donner le dermatome (derme de la peau). La région supérieure interne va donner le myotome (muscle strié), la partie inférieure interne donnera le sclérotome (les vertèbres). La région intermédiaire donnera les gonades et les reins.
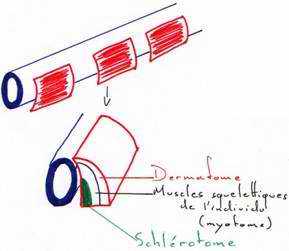
Les régions latérales et la région ventrale du mésoderme ne se métamérisent pas et se délaminent en deux feuillets :
- le plus externe, le somatopleure, donnera le squelette des membres, le péricarde et les muscles viscéraux
- la splanchnopleure va donner le cœur, les premières cellules sanguines, la paroi endothéliale des vaisseaux sanguins.
Ces deux feuillets vont constituer une cavité cœlomique (cavité générale du cœur).
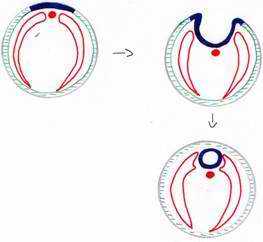
VI La formation du tube digestif.
A la fin de la gastrulation, la masse d’endoblaste constitue le plancher de l’archantéron.
Pendant la neurulation, les bords latéraux de l’endoblaste se soulèvent et viennent se souder dorsalement dans un mouvement inverse à celui du mésoblaste latéral.
L’endoblaste donnera l’épithélium du tube digestif, de l’appareil urinaire et pulmonaire. Celui-ci est étroite association avec le mésoderme splanchnique. L’endoblaste donnera des glandes annexes comme le foie, le pancréas.
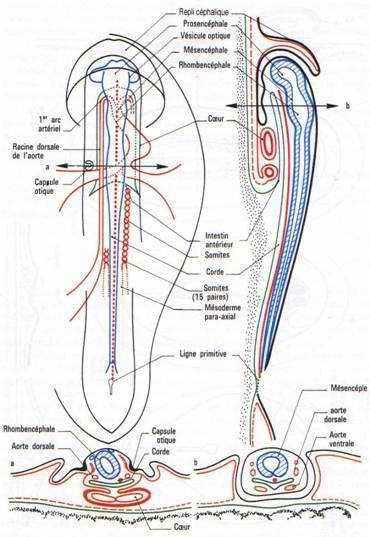
Au cours de la neurulation, le germe s’allonge dans le sens antéropostérieur. A la fin de cette neurulation, on distingue la tête et la queue : c’est le stade du bourgeon caudal. Divers organes apparaissent dans la région antérieure comme les yeux, les branchies, les ventouses adhésives pour les anoures ou le balancier pour les urodèles.
On assiste à une régionalisation du système nerveux donnant l’encéphale et la moelle épinière. Cet encéphale va devenir inducteur vis à vis de l’ectoblaste. C’est ainsi que le proencéphale induit la placode (vésicules) olfactive.
Le diencéphale va former 2 invaginations latérales constituant la rétine qui induit la formation du cristallin qui induira, lui-même, la formation de la cornée (cascade d’inductions).
Le rhombencéphale induit la placode auditive ou otique. Les tissus et les organes se mettent tous en place.
Chapitre 2 :
Le développement embryonnaire des oiseaux.
Introduction.
Les œufs : ce sont des télolécithes avec des réserves considérables, accumulées de deux manières.
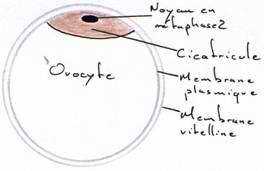
Au niveau de l’ovaire : l’ovocyte s’entoure de couches concentriques de vitellus, lequel est limité par une membrane vitelline. Le jaune représente l’ovocyte proprement dit. Le noyau est rejeté à la périphérie de ce vitellus et se situe dans une région périplasmique qui a l’aspect d’un disque : la cicatricule.
La vésicule germinative représente le noyau en prophase 1.
Ce vitellus permet le développement embryonnaire pendant 21 jours. Il est riche en lipides et fortement coloré par les caroténoïdes (coloration rouge). Durant son transit dans l’oviducte et après sa fécondation, le vitellus est entouré par l’albumen (de nature protéique : le blanc). Ce blanc représente pour l’embryon un supplément de réserves. Il est entouré par une membrane coquillaire double qui s’écarte au gros bout de l’œuf pour constituer la poche à air. Dans la partie inférieure de l’oviducte, l’œuf est revêtu d’une coquille calcaire.
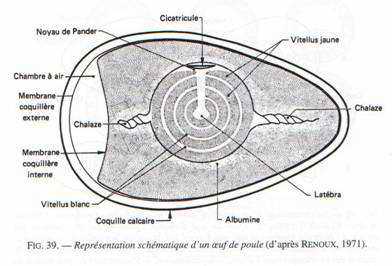
Seul l’ovaire gauche est fonctionnel.
La libération de l’ovule de l’ovaire ou ponte ovulaire provoque la reprise de la première division méiotique et donne un ovocyte 2 bloqué en métaphase 2.
La fécondation est interne et se fait dans la partie antérieure de l’oviducte, avant la sécrétion de l’albumen dans les 15 minutes qui suivent l’ovulation. Il y a polyspermie ; la pénétration du spermatozoïde provoque l’activation de l’œuf et la reprise de la 2ème division méiotique. Le développement embryonnaire commence durant le transit dans l’oviducte. La segmentation dure 24 heures puis, qui s’achève au moment de la ponte. Ce développement ne reprendra que si l’œuf est incubé à 38°C.

I La segmentation.
La segmentation va être partielle compte tenu de la taille, qui se limite à la cicatricule (disque au niveau du pôle animal). Cette segmentation commence 5 heures après la fécondation. Le premier plan de segmentation clive la cicatricule en deux et donne 2 blastomères.
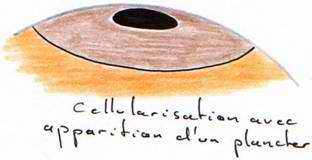
Le second plan de segmentation est aussi superficiel, perpendiculaire au premier et donne 4 blastomères. Ces deux plans de segmentation peuvent être considérés comme des méridiens. Le troisième plan se fait selon la verticale, perpendiculaire au second et donne huit blastomères. Le quatrième site de segmentation se fait selon la verticale, englobant huit blastomères au centre et huit à la périphérie : on atteint alors un stade de 16 blastomères.
Des plans horizontaux vont fermer ces blastomères. L’ensemble de la cicatricule ainsi segmentée est le blastoderme (64 à 128 blastomères).

Une cavité se creuse, le blastocoele primaire qui donnera la blastula primaire avec deux régions :
- l’aire pellucide donnera l’embryon proprement dit
- deux aires latérales : les aires opaques donnant la partie extra-embryonnaire.
Peu avant la ponte, le blastoderme constitue deux feuillets, l’ectophyle et l’entophyle (ou entophyle). C’est le stade blastula secondaire.
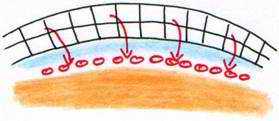
Ces deux feuillets délimitent une cavité qui est le blastocoele secondaire, équivalent du blastocoele de la blastula des amphibiens. Entre l’entophyle et le vitellus, il y a une cavité appelée l’archantéron primaire.
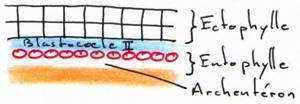
A ce stade, la symétrie bilatérale de l’embryon est acquise. Le développement s’arrête s’il n’y a pas incubation après la ponte de l’œuf.
II Développement durant le début de la gastrulation.
Juste avant le début de la gastrulation, une lame basale va se constituer sous l’ectophyle puis, des cellules issues de l’ectophyle vont migrer en profondeur et constituer l’hypoblaste et l’entophyle. L‘hypoblaste et l’entophyle donneront ultérieurement l’endoderme extra-embryonnaire qui recouvrera la totalité du vitellus.
III La gastrulation.
Pendant la migration, on voit apparaître un soulèvement.
La gastrulation débute par un épaississement de l’aire pellucide dans la région postérieure. C’est dû à la convergence des territoires superficiels vers la région médiane et postérieure. Cet épaississement s’allonge vers la 6ème heure d’incubation. Le blastoderme prend une forme ovale.
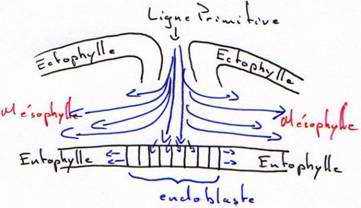
Entre la 10ème et la 16ème heure d’incubation, cet épaississement prend le nom de ligne primitive qui se creuse d’un sillon (fosselle primaire) qui correspond au blastopore des amphibiens. Elle est limitée vers l’avant par une région plus compacte : le nœud de Hensen qui est l’équivalent de la lèvre dorsale du blastopore (responsable de la mise en place de corde).
On a pu reconstituer une carte des territoires présomptifs (en 1937, grâce à Pasteels) par un marquage des cellules du blastomère par les particules d’encre de Chine qui permet d’analyser les mouvements morphogénétiques et la destinée des différents feuillets.
Si on se réfère à cette carte, on voit, qu’au fur et à mesure de l’allongement de la ligne primitive, c’est le matériel superficiel du mésoblaste des lames latérales et extra-embryonnaires qui converge le premier puis immigre en profondeur et diverge pour donner une lame mésodermique pleine, qui va s’insinuer entre l’ectophyle et l’hypoblaste.
Entre 10 heures et 16 heures, le mésoblaste précordal passe en profondeur au niveau du nœud de Hensen. Ce mésoblaste cordal converge vers l’axe médian puis s’insère entre l’ectophyle et l’entophyle puis s’allonge vers l’avant pour former un fin cordon cellulaire qui apparaît sombre par transparence, c’est le prolongement céphalique. La corde s’isole très tôt et permet la formation de la plaque neurale par neurulation.
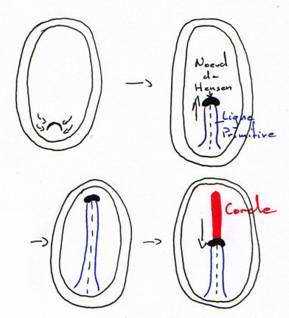
Entre la 18ème et la 19ème heure, la ligne primitive atteint son maximum d’élongation (à peu près deux millimètres). L’aire pellucide ne contient plus que de l’ectoblaste en surface. D’autres cellules issues de l’ectophyle, ayant immigré dans le blastocoele secondaire, vont constituer le mésophyle puis l’endoblaste définitif refoulant l’ectoblaste. Ainsi le mésophyle va contribuer à la formation de deux ensembles distincts : le mésoderme et l’endoderme de l’embryon.
L’hypoblaste et l’entophyle donnent l’endoderme extra-embryonnaire.
A 18 heures d’incubation, tout le mésoblaste des lames latérales et extra-embryonnaires a émigré en profondeur et a divergé au niveau de la ligne primitive délaissant la région antérieure de l’aire pellucide qui reste dépourvue de mésoderme : c’est le Proamnios.
A la fin de la gastrulation, la ligne primitive représente le blastopore très allongé dont la lèvre dorsale correspond au nœud de Hensen. L’aire pellucide ne contient plus en surface que l’ectoblaste, l’épiblaste et le mésoblaste.
IV La neurulation.
La gastrulation se poursuit jusqu’à la disparition de la ligne primitive. Elle se superpose à la neurulation. A 20 heures d’incubation, apparaît un épaississement superficiel en avant du prolongement céphalique (corde). Cet allongement correspond au bord de la plaque neurale qui se soulève en constituant le repli céphalique.
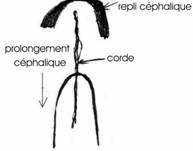
Le blastoderme s’allonge, la ligne primitive commence à régresser. A 24 heures d’incubation, les bourrelets neuraux se soulèvent et vont à la rencontre l’un de l’autre au niveau du futur cerveau moyen.
Dans la région antérieure, on distingue une formation en doigt de gant qui est l’amorce de l’intestin antérieure. A ce stade, la région antérieure de l’aire embryonnaire s’élève au-dessus du blastoderme puis, s’accroît vers l’avant donnant naissance au repli céphalique qui coince le feuillet endodermique sous-jacent en doigt de gant. Au de là de la limite postérieure, l’intestin antérieure n’a plus de plancher et communique avec l’archantéron directement au-dessus du jaune. Le mésoderme somitique commence à se métamériser et 4 paires de somites sont nettement individualisées. A partir de la 20ème heure, une paire de somites se forme toutes les heures.
A la 26ème heure, la fusion des bourrelets neuraux débute dans la région antérieure (au niveau du cerveau). Le cerveau reste ouvert par un neuroport antérieure se fermant vers la 33ème heure d’incubation. Les bourrelets neuraux postérieurs enserrent la ligne primitive qui régresse de plus en plus. Cette région correspond au sinus rhomboïdal.
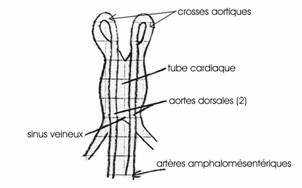
Entre la 25ème heure et la 33ème, le cœur va se différencier à partir d’un épaississement de la splanchnopleure. Ce tube cardiaque se poursuit vers l’arrière par 2 gros troncs veineux, les veines omphalomésentériques. Il apparaît deux aortes vers l’avant, aortes qui se replient en 2 crosses aortiques dorsales se jetant dans les 2 artères omphalomésentériques.
On a la formation d’un réseau vasculaire.
A 37 heures, le cœur bat.
A partir de la 33ème heure d’incubation, l’allure symétrique de l’embryon commence à disparaître. La partie antérieure du cerveau va se soulever et fléchir pour se tordre vers la gauche. L’embryon se soulève au-dessus du jaune puis subit une flexion dans la région antérieure et une torsion qui débute vers la 37ème heure.
Les vésicules optiques et auditives sont nettement visibles. Un repli a pris naissance en avant de la région céphalique : c’est le capuchon amniotique qui progressera vers l’arrière, participant à la formation de l’amnios qui recouvrira l’embryon.
A ce stade, le cerveau est constitué de trois vésicules : le proencéphale, le mésencéphale et le rhombencéphale.
A 48 heures d’incubation, l’embryon qui s’est soulevé au-dessus du jaune va se coucher sur le côté gauche. La ligne primitive disparaît à 50 heures. Le capuchon amniotique recouvre la moitié de l’embryon à 50 heures. Le cerveau est formé de 5 vésicules :

Le cerveau se courbe en un V dont le sommet est occupé par le mésencéphale.
A 60 heures d’incubation, le repli amniotique recouvre les 4/5 de l’embryon. L’allantoïde apparaît sous forme d’un diverticule endodermique de l’intestin postérieur.
A 96 heures d’incubation, la cavité amniotique est complètement refermée. Le bourgeon caudal et les membres antérieurs et postérieurs sont nettement reconnaissables.
Le modelage de l’embryon va se poursuivre avec la formation des annexes embryonnaires.
V Les annexes embryonnaires.
A La vésicule vitelline.
C’est le premier annexe à se former.
Cette vésicule résulte de l’extension des feuillets extra-embryonnaires à la surface du jaune, constitué par de l’endoderme doublé extérieurement par le splanchnopleure. Quand l’embryon se soulève, les ébauches antérieures et postérieures du tube digestif se mettent en place. Ces ébauches iront à la rencontre l’une de l’autre au niveau de la région moyenne de l’embryon et finalement, la vésicule vitelline ne communiquera plus avec l’embryon que par un pédicule vitellin.
La vésicule vitelline, dont les parois sont fortement vascularisées, représente un organe nutritionnel extra-embryonnaire. Les cellules endodermiques, grâce à des enzymes hydrolitiques, vont transformer le vitellus en produits solubles assimilables.
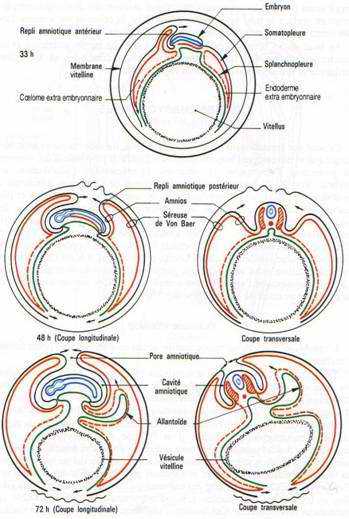
B L’amnios et la séreuse.
L’amnios est une membrane qui enveloppe l’embryon comme un sac, le séparant du milieu environnant. Un repli amniotique naît dans la région antérieure puis un second va apparaître dans la région postérieure. Ils sont formés d’ectoderme doublé par de somatopleure. Quand les replis fusionnent, la partie interne des replis sera l’amnios qui limite la cavité amniotique. La partie externe, sera la séreuse. Entre la séreuse et l’amnios se trouve le coelum extra-embryonnaire qui communique avec le coelum intra-embryonnaire au niveau des lames latérales.
La cavité amniotique est remplie d’une sérosité provenant de la déshydratation de l’albumen. Elle a pour rôle d’empêcher la dessiccation de l’embryon et de le protéger.
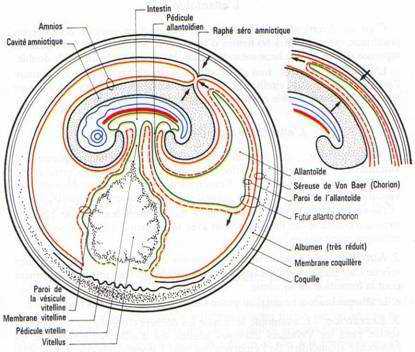
C L’allantoïde.
C’est un diverticule endodermique de l’intestin postérieur. Les invaginations de l’endoderme refoulent devant elles la splanchnopleure. L’allantoïde sera formé d’endoderme doublé extérieurement de splanchnopleure.
L’allantoïde va s’entendre considérablement de manière à venir entourer tout l’amnios et la vésicule vitelline, en refoulant l’albumen vers le petit bout de l’œuf.
L’allantoïde a quatre principaux rôles :
- L’ensemble allantoïde extérieur et séreuse constitue l’allantochorion qui, extrêmement vascularisé, a fonction respiratoire (nombreux échanges gazeux).
- Le contact étroit de l’allantochorion avec la coquille permet l’absorption de sels qui seront utilisés pour l’édification du squelette de l’embryon.
- Le voisinage de l'allantoïde et du sac de l’albumen permet l’absorption du blanc : rôle nutritionnel.
- L’allantoïde stocke les produits d’excrétion du rein.
VI L’organogenèse de l’œuf.
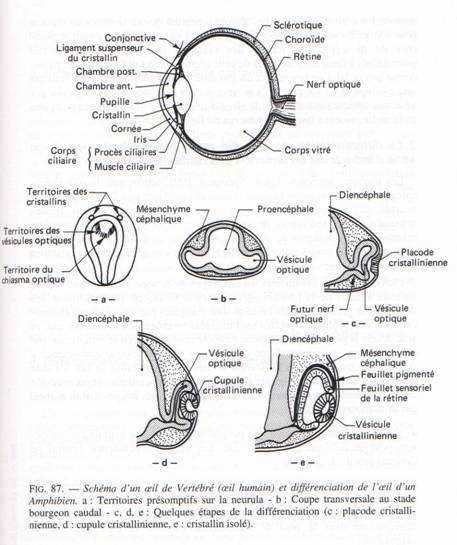
Vers 33 heures d’incubation, les parties latérales du diencéphale s’invaginent pour donner les vésicules optiques (au nombre de 2) grâce à l’effet inducteur de la plaque précordale. Ces vésicules optiques s’allongent et se pédiculisent pour donner le nerf optique. Elles se creusent en cupules optiques formées de deux feuillets. Un mince externe à la cupule constituant la rétine pigmentaire et le feuillet interne à la cupule qui constitue la rétine nerveuse (couches de cellules sensorielles). La cupule optique va induire un épaississement de l’ectoderme. La placode cristallinienne s’invagine pour donner le cristallin formé de deux parties : un épithélium mince et vers l’intérieure et des grandes fibres cristalliniennes. Cela permet la transformation de l’ectoderme en cornée transparente.
Chapitre 3 :
Le développement embryonnaire des mammifères.
I Protothériens ou Monotrèmes (mammifères inférieurs).
Exemple : l’ornithorynque.
Il y a des ovocytes riches en réserves, s’entourant d’albumen au niveau de l’oviducte puis d’une coque cornée contenant des nodules calcaires. Seule l’ovaire gauche est fonctionnel. L’œuf est pondu par la femelle dans un terrier.
Chez les échinides (ils ressemblent à des petits hérissons et sont proches des marsupiaux), il y a incubation des œufs dans une poche ventrale abdominale dans laquelle ils sont reçus au sortir du cloaque. Les deux ovaires sont fonctionnels et l’œuf pondu correspond à un embryon de poulet à 40 heures d’incubation.
On distingue trois périodes chez ces espèces :
- Une période intra-utérine (brève).
- Une période d’incubation.
- Une période qui suit l’éclosion et où commence la lactation.
II Les métathériens (les marsupiaux).
La gestation est de courte durée, l’embryon se développe dans l’utérus où il effectue son organogenèse. Il y a formation d’un placenta très rudimentaire. Quand le jeune est mis au monde, il gagne la poche marsupiale où il achèvera sa croissance.
III Les euthériens.
La gestation va atteindre son maximum de compétence. L’œuf est dépourvu de réserve (alécithes). Le développement va dépendre de substances nutritives apportées par la mère grâce à un organe d’origine fœto-maternelle qu’est le placenta.
IV Physiologie de la gestation.
L’œuf ne peut s’implanter dans la muqueuse utérine que si celle-ci est préalablement préparée par l’action synergique des œstrogènes puis de la progestérone.
L’ovariectomie précoce empêche la nidation. Or, quand la gestation est installée, on distingue deux types d’espèces :
- Espèce où l’ovaire est indispensable jusqu’au terme (exemple : le lapin, le hamster).
- Espèce où l’ovaire n’est plus nécessaire dans la deuxième partie de la grossesse (femme, cobaye, chien, chat) : le placenta prend le relais hormonal et sécrète une gonadotrophine agissant sur le corps jaune cyclique qui devient ainsi gestatif. La grossesse se résume par un équilibre entre œstrogènes et progestérone, sans oublier les interactions hypophyse, hypothalamus.
V L’ovoimplantation.
Les œufs alécithes (de 100 à 150 µm de diamètre).
Dans les douze heures qui suivent la ponte, l’ovocyte II doit être fécondé, sinon il dégénère. La première mitose a lieu vers la trentième heure. La segmentation est asynchrone. Au bout de quatre jours, on obtient un stade morula, formé de douze à seize cellules. Le transit tubaire est favorisé par un flux péritonéo-utérin en péristaltisme de l’oviducte et de l’action des cils.
La morula arrive dans l’utérus où elle atteint un stade blastocyste (vers le 6ème jour). Ce blastocyste est formé de deux parties :
· des cellules aplaties à la périphérie
· 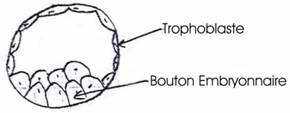 un amas cellulaire à l’un des pôles constituant le bouton embryonnaire.
un amas cellulaire à l’un des pôles constituant le bouton embryonnaire.
Le blastocyste peut demeurer libre dans la cavité utérine pendant un temps variable (jusqu’à six jours chez la femme).
VI Les différents types de nidation.
A L’implantation centrale.
Dans ce cas, la muqueuse utérine est peu transformée. Le blastocyste reste dans la lumière de l’utérus et s’y développe. Ses parois viennent alors s’accoler à celles de l’utérus. L’endomètre est peu transformé. C’est un phénomène que l’on observe chez les carnivores, les ruminants, les suidés et les chéiroptères.
B L’implantation excentrée.
Le blastocyste s’insinue entre les plis de la muqueuse utérine qui est fortement transforméeLe blastocyste détruit partiellement la muqueuse utérine, se refermant sur lui-même pour former une chambre close, sans communication avec la lumière utérine. Cette implantation a lieu chez le lapin, le rat et la souris. et qui ressemble à une véritable dentelle. La transformation de l’endomètre se fera grâce à des hormones.
C L’implantation interstitielle.
Le blastocyste pénètre dans l’épaisseur de l’endomètre et s’y développe. C’est le cas des primates, de l’homme. La grossesse ectopique (extra-utérine) est fréquente chez la femelle, dans la trompe, l’abdomen ou sur un ovaire.
VII La placentation.
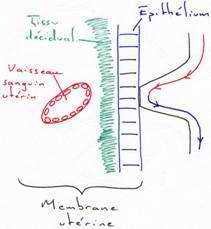
Le placenta s’édifie à partir du trophoblaste, du blastocyste et de la muqueuse utérine.
A Formation du côté fœtal.
La prolifération cellulaire se poursuit activement au niveau du trophoblaste. Au 7ème jour, chez la femme, le trophoblaste se différencie en un cytotrophoblaste cellulaire et à sa périphérie, on a un syncytiotrophoblaste qui, par son activité protéolytique, attaque l’épithélium, le tissu conjonctif et la paroi endothéliale des vaisseaux maternels. Cette nidation est complète au bout de douze à quatorze jours.
Le syncytiotrophoblaste constitue des chambres intervitellines pleines de sang maternel séparées par des évaginations du cytotrophoblaste (ou villosité crampon primaire) avec un axe mésodermique (villosité crampon secondaire), puis, par la présence de vaisseaux fœtaux (villosité crampon tertiaire).
B Formation du côté maternel.
Sous l’effet des hormones, l’endomètre utérin se modifie : c’est la réaction déciduale qui est plus ou moins importante selon les espèces. L’endomètre prend le nom de décidu ou de caduque qui joue un rôle protecteur contre les attaques immunologiques de la mère et contre l’activité érosive du syncytiotrophoblaste. La décidu peut se conserver intacte au moment de la mise bas ou parturition (accouchement chez la femme).
L’expulsion du placenta se fera sans hémorragie maternelle : on parle alors de placenta indécidué (sans caduque). La décidu est partiellement détruite par le syncytiotrophoblaste. Il y aura élimination de la décidu à la naissance : on parle de placenta décidué.
C Formation de l’allantoïde et évolution de la placentation.
Chez les oiseaux, l’allantoïde est une invagination de l’intestin postérieure doublée extérieurement de splanchnopleure très vascularisée. Elle se forme tardivement chez les oiseaux (vers 60 heures d’incubation), quand la moins grande partie des somites est en place. Chez les mammifères, sa formation est beaucoup plus précoce, avant même l’apparition des premiers somites, vers le 18ème jour chez la femme.
Il y a deux annexes :
· La vésicule vitelline est à l’origine d’un amphaloplacenta.
· L’allantoïde donne un allantoplacenta.
Ces deux annexes embryonnaires vont entrer en contact avec le chorion de l’embryon qui est formé de trophoblaste et de somatopleure.
L’évolution du placenta se fait par une réduction progressive de la vésicule vitelline et le développement de l’allantoïde, puis, chez les mammifères supérieurs (primates et hommes), elle se fait par une réduction d’allantoïde. A partir du troisième mois, chez la femme, la vésicule vitelline et l’allantoïde dégénère et à la naissance persistent deux artères et un ucine.
Chez les marsupiaux, le placenta est très rudimentaire et aussi bien constitué par la vésicule vitelline que par l’allantoïde. Chez les péramèles (marsupiaux), il y a une volumineuse vésicule vitelline et un allantoïde qui vient s’appliquer contre le chorion. Il se forme ainsi un alloplacenta sans villosité. Le fœtus dépend de la sécrétion vitelline (une sorte de lait utérin) pour son développement. Il y a une vascularisation de la vésicule vitelline (chez les marsupiaux). La circulation allantoïdienne apporte au fœtus des substances nutritives.
Chez les carnivores, la vésicule vitelline est nettement réduite mais persiste durant la gestation, avec sa vascularisation, mais elle n’atteint pas le chorion. L’allantoïde s’étale sur toute la face intérieure et entoure la cavité amniotique : on a alors un placenta dit allantoïdien. Les villosités se localisent dans une zone, d’où le nom de placenta zonaire.
Chez les ruminants, l’allantoïde est extrêmement développé ainsi que l’amnios. Chaque fois que l’allantoïde régresse, les vaisseaux allantoïdiens s’étendent dans la membrane chorio-amniotique, le placenta restant allantoïdien.
1 Les différents types d’alloplacenta.
Les alloplacentas sont classés en deux catégories :
· selon la typographie des villosités choriales,
· selon leur relation avec l’endomètre utérin.
2 le placenta épithéliochorial :
L’épithélium de l’endomètre vient en contact avec les villosités choriales. On en distingue deux types :
· le placenta diffus. Dans ce cas, les villosités choriales sont réparties de façon uniforme, elles s’enfoncent dans les glandes de l’endomètre remplies d’embryotrophe (produit de sécrétion absorbé par les villosités choriales). C’est le plus primitif. Il est observé chez les marsupiaux.
· le placenta indécidué. On le trouve chez les cétacés, les chevaux, les porcs.
3 Le placenta cotylédonaire.
Dans ce cas, les villosités choriales s’enferment dans un épaississement de l’endomètre en caroncule. L’ensemble des villosités choriales et de la caroncule constitue le cotylédon.
4 Le placenta endothéliochorial.
Le syncytiotrophoblaste vient en contact avec l’endothélium des vaisseaux de la mère (chez les carnivores). Le placenta est zonaire et décidué.
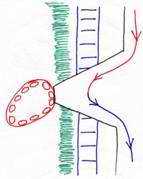
5 Le placenta hémochorial.
Les villosités choriales érodent l’épithélium des vaisseaux de la mère, provoquant une hémorragie. Il y a formation de lacunes de sang maternel (comme chez la femme). C’est une placentation discoïdale).
D Le rôle physiologique des placentas.
La surface des villosités est de l’ordre de 14 m². Les échanges se font par
Diffusion simple (pour l’O2, le CO2, l’eau, le Na+, le K+, les chlorures et les bicarbonates).
Diffusion facilitée : les molécules sont transportées d’un pôle de la cellule à l’autre (ex : les sucres, les sels, les acides aminés …).
Transport actif : il est nécessaire pour les molécules plus complexes.
La phagocytose et la pinocytose.
Les substances transportées par le sang maternel passent dans le sang fœtal (les gaz, l’eau, les électrolytes, les glucides, lipides, protides, vitamines, hormones et anticorps).
Chez l’homme, l’immunité passive est transmise in utero. Beaucoup de médicaments traversent, ainsi que pratiquement tous les antibiotiques. Ces substances peuvent être accompagnées, dans leur traversée, par des agents infectieux et par des virus.
E La fonction endocrine du placenta.
Le placenta sécrète une HCG : Hormone Gonadotrophine Chorionique. Elle est produite par le syncytiotrophoblaste, éliminé dans l’urine de la femme enceinte. L’injection à des lapins impubères provoque le maintien du corps jaune (de cyclique, il devient gestatif).
L’HLP est l’Hormone Lactogène Placentaire. Elle provoque la sécrétion lactée chez les lapines,… Elle est analogue à la prolactine. Elle n’a pas un rôle lactogène mais participe avec les stéroïdes sexuels dans la préparation de la glande mammaire à la lactation. Cette hormone contrôle la mobilisation des lipides maternels.
L’œstrogène et la progestérone agissent sur l’utérus : il y a stimulation de la croissance et du métabolisme. Elles agissent sur le fonctionnement des systèmes enzymatiques placentaires. Dans les deux premiers mois, la progestérone vient du corps jaune, puis, du placenta. Son effet majeur est l’inhibition du muscle utérin.
Chapitre 4 :
Phénomènes morphogénétiques de la régulation.
Au cours du développement d’un œuf totipotent, on assiste à une détermination progressive de divers ensembles cellulaires qui aboutissent par pertes successives de potentialité à la différenciation cellulaire terminale. Cette détermination, se faisant par interactions cellulaires, est régulée au cours des différentes étapes du développement. Cette régulation permet, en contrepartie, une grande flexibilité, les cellules n’étant pas d’emblée prédéterminées.
I Capacités de régulation chez les amphibiens.
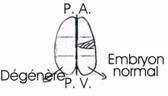
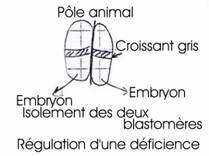
Expériences réalisées par Spemann et >Mangold en 1927.
Dès que les territoires présomptifs commencent à se déterminer, les phénomènes de régulation intéressent des ensembles cellulaires de plus en plus réduits appelés champs morphogénétiques.
A Expérience fondamentale de Spemann.
Cette expérience consiste à réaliser la greffe de la lèvre dorsale du blastopore d’une jeune gastrula à partir de deux germes différemment pigmentés ; à partir d’un œuf de triton crêté (œufs clairs) et d’un œuf de triton vulgaire (œufs sombres).
Ce marquage est nécessaire pour retrouver dans le germe hôte : les tissus provenant du greffon.
On prélève la lèvre dorsale du blastopore d’une jeune gastrula de triton crêté et on la greffe sur la face ventrale d’une autre jeune gastrula, au même stade, de triton vulgaire, à la place d’un volet d’ectoblaste de même dimension et préalablement excisé, le greffon est alors implanté en position inversée (les deux concavités se faisant face de part et d’autre du pôle végétatif). Ceci est nécessaire pour que l’invagination au niveau du greffon conduise à un résultat à long terme.
L’enroulement de la gastrulation se fait dans le même sens que les mouvements d’épibolieneurulation, apparaît une plaque neurale secondaire. Ces deux plaques évoluent pour leur propre compte et constituent chacune un tube nerveux. Ainsi, un embryon, primaire, se forme et ventralement, un deuxième embryon, légèrement plus petit que le primaire, se développe normalement constitué. de l’ectoblaste du porte-greffe. La gastrulation du germe hôte se poursuit normalement de son côté. Au moment de la
B Analyse des résultats.
Le greffon s’est invaginé autour de la lèvre blastoporale et ses cellules ont formé la chorde antérieure et une partie des somites de l’embryon secondaire. Ce greffon s’est développé dans sa nouvelle situation conformément à sa destinée. Ce greffon est capable de s’auto-différencier : il était déterminé au moment où on l’a prélevé. Il ne s’est pas transformé en épiderme dans sa nouvelle position. Par contre, les deux territoires présomptifs de l’ectoblaste, au début de la gastrulation, étaient encore indéterminés.
Les deux territoires, épiblaste et neurectoblaste, sont indéterminés au moment de leur prélèvement. L’épiblaste présomptif est compétent pour recevoir l’induction neurogène. Les différents territoires d’un même stade embryonnaire n’ont pas le même degré de détermination (lèvre dorsale, neuroblaste et épiblaste présomptifs).
· Au contact des tissus invaginés du greffon, l’épiblaste ventral présomptif du porte-greffe s’est transformé en neuroblaste et a fourni la totalité du système nerveux de l’embryon secondaire, au lieu de se différencier en épiderme. Le greffon a donc exercé une action inductrice sur l’ectoblaste ventral du porte-greffe. Le système nerveux secondaire est le résultat d’une induction neurogène exercée par le greffon sur l’ectoblaste encore indéterminé du porte-greffe. Les cellules nerveuses proviennent par conséquent du porte-greffe et non du greffon. Cela signifie que l’ectoblaste ventral est compétent pour recevoir l’induction neurogène.
· Le greffon a exercé d’autres effets inducteurs sur les feuillets du porte-greffe. Le mésoblaste latéral du porte-greffe aurait du fournir les dérivés de la splanchnopleure et de la somatopleure. Sous l’influence du greffon, il a fourni la chorde du tronc et de la queue et une partie des somites ainsi que le pronéphros. Le greffon a donc transformé les potentialités du mésoblaste latéral en exerçant sur celui-ci une induction mésoblastogène ou mésodermatisante. Le mésoblaste latéral présomptif se transforme en mésoblaste cordal et somatique.
Conclusion :
L’embryon induit n’est pas formé de tissus déposés de façon anarchique. C’est un organisme (centre organisateur) donné à la lèvre dorsale du blastopore. Ce centre organisateur occupe le centre du croissant gris sur l’œuf de grenouille asegmenté au début de la gastrulation puis les territoires présomptifs de la plaque précordale, corde, somites antérieures et endoblaste pharyngien.
II Les oiseaux.

La blastula secondaire de Cane donne >Lutz. III Les mammifères.
Le cas des jumeaux homozygotes (cf. p 5 sur les mammifères).
· Tarkovski (1961) : au stade de deux blastomères, il les a séparés et a obtenu une souris normale è régulation de la déficience.
· Mintz (1962) : fusion de deux morulas de souris de couleur différente : on obtient un blastocyste géant, implantable dans l’utérus. On aura alors une souris normale chimère. Elle aura quatre parents, les génomes de ses parents s’exprimant en même temps. Il y a toutefois régulation d’un excédent.
·Hillman (1972) : il a utilisé une morula de souris marquée à la thymidinen tritiée. Il dissocia les cellules de cette morula, qu’il incorpore à l’intérieure d’une morula receveuse. Les cellules forment les boutons embryonnaires lorsqu’elles sont injectées à la surface d’une morula : formation du trophoblaste. Les cellules sont encore totipotentes : il y a eu un effet de position, des signaux extrinsèques vont modifier leur destinée par des interactions cellulaires et des facteurs vont ainsi se transmettre et définir un patron de détermination. Ces capacités de régulation contrastent avec les embryons mosaïques.
IV Les embryons mosaïques.
A Le développement de l’œuf d’une ascidie.
Ces ascidies sont des animaux marins (groupe le plus important des urocordés à corde dorsale dans la queue).
L’apparition de la corde en position dorsale est fondamentale car cet axe longitudinal de soutien marque l’avènement du système nerveux en position dorsale (invertébrés à ventral).
Les larves ont l’aspect d’un têtard avec la corde uniquement au niveau de la queue. Au cours de la métamorphose, elles perdent la queue et donc la corde ; l’adulte se fixe à un substrat. Le corps de cet adulte est recouvert d’une tunique, d’où le nom de tunicier.
L’ovocyte primaire possède une couche périphérique pigmentée en jaune, un cytoplasme gris ardoisé comprenant des plaquettes vitellines et un cytoplasme hyalin autour du noyau.
La fécondation entraîne des remaniements cytoplasmiques : apparition des trois régions.
- cytoplasme hyalin (équatorial),
- cytoplasme gris (PA),
- cytoplasme jaune (PV).
Le spermatozoïde, en pénétrant par le PV, et en remontant vers le centre de l’œuf, va provoquer de nouveaux déplacements cytoplasmiques. La fusion des deux pronucléus a lieu à mi-chemin entre le centre de l’œuf et le PV. Ces déplacements aboutissent à la formation de six territoires visibles disposés dans un ordre précis par rapport à l’axe de l’œuf. C’est une disposition qui préfigure le plan de symétrie bilatérale de la larve.
On peut distinguer, dans l’hémisphère animal, une large calotte de cytoplasme hyalin clairectoplasme qui donnera l’ectoderme. Du futur côté antérieur de l’embryon, un croissant gris clair granuleux, dont une partie, située à l’équateur et l’autre au-dessous, constituent le neuroplasme et le cordoplasme qui donneront le système nerveux et la corde. Du côté opposé, se trouve un croissant jaune, lui-même formé d’un croissant jaune foncé constituant le mésoplasme caudal, qui donnera le mésoderme caudal. En dessous, un croissant jaune clair formera le mésoplasme thoracique et donnera le mésoderme thoracique. Au PV, un cytoplasme gris ardoisé constituera l’endoplasme et donnera l’endoderme. On a alors six territoires cytoplasmiques déterminés. ou
Chacune de ces régions constitue un marqueur naturel des cellules dont on peut suivre la destinée. Ces régions traduisent l'anisotropie du cytoplasme et peuvent être considérées comme des plasmes organogènes dont la destinée est rigoureusement déterminée.
Le premier plan de segmentation est méridien et coïncide avec le plan de symétrie bilatérale. Au stade deux blastomères, chacun des blastomères contient les six territoires. Le deuxième plan de segmentation est méridien, perpendiculaire au premier et va séparer les deux blastomères postérieurs renfermant le croissant jaune et les deux blastomères antérieurs renfermant le croissant gris. Le troisième plan de segmentation est subéquatorial et donne huit blastomères :
- 4 blastocystes animaux contenant l’ectoplasme qui donnera l’ectoderme,
- 4 blastocystes végétatifs, dont les deux postérieurs contenant le croissant jaune, le mésoplasme caudal et thoracique donnant les mésodermes respectifs. Les deux antérieurs contiennent le croissant gris, le neuroplasme et le cordoplasme.
Grâce à ces marqueurs colorés, on peut faire une analyse expérimentale.
B Analyses expérimentales.
Chatry (1887) et Cowklin (1905).
C’est une étude de la conséquence de la destruction sélective des blastomères ou de l’isolement de certains d’entre eux.
Si on sépare les deux premiers blastomères, situés de part et d’autre du plan de symétrie bilatérale ou si l’on détruit l’un d’eux, on obtient le développement d’un hémi-embryon gauche ou droit.
Si, au stade 4 blastomères, on détruit les deux blastomères postérieurs (ou si on les sépare), on obtient un hémi-embryon antérieure avec une structure dorsale (ectoderme, plaque neurale avec organes sensoriels) mais on n’a pas de structure ventrale (musculature ou endoderme). Ultérieurement, à 32 blastomères, la destruction de chacun des blastomères est suivie de l’absence des organes correspondants (corde, mésoderme et système nerveux).
Conclusion :
Chaque territoire cytoplasmique est un plasma organogène. Isolé, il ne peut s’auto-différencier ; détruit, il ne peut être remplacé.
Chapitre 5 :
Le développement de la drosophile.
I La Drosophile melanogaster (la mouche du vinaigre).
Elle a été rendue célèbre avec l’avènement de la génétique classique au début du siècle et depuis 1980 par la biologie moléculaire. Grâce à cette mouche, on peut étudier le déterminisme moléculaire du développement.
La drosophile est une espèce qui présente de très nombreuses mutations spontanées qui affecte les caractéristiques morphologiques et physiologiques.
On peut provoquer des mutations par des agents chimiques ou ionisants. Les mutations peuvent affecter les mécanismes de l’orogenèse, du développement embryonnaire (larvaire ou pendant la métamorphose). Certains gènes séquencés chez la drosophile ont des équivalents dans les vertébrés supérieurs. Ils ont permis d’aborder l’étude du déterminisme moléculaire du développement chez les vertébrés supérieurs (entre autre, l’homme).
Le développement de la drosophile est très rapide : en 9 jours, on obtient un adulte. On voit donc rapidement de la mutation.
II Le cycle de vie de la drosophile.
A L’œuf centroleucyte (le vitellus est au centre de l’œuf).
La segmentation est dite superficielle. En effet, des noyaux se divisent au centre puis migrent vers l’extérieur et vont y former le blastomère. A 22°C, on a un développement très rapide.
Le développement embryonnaire dure 24 heures. La segmentation gastru-neuralation donne une larve de premier stade qui mue au bout de 24 heures et donne alors une larve de second stade qui va muer une nouvelle fois pour donner une larve de troisième stade. Pendant les trois stades larvaires, les organes mis en place pendant le développement embryonnaire vont croître. On assiste cependant à l’apparition d’une série d’ébauches indifférenciées : les disques imaginaux (è ils formeront souvent de l’adulte).
Après 48 heures, la larve commence à se métamorphoser. Elle conserve son tégument externe qui constitue le puparium (épaissi). C’est le stade de la pupaison. La dernière mue donne naissance à la pupe immobile ou l’on reconnaît les contours du corps et les appendices de la future mouche.
Le processus de la métamorphose est induit par des hormones stéroïdes (ce sont toutes des hormones de mue). Ce processus dure quatre jours. La larve sera en parti détruite par histolyse. Les images seront reconstituées par les disques imaginaux.
A l’issu de ces quatre jours, on se débarrasse du puparium. On a ensuite la ponte.
B L’orogenèse.
Les ovaires sont constitués de plusieurs tubes ou ovarioles qui contiennent les chambres contenant les œufs (chambres ovariennes). Ces chambres sont composées de seize cellules issues de la lignée germinale (cellules polaires).
On a quinze cellules nourricières et un oocyste. La chambre ovarienne est entourée par une couche de cellules folliculaires. Des ponts cytoplasmiques provenant d’une cytodiérèse incomplète permettent l’accumulation, dans l’oocyste, des métabolites nécessaires aux premiers stades de développement Des ponts cytoplasmiques provenant d’une cytodiérèse incomplète permettent l’accumulation, dans l’oocyste, des métabolites nécessaires aux premiers stades de développement, mais également à la répartition d’ARNm et de protéines qui sont des déterminants maternels.
Les cellules folliculaires produisent des composants du cytoplasme qui déterminent l’axe dorso-ventral. Les deux axes sont donc définis pendant l’orogenèse par des déterminants maternels.
Autour de l’orogenèse, les cellules sont agencées en palissade et forment ainsi la membrane vitelline et un chorion cireux et imperméable.
Les cellules nourricières et folliculaires sont responsables de la mise en place des axes embryonnaires par répartition polarisée des déterminants moléculaires maternels.
C Le développement embryonnaire.
La segmentation : les cycles cellulaires sont très brefs.
Après la fécondation qui est intérieure (dans la spermathèque), le développement commence par une série de huit divisions nucléaires synchrones qui se succèdent de huit à dix minutes sans formation de cellules individualisées. Ces noyaux constituent des énergides. Les 256 noyaux (ou énergides) formés vont migrer vers la périphérie de l’ooplaste (cytoplasme de l’oocyte) pour former le blastoderme syncytial (tissu plurinucléé).
A la neuvième division de la segmentation, des plasmes polaires vont s’individualiser en région postérieure (région de cytoplasme). Cinq ou 6 noyaux vont migrer puis pénétrer dans les plasmes et se viser pour donner une trentaine de cellules : les cellules polaires qui seront à l’origine du germanium. Après les quatre divisions synchrones syncytiales, on a treize divisions. Celles-ci permettent la formation des membranes cellulaires qui se forment de la périphérie vers le centre : c’est la cellularisation complète (d’une durée d’à peu près deux heures et demi). Le blastoderme est dit cellularisé.
Durant la transition entre 2 blastodermes, les gènes zygotiques commencent à s’exprimer, prenant le relais des déterminants maternels.
D La gastrulation.
Le long de la ligne médiane ventrale, une bande de cellules s’invagine et forme le sillon ventral, puis un cordon ventral qui donnera le mésoderme accolé au futur ectoderme.
Ces deux formations constituent la bandelette germinatique, mise en place en vingt minutes.
Cette bandelette s’étend sur les deux tiers de la longueur de l’embryon et a pour limite antérieure, le sillon céphalique oblique qui se forme de façon superficielle et transitoire au même moment, donc, dès le début de la gastrulation.
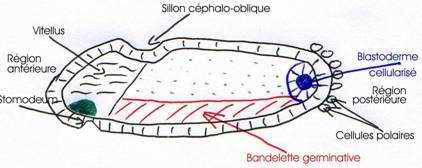
L’ensemble ectoderme plus mésoderme forme la bandelette germinative.
On a ensuite deux épaississements du blastoderme qui constitue les ébauches endodermiques de l’intestin moyen antérieur et postérieur qui seront repoussés à l’intérieur de la formation par deux évaginations d’origine ectodermique.
On a une évagination à l’avant du système céphalique : le stomodeum qui donnera la bouche (œsophage) et le proctodeum qui donnera l’anus et l’intestin postérieur.
Les mouvements morphogénétiques de la gastrulation vont amener la bandelette germinative à s’enrouler autour de l’extrémité postérieure par un mouvement postérodorsal : une extension de cette bandelette qui est optimale en six heures.
Quand l’extrémité atteint le sillon céphalo-oblique, ce mouvement entraîne l’invagination du proctodeum qui se développe à l’intérieur des cellules polaires et du geme.
Entre 4 et 7 heures, de grosses cellules migrent, à partir de l’ectoderme, de part et d’autre du sillon médian : ce sont les neuroblastes.
Ces neuroblastes vont donner naissance à deux cordons nerveux entre l’ectoderme et l’endoderme selon un patron répétitif qui rappel les métamères de l’embryon.
Les sillons segmentés caractérisants la métamérisation apparaissent vers la 7ème heure sur la face ventrale, au moment ou le sillon céphalique disparaît.
On distingue 3 segments pour la tête, 3 pour le thorax et 8 pour l’abdomen. Entre 9 et 10 heures, on assiste à un retour en arrière de la bandelette germinative (rétraction de cette bandelette) qui place l’orifice du proctodeum à sa position définitive (anus) et les segments postérieurs se trouvent alors dans l’alignement axial du corps.
Le système nerveux subit ce phénomène de rétraction et lorsqu’il est dans sa position ventrale, une mince couche de cellules amnio-séreuses va recouvrir le vitellus exposé dorsalement après la rétraction de la bandelette germinative. On a ensuite la fermeture dorsale de l’embryon.
Le mésoderme se métamérise et se régionalise et donne alors, le mésoderme somatique (qui est à l’origine des muscles larvaires) et le mésoderme viscéral (qui est lui, à l’origine du tube digestif).
Les deux ébauches endodermiques de l’intestin moyen antérieur et postérieur se rejoignent vers la douzième heure. Les ébauches de la chaîne nerveuse ventrale vont se développer de plus en plus à l’avant avec les corps cérébroïdes. La chitine apparaît vers la treizième heure et les premiers mouvements musculaires vers la quatorzième.
E Les disques imaginaux.
L’ectoderme va former une sorte de sac aplati constitué d’une seule couche de cellules accrochées intérieurement à l’ectoderme de la larve sous l’influence de l’ecdysone (hormone de mue). Au moment de la métamorphose, ces disques imaginaux s’évaginent (se retournent comme des doigts de gants) pour prendre leur aspect apindiculaire définitif.
On distingue 19 disques dont :
- 3 paires pour la tête,
- 3 paires thoraciques-dorsales qui donnent les pro, méso, méta thorax avec les appendices correspondant (paire d’ailes et d’élytres),
- 3 paires thoraciques-ventrales qui donneront les trois paires de pattes,
- 1 disque génital impair.
TP 1 :
Le développement de l'oursin
L’œuf d’Oursin est oligolécithe. Chez Paracentrotus lividus, la pigmentation corticale uniforme se rassemble après la fécondation en une ceinture pigmentée, dans l’hémisphère végétatif. Les deux globules polaires ont été émis avant la fécondation.
SEGMENTATION
(fig. 28)
La segmentation est totale radiaire et sub-égale, les différences de taille entre les blastomères n’étant jamais importantes. Les deux premiers plans sont méridiens, perpendiculaires et séparent quatre blastomères égaux. Le troisième plan équatorial sépare quatre blastomères animaux et quatre blastomères végétatifs contenant la ceinture pigmentée.
Au stade 16 cellules, les quatre blastomères animaux donnent 8 blastomères organisés suivant un plan radiaire (mésomères), tandis que les blastomères végétatifs se divisent suivant un plan sous-équatorial en 4 cellules contenant le matériel pigmentaire, les macromères, et 4 cellules plus petites au pôle végétatif, les micromères. Au cours des deux cycles de division ultérieurs les plans de segmentation vont diviser l’œuf de sorte qu’il comprendra cinq assises de blastomères. Les 8 blastomères animaux se divisent d’abord suivant un plan latitudinal, puis suivant un plan méridien, et forment deux couches de 16 blastomères (an. 1, an. 2). Les 4 macromères se divisent successivement suivant un plan méridien, puis latitudinal et forment deux couches de huit blastomères (vég. 1, vég. 2). Après 2 cycles de division, les 16 micromères formés restent au pôle végétatif en une seule assise. Les différences de taille s’estompent progressivement. A la fin de la segmentation, la blastula est creusée d’une cavité, le blastocœle, qui est apparu dès le stade 8. Les cellules embryonnaires s’organisent en une seule couche autour de cette cavité. Elles sont ciliées, avec une touffe apicale. La larve est nageuse au bout de 24 heures.
GASTRULATION
(fig. 28)
En l’absence de réserves vitellines notables au pôle végétatif, la gastrulation se fait par embolie. La destinée de chaque catégorie de cellules de la morula est connue (voir p. 170).
Dans un premier temps, les cellules dérivées des micromères, formant le mésenchyme primaire, migrent isolément dans la cavité du blastocœle. C’est la blastula avec mésenchyme. Ces cellules sécrètent les spicules calcaires de la larve Plutéus.
Les territoires de l’endoderme et du mésoderme s’invaginent ensuite et forment l‘archentéron qui s’ouvre par le blastopore. La limite d’invagination se situe entre les dérivés de la première et de la seconde rangée de macromères végétatifs. Tout l’hémisphère animal et la première rangée de macromères végétatifs forment l’ectoderme.
Tandis que la larve s’aplatit suivant la future région ventrale et acquiert une symétrie bilatérale, le fond de l’archentéron prolifère et les cellules qui en résultent, ou, mésenchyme secondaire, édifient le mésoderme cœlomique organisé en vésicules qui suivront une évolution complexe. Lorsque cette séparation est achevée, l’extrémité de l’archentéron rencontre sur la face ventrale une dépression ectodermique où s’ouvrira la bouche, le blastopore devenant l’anus. La mise en place des trois feuillets, ectoderme, mésoderme et endoderme est alors achevée. La larve s’étire, avec une face anale aplatie, une face orale dont la concavité s’accentue, cette face orale étant encadrée de quatre bras soutenus par les spicules calcaires. La larve Plutéus est ainsi formée au bout de 3 jours (fig. 28). Elle acquiert une symétrie bilatérale (fig. 28) à laquelle se substituera une symétrie radiaire d’ordre 5 au moment de la métamorphose.
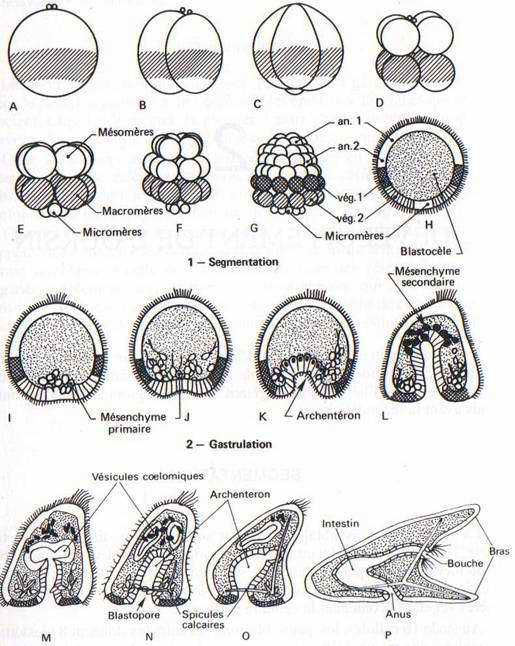
FiG. 28. -- Développement de l’oursin. A : Oeuf fécondé. B. C, D : Premières segmentations (2-4-8 blastomères). E, F, G : Morula (16, 32, 64 blastomères). H : Coupe d’une blastula. I : Immigration des micromères qui forment le mésenchyme (mésoderme) primaire. J, K : Invagination de l’endoderme, formation de l’archentéron. L : Prolifération d’un mésenchyme secondaire à partir du fond de l’archentéron. M. N : Formation des vésicules cœlomiques. O, P : Formation d’une larve Plutéus : acquisition d’une symétrie bilatérale, ouverture d’une bouche et développement des bras.
TP 2 :
Le développement de la drosophile
Cette étude sommaire portera sur la segmentation et la gastrulation de l’embryon de drosophile (fig. 29, 30).
Segmentation et formation du blastoderme
(fig. 29)
La segmentation de l’œuf d’Insecte, centrolécithe, est une segmentation superficielle.
A la fin de la vitellogenèse, l’ovocyte est entouré de la membrane vitelline, très fine, et d’une seconde enveloppe plus externe et plus dure, le chorion, sécrétée par les cellules folliculeuses et pourvue d’une ouverture apicale ou micropyle, par où pénètrent les spermatozoïdes contenus dans la spermathèque1, lorsque l’ovocyte passe devant l’ouverture de celle-ci au moment de la ponte.
Après l’amphimixie, le noyau de fécondation situé dans la masse vitelline se divise rapidement, l’embryon comprend 128 énergides, (c’est-à-dire noyau environné d’un domaine cytoplasmique. sans membrane limitante), 72 minutes après la ponte. Après un cycle de divisions supplémentaires (256 énergides), celles-ci gagnent la périphérie de l’œuf où les noyaux continuent à se multiplier, mais plus lentement. Il se forme un blastoderme syncytial. Lorsqu’il y a 512 noyaux, les cellules polaires sont individualisées. Elles sont à l’origine des cellules germinales initiales. Les membranes plasmiques isolant les cellules du blastoderme se forment par invagination de la membrane de l’œuf ; chaque noyau entouré de son domaine cytoplasmique est isolé et, 3 heures plus tard, un blastoderme cellulaire, comprenant environ 6 000 cellules, est formé autour d’une masse centrale de vitellus contenant quelques noyaux vitellins, polyploïdes. Treize cycles cellulaires se sont succédé depuis la fécondation.
Dans le blastoderme syncytial, des différences apparaissent déjà parmi les noyaux quant à la durée de leurs cycles mitotiques et ceux-ci deviennent asynchrones tandis que la transcription d’ARNm augmente. Cette augmentation s’accélère après le 14ème cycle cellulaire. C’est alors que, les cellules devenant mobiles, la gastrulation commence.
1. L’appareil génital femelle des Insectes comporte une poche, la spermathèque (fig. 19), où sont conservés les spermatozoïdes après la fécondation, pendant des durées qui peuvent être assez longues.
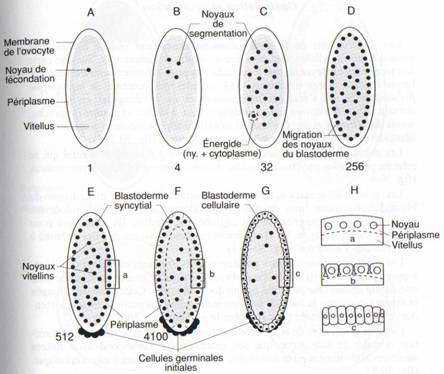
Fig. 29 : Schémas de la segmentation de l’œuf de drosophile et formation du blastoderme. a : oeuf fécondé. b, c, d, e : multiplication des noyaux au sein d’un blastoderme syncytial (le nombre de noyaux est indiqué sous chaque figure). e, f : les noyaux du blastoderme se mettent en place à la périphérie, dans le périplasme ; des noyaux vitellins restent dans l’aire vitelline. f, g : le blastoderme syncytial devient un blastoderme cellulaire. Les cellules initiales germinales sont individualisées au stade 512 noyaux. h : 3 phases de la formation des membranes cellulaires par invagination de la membrane plasmique de l’œuf.
Gastrulation et neurulation
(fig. 30)
Les mouvements de la gastrulation ne concernent que le blastoderme ventral dont les cellules sont plus hautes et plus volumineuses. Sur une carte des territoires embryonnaires, à ce stade, on peut délimiter ventralement une bande médiane large d’environ 1000 cellules qui constitue le mésoderme présomptif et, en s’écartant latéralement et en se dirigeant en direction dorsale, deux territoires ectodermiques, l’un à droite et l’autre à gauche, suivis de l’amnios et de la séreuse. Les extrémités antérieure et postérieure du blastoderme sont formées d’endoderme présomptif .(fig. 30-1, 2)
Les cellules mésodermiques s’invaginent le long d’un sillon ventral qui se referme pour isoler une ébauche aplatie de mésoderme sous l’ectoderme ventral. (fig. 30-6)
Une double invagination, à l’avant et à l’arrière du sillon d’invagination du blastoderme ventral, met en place l’endoderme antérieur et l’endoderme postérieur qui se rejoignent et qui englobent le vitellus. Ils fusionnent pour former l’intestin moyen. Ce mouvement entraîne aussi les cellules polaires à l’intérieur de l’embryon. (fig. 30-5, 7)
Les replis séro-amniotiques postérieurs, puis antérieurs et latéraux se développent pour recouvrir l’ébauche embryonnaire qui se trouve ainsi isolée dans une cavité amniotique protégée par un double feuillet. Cette ébauche allongée et épaisse constitue la bandelette germinative dont les parois latérales s’étendent en direction dorsale pour englober le vitellus. (fig. 30-8, 10)
La partie postérieure de la bandelette germinative croît et se retrousse en direction dorsale, de telle façon que son extrémité qui correspond à de futures structures abdominales, se trouve repliée au-dessus de la future région céphalique. (fig. 30-9)
La chaîne nerveuse se différencie dans le feuillet ectodermique, sous la forme de deux bandes de cellules qui se condenseront pour former une paire de ganglions par segment ; les ganglions de la région céphalique fusionnent ensuite en ganglions cérébroïdes. (fig. 30-11)
L’embryon se contracte dans le sens antéro-postérieur, et le repli en position dorsale de la partie abdominale disparaît. La division du corps en segments ou métamères devient visible. Sur une larve de 10 heures, on distingue 6 segments céphaliques, 3 segments thoraciques, 9 segments abdominaux (le nombre primitif de 13 abdominaux a été réduit ou modifié chez la drosophile). Les régions apicales de l’animal, l’acron en avant du premier métamère et le telson en arrière du dernier ne sont pas des métamères.
On verra plus loin que les mécanismes de régulation génétique qui déterminent la nature céphalique, thoracique ou abdominale d’un métamère chez un Insecte présentent de remarquables similitudes avec ceux qui contrôlent la différenciation des métamères suivant l’axe antéro-postérieur de tous les animaux métamérisés et notamment les Vertébrés.
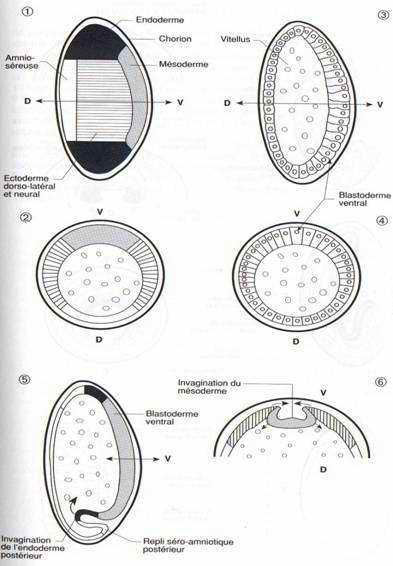
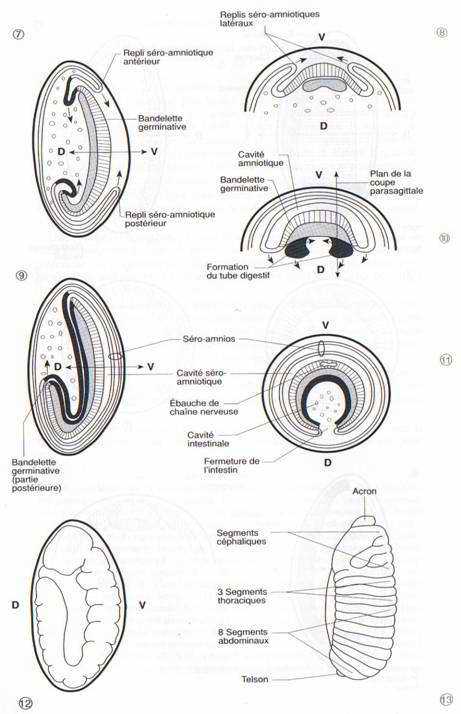
FiG. 30. — Gastrulation et neurulation de l’embryon de drosophile. 1,2 : Carte simplifiée des territoires présomptifs de la blastula, 1 : vue latérale externe, 2 : coupe transversale. 3,4 : Coupes sagittale et transversale d’une blastula. Le blastoderme ventral est épaissi. 5 : Coupe sagittale au début de la gastrulation : invagination de l’endoderme postérieur et début d’extension du repli séro-amniotique postérieur. 6 : Détail du même stade, coupe tranversaleséro-amniotique antérieur et de l’ébauche d’intestin antérieur. 8 : Coupe transversale de la région ventrale de 7: mésoderme invaginé, formation des replis séro-amniotiques latéraux. 9 : Coupe parasagittale après fermeture de la cavité amniotique ; retroussement en position dorsale de la bandelette germinative postérieure. 10 : Coupe transversale de la région ventrale de 9. Deux bandelettes d’endoderme se développent pour englober le vitellus, la cavité séro-amniotique se développe dorsalement. 11 : Coupe transversale d’embryon après formation de l’ébauche de chaîne nerveuse dans l’ectoderme, fermeture dorsale de l’intestin pratiquement achevée et développement dorsal maximum de la cavité séro-amniotique. 12: Vue externe d’un embryon de 5 heures. 13 : Vue externe d’un embryon de 10 heures, après rétraction du retroussement de la partie postérieure. du blastoderme ventral : migration de la bandelette mésodermique. 7 : Formation du repli
TP 3 :
DÉVELOPPEMENT DES AMPHIBIENS.
STRUCTURE DE L’OEUF D’AMPHlBlEN
(fig. 31)
Le chapitre traitant de l’ovogenèse a exposé les mécanismes de la formation de cet oeuf hétérolécithe. Cette structure conditionne les modalités de segmentation.
Oeuf vierge
L’œuf vierge d’Amphibien Anoure ou Urodèle est une cellule arrondie de deux millimètres de diamètre. Il possède un axe de symétrie qui passe par le pôle animal sous lequel se trouve le noyau en métaphase de seconde division de méiose, au sommet de l’hémisphère animal, et par le pôle végétatif, à l’opposé, au sommet de l’hémisphère végétatif.
On distingue une couche de cytoplasme cortical superficiel et un cytoplasme interne.
Sous le plasmalemme (membrane plasmique) de l’œuf non fécondé, le cytoplasme cortical ne contient pas de plaquettes vitellines. Il est plus visqueux que le cytoplasme interne avec un cytosquelette constitué d’un réseau de microfilaments d’actine enserrant dans ses mailles des granules corticaux superficiels et des pigments (mélanine) en profondeur. Les granules corticaux sont d’origine golgienne ; ils sont absents chez les Amphibiens Urodèles. Les pigments sont répartis suivant une intensité qui diminue souvent chez certaines espèces, dans l’hémisphère végétatif. Ils sont également absents au voisinage du pôle animal de l’œuf vierge où le noyau est voisin de la membrane cellulaire : c’est la tache de maturation, emplacement où les globules polaires sont expulsés à la suite de la méiose, au cours de la maturation et de la fécondation.
Le cytoplasme interne est hétérogène. C’est le résultat d’une répartition inégale des produits de synthèses élaborés pendant l’ovogenèse. Schématiquement, des ARN stables se répartissent suivant un gradient décroissant du pôle animal au pôle végétatif. A l’inverse, des réserves lipidiques, protéiques et glucidiques formant notamment des plaquettes vitellines suivent un gradient de taille croissante du pôle animal au pôle végétatif et de la périphérie de l’œuf vers le centre, de sorte que le hyaloplasme est peu abondant dans l’hémisphère végétatif. L’analyse globale montre que l’œuf d’Amphibien contient 52,5% d’eau, 34,5% de protéines, 7,5% de graisses, 3 %de glucides, 2%de substances diverses.
1. Cet embranchement contient aussi des espèces vivipares et des espèces à oeufs télolécithes.
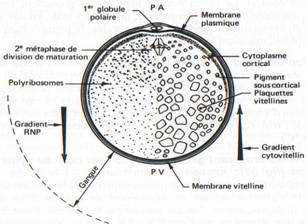
FIG. 31. — Schéma d’un oeuf vierge de grenouille mettant en évidence le pigment cortical présent surtout dans l’hémisphère animal, les gradients de concentration croissante des ribonucléoprotéines, en allant du PV vers PA, et du vitellus, suivant un gradient inverse PA vers PV.
Modifications des structures cytoplasmiques à la fécondation
La pénétration du spermatozoïde dans l’hémisphère animal déclenche des remaniements cytoplasmiques dont la conséquence sera de déterminer le plan de symétrie de l’embryon dans les deux heures qui suivent la fécondation.
Le second globule polaire est émis après la pénétration du spermatozoïde, la tache de maturation disparaît par contraction du cytosquelette du feuillet pigmentaire cortical. Le noyau femelle haploïde ou pronucléus femelle se porte à la rencontre du noyau spermatique, pronucléus mâle, en une aire plus profonde du cytoplasme, le spermatozoïde entraîne du pigment dans le cytoplasme profond, marquant la traînée spermatique.
Rétraction de l’œuf dans ses enveloppes: rotation d’orientation. —Après la réaction corticale, la plasmalemme est libérée du contact avec la membrane vitelline devenue la membrane de fécondation. L’œuf s’équilibre selon les lois de la pesanteur, le pôle végétatif plus lourd s’oriente vers le bas. Cette rotation d’équilibration s’achève en 30 minutes et intéresse la totalité de la masse de l’œuf. (La chronologie qui est donnée correspond au développement à 180C).
Formation du croissant gris, acquisition du plan de symétrie de l’embryon (fig. 32): rotation de symétrisation. — 1 heure dix après la fécondation, un déplacement de cytoplasme superficiel comprenant la couche pigmentaire s’effectue suivant un mouvement de bascule d’une ampleur d’environ 30 degrés, autour d’un axe passant par le centre de l’œuf, et orthogonal à un plan déterminé par l’axe P.A.-PV. et la traînée spermatique. Le sens du déplacement est tel que le pigment descend vers le PV. du côté correspondant au point de pénétration du spermatozoïde et remonte vers le P.A. du côté opposé. La zone de remontée a une forme de croissant de teinte grisâtre due à du pigment resté sur place, le croissant gris. C’est dans le plan défini par P.A.-PV. et traînée spermatique que la remontée du pigment est à son maximum. Ce plan constitue le plan de symétrie de l’embryon et le croissant gris sa région dorsale. Le mouvement superficiel du cortex est appelé rotation de symétrisation.
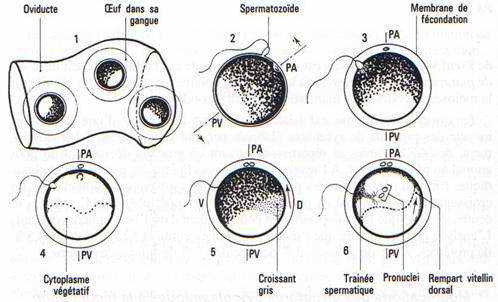
FIG. 32. Rotations d’orientation et de symétrisation dans l’œuf d‘Amphibien. 1 : Œufs dans l’oviducte orientés de façon quelconque. 2 et 3 : Pénétration du spermatozoïde, décollement de la membrane de fécondation, rotation d’orientation. 4-6 : Rétraction superficielle du pigment vers le point de pénétration du spermatozoïde, et formation du croissant gris dorsal. Remaniement profond du cytoplasme végétatif et formation du rempart vitellin dorsal. OEuf vu en coupe sagittale avant (4) et après (6) la rotation de symétrisation.
Chez le xénope (fig. 32), ce mouvement est dirigé par le spermaster qui se développe, lors de la pénétration du spermatozoïde. dans le cytoplasme de l’hémisphère animal autour du centriole spermatique et qui suit la migration du pronucléus mâle. Après la fusion des pronucléi mâle et femelle au centre de l’hémisphère animal, le cortex dorsal se contracte en direction du point d’entrée du spermatozoïde, entraînant un retrait dans la partie dorsale. Le sens de ce mouvement du cortex dorsal est sans doute induit par les interactions entre les microfilaments du cortex dorsal et les microtubules du spermaster qui sont largement développés. Des mouvements cytoplasmiques plus profonds créent aussi dans le vitellus une dissymétrie avec remontée d’un mur vitellin dorsal (Ubbels et al. 1983).
Chez les Urodèles qui sont polyspermiques, on ne connaît pas de relation entre croissant gris et pénétration du spermatozoïde. Il est possible que, dans ce groupe, le plan de symétrisation soit prédéterminé.
SEGMENTATION
(fig. 33)
C’est une segmentation totale et inégale.
Le développement se déroule à l’intérieur de la membrane de fécondation, jusqu’à l’éclosion.
La durée de la segmentation varie avec les espèces. Chez l’axolotl, un Urodèle, le premier sillon de segmentation qui sépare les deux premiers blastomères apparaît 2h30 après la fécondation et coïncide dans 50 % des cas avec le plan de symétrie bilatérale de l’embryon. Après une seconde division suivant un plan méridien perpendiculaire au premier et une troisième sus-équatoriale, les blastomères commencent à s’écarter sur leur face interne pour délimiter un blastocèle qui occupera surtout l’intérieur de l’hémisphère animal. Les 2 plans de division suivants sont méridiens et forment un angle de 45° avec les deux premiers. Les divisions sont d’abord synchrones pendant onze cycles, chaque cycle, dépourvu de phase G1, dure 70 minutes. Ce rythme se ralentit et les divisions deviennent asynchrones, avec allongement de G2 et apparition de G1, après le 11ème cycle qui correspond à la transition blastuléenne ou mi-blastula. Le ralentissement est plus marqué dans l’hémisphère végétatif. Au bout de 30 heures à 18 0C, l’embryon compte environ 10000 cellules et la gastrulation commence.
La chronologie est différente chez le xénope, avec des cycles de 35 minutes et une mi-blastula atteinte à la 9e heure de segmentation. Chez d’autres espèces aux oeufs volumineux, certaines rainettes, elle est par contre beaucoup plus lente.
|
|
|
FIG. 33. --Segmentation de l’œuf d’Amphibien représenté dépourvu de sa gangue. 1 à 4 : Stades 2 à 16 ; 5 : Morula ; 6-7 Blastula en vue externe et en coupe.
|
GASTRULATION
(fig. 34)
Dans cet œuf hétérolécithe, la totalité des cellules contenant des inclusions vitellines est concernée par les mouvements morphogénétiques. La gastrulation dure 24 heures chez le pleurodèle ou l’axolotl, mais seulement 7 heures chez le xénope.
Une zone d’invagination cellulaire ou blastopore se situe sous l’emplacement du croissant gris dont les limites se sont estompées pendant la segmentation. C’est d’abord un sillon incurvé, horizontal, la lèvre dorsale du blastopore qui évolue tandis que les tissus mésodermique et endodermique pénètrent dans la cavité de segmentation et forment une seconde cavité qui s’y emboîte, l’archentéron. La lèvre blastoporale s’incurve, avec son prolongement par les lèvres latérales, puis se referme en un cercle avec l’apparition de la lèvre ventrale du blastopore, entourant le bouchon vitellin constitué par les cellules endodermiques encore visibles à l’extérieur et dont le diamètre se réduit progressivement. Le blastopore prend enfin la forme d’une fente blastoporale verticale lorsque l’invagination est achevée. Cette fente correspond à l’anus chez les Urodèles. Chez les Anoures, elle s’oblitère, l’anus résulte d’une réouverture secondaire.
La formation et l’évolution du blastopore sont le résultat d’un mouvement combiné d’élongation et de recouvrement des tissus de l’hémisphère animal (épibolie) et de la disparition passive des cellules chargées en vitellus de l’hémisphère végétatif (embolie). Les mouvements de l’hémisphère végétatif provoquent une modification du centre de gravité, et un basculement de l’embryon sur la face ventrale. L’axe animal végétatif devient presque horizontal (fig. 34).
Principe d’une analyse de la gastrulation
par la technique des marques colorées (Vogt 1925)
Un marquage à l’aide de colorants vitaux des différentes parties de la surface de la blastula fut la première technique qui ait permis de suivre les mouvements cellulaires à la gastrulation et de reconstituer a posteriori une carte du devenir présomptif des différentes parties de la blastula avant la gastrulation: la carte des territoires présomptifs. Il suffisait d’utiliser de minuscules fragments d’agar agar imprégnés de rouge neutre ou de sulfate bleu de Nil qui étaient appliqués à la surface de la blastula immobilisée dans une logette de paraffine et convenablement orientée. On suivait ensuite le cheminement des marques colorées ainsi obtenues (fig. 34), ce qui permettait de préciser la chronologie, le sens et l’importance des mouvements des tissus pendant la gastrulation. D’autre part, on identifiait les différentes ébauches d’organes où se retrouvent les cellules colorées. Pour repérer sur la jeune blastula les emplacements normalement destinés à former un feuillet ou un organe donné, il suffisait d’y reporter après coup l’aire correspondant à ces organes et d’établir ainsi une carte des territoires présomptifs.
La carte des territoires ainsi dressée par Vogt reste très commode pour décrire les mouvements morphogénétiques. Cependant, on ne peut plus considérer qu’elle indique très exactement la destinée des cellules d’un territoire. En effet, ce marquage n’est pas assez précis; un certain degré de mélange cellulaire se produit à la frontière des territoires, dès la segmentation, puis à la gastrulation, ce que les marques colorées ne permettent pas de repérer. Par ailleurs, les plans de segmentation ne Sont jamais exactement reproductibles.
Des travaux réalisés sur diverses espèces, telles que le pleurodèle (Delarue et coll., 1992), le xénope (Dale et Slack, 1987), utilisent des colorants vitaux marqués à la fluorescéine ou à la rhodamine, qui sont injectés à des stades précoces du développement, par exemple dans chacun des blastomères d’une morula au stade 32 cellules du xénope, choisie pour la régularité de sa segmentation. Ils retrouvent à la neurula la position de chacune des cellules filles issues de chaque blastomère, ce qui leur permet de rétablir leur filiation jusqu’à la morula. Il existe certes une relation avec la cartographie classique, mais on constate aussi qu’une fraction des cellules dérivées des blastomères bien identifiés s’est trouvée intégrée, au stade neurula, dans des ébauches d’organes que l’analyse classique ne prévoyait pas. Les frontières entre les différents territoires sont donc beaucoup moins précises qu’il n’apparaît avec la méthode de Vogt.
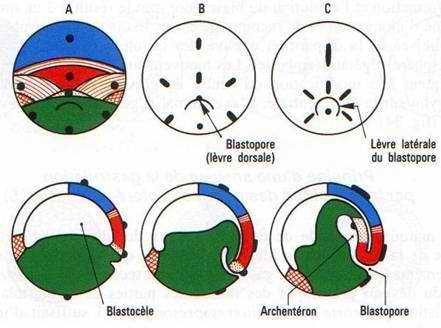
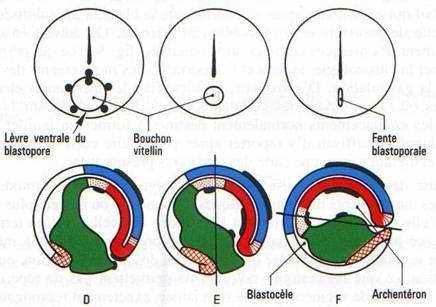
FIG. 34. — Gastrulation d’embryon d’Amphibien. Vues externes dorsales la lèvre blastoporale dorsale (A) se prolonge par des lèvres latérales (B, C) qui se rejoignent par une lèvre ventrale (D) le tout circonscrit un bouchon vitellin qui se réduit (D, E), fait place à une fente blastoporale (F) quand l’endoderme a disparu à l’intérieur. Les vues en coupe sagittale montrent la formation de l’archentéron, la réduction du blastocèle, l’élongation des feuillets ectoblastiques et mésoblastiques. A la fin de la gastrulation, l’embryon bascule sur la face ventrale (F). Des marques colorées, représentées ici en noir, sont déposées à la surface de la blastula. On suit leurs déformations et leurs migrations jusqu’à la fin de la gastrulation. Les territoires sont représentés suivant des conventions précisées (fig. 35).
On peut conclure qu’il n’existe pas pendant la gastrulation de ségrégation rigoureuse entre les cellules issues des territoires cytoplasmiques de l’œuf.
On ne peut qu’apprécier la probabilité pour que telle cellule issue d’une aire cytoplasmique donnée ait telle descendance.
Il faut noter que la carte classique des territoires qui est présentée ici est celle d’un Urodèle. Elle ne convient pas exactement au xénope chez qui les aires présomptives mésodermiques ne sont pas visibles en surface.
Carte des territoires présomptifs
(fig. 35)
Elle ne préjuge pas de l’état de détermination des territoires mais n’indique que leur destinée probable. On n’envisagera ici que les grandes subdivisions, bien que des localisations plus précises (organes des sens par exemple) soient connues.
1. L‘ectoblaste correspond à peu près à l’hémisphère animal. Il se subdivise en épiblaste ventral qui donnera l’épiderme et ses dérivés (placodes sensorielles notamment) et en neuroblaste dorsal, à l’origine du système nerveux.
2. Le mésoblaste forme une ceinture équatoriale et sous-équatoriale, plus large dorsalement. On identifie dorsalement les territoires de la corde et du mésoderme précordal à l’emplacement du croissant gris; latéralement, les territoires des somites et du mésoderme latéral, puis le mésoderme caudal.
3. L’endoblaste appartient à l’hémisphère végétatif. Il est à l’origine de l’épithélium du tube digestif et de ses dérivés. Il s’y forme les cellules germinales primordiales chez les Anoures.
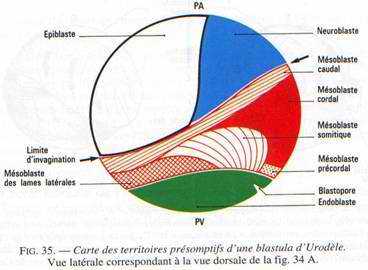
Interprétation des mouvements morphogénétiques à la gastrulation
(fig. 36)
Les tissus situés sous la limite de l’ectoblaste vont passer à l’intérieur. Les
mouvements sont complexes. On peut les décomposer comme suit :
• a) Involution ou enroulement des tissus mésoblastiques situés au-dessus de
la lèvre dorsale du blastopore, qui forment un feuillet mince et souple.
• b) Convergence des tissus mésoblastiques axiaux et des somites vers les
lèvres blastoporales dorsales et latérales où ils involuent.
• c) Élongation des tissus de l’hémisphère animal, ectoblaste et mésoblaste, l’allongement des tissus du mésoblaste se poursuivant encore à l’intérieur, après son involution. L’élongation de l’ectoblaste lui permet de recouvrir activement par épibolie, la totalité de l’embryon. Le front de progression de ce feuillet autour de la masse de l’endoblaste devient visible à la fin de la gastrulation par la matérialisation de lèvres latérales et ventrales du blastopore.
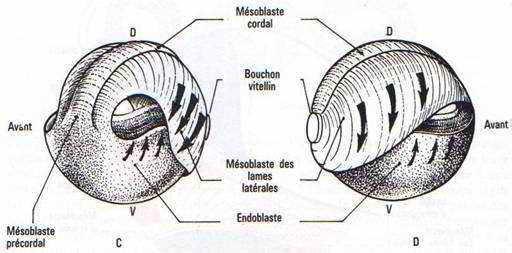
FIG. 36. --Mouvements morphogénétiques à la gastrulation. A : Vue dorso-végétative d’une gastrula avec indication des mouvements de convergence, élongation, enroulement autour des lèvres blastoporales, et divergence en profondeur. B : Coupe de gastrula âgée lors de l’extension du mésoblaste et de l’endoblaste. C et D : Mouvements d’extension du mésoblaste, de l’endoblaste (flèches), l’ectoblaste étant supposé enlevé. C vue de l’avant. D: vue de l’arrière.
• d) Embolie de la masse de l’endoblaste recouverte par les tissus qui progressent au niveau des lèvres blastoporales qui entourent sa partie visible ou bouchon vitellin.
Le résultat de ces mouvements (fig. 34 F) est, au stade du bouchon vitellin, la formation d’un germe à deux feuillets; l’un, externe ou ectoderme, l’autre interne, composite avec une voûte dorsale mince de mésoderme et un plancher massif d’endoderme. Le feuillet interne limite une cavité nouvelle, l’archentéron, qui s’ouvre au niveau d’un blastopore qui peut se fermer pour s’ouvrir plus tard et former l’anus en une aire dépourvue de mésoderme. La cavité de segmentation est à peu près totalement oblitérée.
Simultanément, à la limite entre endoderme et mésoderme entourant l’archentéron, une discontinuité se crée. Il y a divergence du matériel mésodermique des lames latérales qui s’étale à droite et à gauche puis vers le bas entre ectoderme et endoderme, tandis que les parois latérales de l’endoderme convergent et tendent à se rejoindre dorsalement pour délimiter l’archentéron. Le mouvement s’achève dans la neurula. Trois feuillets emboîtés se mettent ainsi en place, l’ectoderme, qui s’épaissit sur la face dorsale, le mésoderme et l’endoderme. Dans le mésoderme, la couche axiale va s’isoler progressivement, le mésoderme précordal se dissocie sous l’ectoderme et la future région céphalique (fig. 37).
NEURULATION
(fig. 37)
Cette étape du développement embryonnaire s’achève en 24 heures à 18 0C chez les Urodèles.
• 1. — Extérieurement, on note un allongement dans le sens antéro-postérieur et un aplatissement de l’embryon dans la région dorsale, qui délimite la plaque neurale en forme de raquette. Celle-ci se creuse en gouttière, se referme d’abord au niveau médian puis s’isole, formant le tube nerveux. Des épaississements latéro-dorsaux répétés au niveau du tronc sont la manifestation de la différenciation des somites. Des épaississements antérieurs et latéraux dans la région du cerveau marquent les ébauches des placodes sensorielles (cristallin, oreille interne) et des bourgeons branchiaux.
• 2. — Les mouvements internes sont la continuation des mouvements gastruléens.
1. La zone dorsale de l’ectoderme, en contact étroit avec le mésoderme se différencie en neuroblaste sous l’influence inductrice de ce dernier (3e partie, chap. 4). Les bords latéraux de l’aire aplatie de la plaque neurale forment les bourrelets médullaires. Leur partie la plus externe forme les crêtes neurales. La fusion des bourrelets dans le plan de symétrie de l’embryon isole un tube nerveux du restant de l’ectoderme. Celui-ci n’est plus alors constitué que par de l’épiblaste qui recouvre la totalité de l’embryon et d’où s’isoleront plus tard des placodes sensorielles. Le tube nerveux est élargi vers l’avant en une vésicule céphalique, futur encéphale; il est flanqué latéralement par les crêtes neurales.
2. Dans le mésoderme, les somites s’individualisent. Leur nombre varie suivant l’espèce. Ce sont des masses de mésoderme paires, situées de part et d’autre de la corde qui est axiale. Ils forment une structure répétitive qui se différencie en arrière du niveau de la vésicule céphalique dans le sens antéropostérieur. La corde s’isole en un cylindre de cellules turgescentes. Le mésoderme précordal s’étale sous la vésicule céphalique. Les lames latérales se creusent d’une cavité ou cœlome qui est à l’origine de la cavité générale. Le feuillet externe est la somatopleure, le feuillet interne la splanchnopleure. Entre les lames latérales et les somites, des zones d’étranglement constituent les pièces intermédiaires qui s’isoleront des somites mais restent en communication avec la cavité cœlomique. Comme les somites, elles se métamérisent et forment les gononéphrotomes à l’origine de l’appareil uro-génital.
3. L’endoderme achève son mouvement de fermeture dorsale. Il se trouve au contact direct de l’ectoderme aux emplacements de la future bouche et du futur anus.
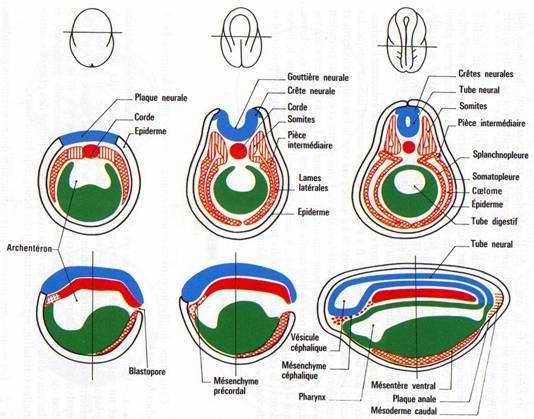
FIG. 37. Neurulation d’embryon d’Amphibien. 3 stades différents : Plaque neurale, gouttière neurale et tube neural. Haut : vues externes dorsales. Milieu : coupes transversales. Bas : coupes longitudinales.
ÉVOLUTION DES FEUILLETS APRÈS LA NEURULATION
(fig. 38)
Le devenir de chacun de ces territoires est illustré par des schémas de bourgeon caudal en coupes transversale et longitudinale.
Ectoderme
1. Neuroblaste
— Vésicule céphalique: formée d’abord de trois vésicules : le prosencéphale, le mésencéphale, le rhombencéphale. La première se divise en télencéphale (hémisphères cérébraux) et diencéphale (avec les vésicules optiques); la deuxième donne les lobes optiques et pédoncules cérébraux, la dernière forme le métencéphale (cervelet) suivi du myélencéphale (bulbe rachidien).
— Tube nerveux: moelle épinière.
— Crêtes neurales: ganglions nerveux crâniens et rachidiens, ganglions des systèmes sympathique et parasympathique, certains muscles lisses et striés de la tête et du cou, une partie du squelette cartilagineux de la tête, certains éléments des tissus conjonctifs de la tête, les cellules pigmentaires, les glandes médullo-surrénales.
2. Epiblaste
— Épiderme et phanères (poils, plumes, cornes, etc.).
— Placodes sensorielles (vésicules olfactives, cristallins, vésicules auditives).
— Placodes des lobes antérieur et intermédiaire de l’hypophyse, de certains ganglions crâniens; elles participent aussi avec les crêtes neurales céphaliques à la formation du squelette des arcs branchiaux chez la larve.
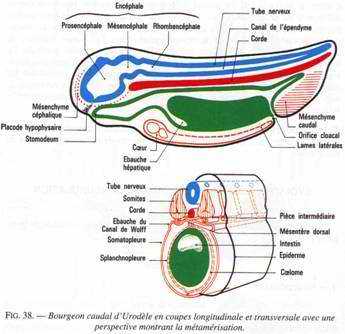
Le Mésoderme
1. Mésoderme cordal et précordal : la corde régresse en général, subsiste chez quelques Poissons. Le mésoderme précordal forme le mésenchyme céphalique d’où dérive une partie du squelette et du mésoderme de la tête.
2. Somites: les sclérotomes: ébauches du squelette axial; les myotomes : muscles striés dorsaux et ventraux; les dermatomes derme et mésenchyme.
3. Pièces intermédiaires restant provisoirement en communication avec le cœlome des lames latérales Situées du même côté, elles forment la médulla des gonades, les uretères.
4. Lames latérales, constituées par 2 feuillets se rejoignant ventralement puis dorsalement et formant les mésentères dorsal et ventral:
— La splanchnopleure (ou feuillet interne) à l’origine de muscles lisses, myocarde, endocarde, endothélium des vaisseaux sanguins, les cellules sanguines.
— La somatopleure (feuillet externe) à l’origine de la musculature viscérale de la tête, le péricarde, le squelette et la musculature des membres, le cortex des gonades.
Endoderme
Épithéliums du tube digestif et des glandes annexes (glandes salivaires, foie et pancréas), de la cavité pharyngienne et de ses dérivés (thyroïde, para-thyroïde, thymus), l’épithélium pulmonaire, la vessie.
LA MÉTAMÉRISATION CHEZ LES VERTÉBRÉS
La segmentation du mésoderme para-axial en somites est une manifestation de l’organisation métamérisée des Vertébrés.
Un métamère est une unité d’organisation du corps qui, chez certains Invertébrés, se répète presque à l’identique, délimitant des segments le long de l’axe antéro-postérieur (ex: segments de Vers Annélides). Au cours de l’évolution, une spécialisation régionale de plus en plus poussée est apparue, comme chez les Insectes, aboutissant même à ce que la structure avec segments visibles ne reste perceptible que chez l’embryon, c’est le cas des Vertébrés. Il n’en demeure pas moins que de nombreux caractères de la métamérie subsistent chez l’adulte:
— Les vertèbres, par exemple, sont des structures métamérisées, formées par l’union d’éléments provenant de la moitié antérieure d’un somite et de la moitié postérieure de celui qui le précède.
— La division en somites du mésoderme dorso-latéral influence la disposition d’autres organes, notamment la distribution des nerfs moteurs, des ganglions spinaux et sympathiques dont la répartition est imposée par le découpage du mésoderme dorso-latéral en sclérotomes, une paire de ganglions se situant entre deux sclérotomes successifs.
— Le mésoderme dorsal n’est pas seul à être métamérisé; le rhombencéphale de la jeune neurula est segmenté en rhombomères et cette organisation conditionne celle, ultérieure, des nerfs crâniens, du mésoderme pharyngien (arcs viscéraux), ainsi que la destinée des cellules des crêtes neurales, qui semble dépendre de leur rhombomère d’origine.
Nous verrons que chaque métamère se différencie en fonction du niveau où il se trouve le long de l’axe antéro-postérieur du corps, et que cette différenciation est régulée par des familles de gènes régulateurs, dont les mieux connus actuellement sont les gènes sélecteurs homéotiques.
TP 4 :
DÉVELOPPEMENT DES OISEAUX.
STRUCTURE DE L’OEUF D’OISEAU
Organisation de l’œuf et de ses enveloppes
(fig. 39)
C’est un oeuf télolécithe qui se caractérise par une accumulation tardive de réserves. La croissance de l’ovocyte se déroule lentement jusqu’à une semaine environ avant l’ovulation; dans une seconde phase qui dure 6 à7 jours chez la poule, l’œuf passe de 0,2 à 16 grammes environ. Il se dépose un vitellus dont les éléments sont élaborés dans le foie. Le jour, un vitellus jaune se forme, plus riche en graisse et en pigment que le vitellus nocturne qui est blanc. La latebra est la masse centrale du vitellus anciennement formé, le col et le noyau de Pander marquent le chemin de migration de la cicatricule vers la surface du cytoplasme pendant la croissance de l’œuf. La cicatricule, de 3 mm de diamètre, marque le pôle animal de l’œuf; constituée de cytoplasme sans réserves, elle seule se segmentera.
Une membrane vitelline constitue la membrane primaire périovulaire. S’il y a eu fécondation, celle-ci se produit au niveau de la trompe de l’oviducte. Des enveloppes secondaires se déposent ensuite pendant le transit de l’œuf dans l’oviducte. Le blanc ou albumine se forme en trois heures dans une portion égale à la moitié de la longueur de l’oviducte (le magnum), puis la membrane coquillière se dépose dans l’isthme en une heure. Le blanc s’enrichit en eau dans l’utérus où son volume double; la coquille se constitue en 22 heures.
L’œuf d’Oiseau est composé d’eau, 65% ; protéines, 12% ; graisses, 10% ; calcite, 10%; divers, 2,5%.
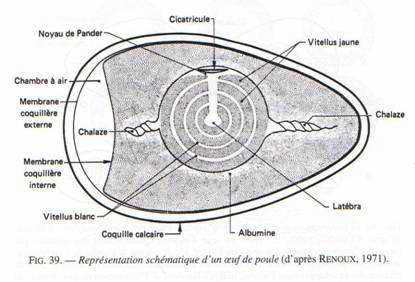
Acquisition de l’orientation de l’embryon
L’axe antéro-postérieur de l’embryon se fixe au cours du séjour de l’œuf dans l’utérus (fig. 40) après formation des membranes et de la coquille. Les enveloppes de l’œuf subissent un mouvement de rotation qui se matérialise par la torsion d’une partie de l’enveloppe albumineuse, les chalazes, qui se fixent à la membrane coquillière à la droite de l’embryon, la chalaze est senestre, à sa gauche elle est dextre. C’est la pesanteur et le sens de rotation qui interviennent dans cette détermination. La démonstration en a été apportée en agissant sur des oeufs obtenus précocement par pression au niveau de l’utérus où ils n’avaient séjourné que 10 heures. L’axe antéro-postérieur n’est pas encore définitivement fixé et, suivant la position qu’on fait adopter aux oeufs en expérience tandis qu’ils tournent artificiellement, on modifie sa direction.
Dans les conditions normales, le disque embryonnaire, ou blastodisquehypoblaste a progressé dans la cavité de segmentation, le sens de cette progression ayant un effet déterminant sur l’orientation des territoires ecto-mésodermiques, comme on le verra ultérieurement. Le plan dorso-ventral de l’animal correspond au gradient vitellin, la partie dorsale étant à la surface du disque embryonnaire. adopte une position dans l’espace telle que l’axe de l’embryon est perpendiculaire au grand axe de la coquille, la tête étant tournée dans le sens de la rotation de l’œuf. L’acquisition de la symétrie bilatérale n’est irréversible qu’après un temps de transit dans l’oviducte de 14 à 16 heures; ce temps correspond à un stade de la segmentation où l’
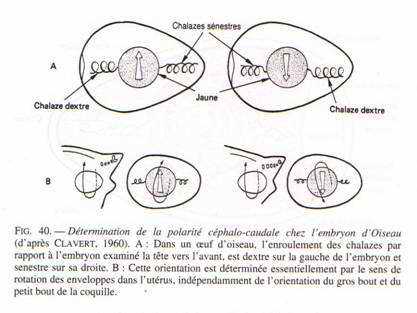
SEGMENTATION
(fig. 41)
C’est une segmentation partielle qui n’intéresse que le disque germinatif de 3 mm de diamètre environ. Son cytoplasme est dépourvu de réserves et contient le noyau de fécondation. La segmentation se produit dans l’oviducte et commence 5 heures après la fécondation chez l’embryon de poulet, elle est achevée au bout de 24 heures. La blastula comporte alors quelques dizaines de milliers de cellules.
Les premiers blastomères, jusqu’au stade 16 cellules, n’ont pas de membrane plasmique inférieure (fig. 41a). Le blastodisque en segmentation ou blastoderme compte 8 blastomères centraux à limites nettes et 8 blastomères périphériques dont les limites avec le vitellus sont peu distinctes. Aux stades 32 et 64, les blastomères centraux acquièrent une limite inférieure. Plusieurs assises cellulaires se mettent en place par multiplication des cellules du disque central. Une cavité se creuse entre celles-ci et le vitellus sous-jacent (fig. 41b). On distingue alors plusieurs régions dans le blastoderme. Au centre, l’aire pellucide avec les cellules au-dessus de la cavité de segmentation. A la périphérie. l’aire opaque comprend 3 zones : la zone de recouvrement, où les mitoses sont actives, avec des blastomères bien individualisés au Contact du vitellus, le rempart germinatif qui est une zone profonde dont les blastomères sont individualisés, la zone de jonction qui est une assise profonde, sans limites nettes avec le vitellus et qui constitue le syncytium vitellin.
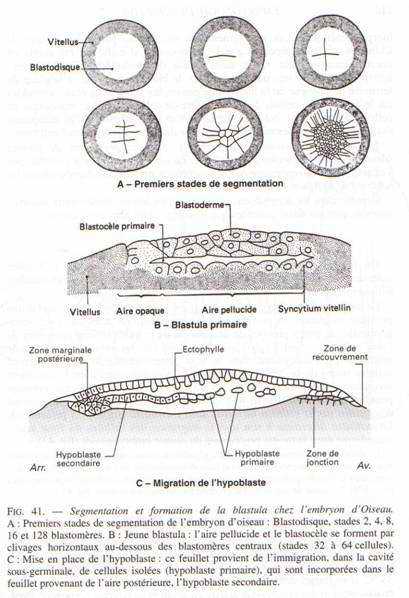
GASTRULATION
Différentes méthodes ont été utilisées pour établir des cartes des territoires présomptifs de la blastula des Oiseaux et analyser les mouvements morphogénétiques. Les mouvements de très petites particules d’encre de Chine ou carbone déposées sur le blastoderme d’œufs ont été suivis en microcinématographie. On a aussi utilisé des techniques plus précises transplantations de très petits territoires de blastula de caille, à la place du territoire homologue de la blastula de poulet, les transplants étant repérables car le noyau de la cellule de caille diffère de celui du poulet; marquages de cellules à l’aide d’un colorant fluorescent et non diffusible. Ces marqueurs ont permis de suivre les migrations et de localiser ces cellules dans l’embryon.
Les cartes des territoires présomptifs obtenues présentent de légères variantes suivant la technique employée. La carte de la figure 43, établie par Vakaet (1985), ne représente pas le neuroblaste présomptif; il apparaît sur les schémas de la figure 42, établis d’après d’autres travaux.
Comme chez les Amphibiens (cf. p. 103), les limites réelles entre les territoires ne sont pas aussi tranchées que semblent l’indiquer les schémas.
Mise en place de l’hypoblaste
Un feuillet interne, l’entophylle ou hypoblaste, va doubler le feuillet externe, l’ectophylle ou épiblaste qui s’étend et s’amincit. Ces deux feuillets délimitent un blastocœle homologue du blastocœle des Amphibiens.
Le mode de formation de l’hypoblaste est encore discuté. Il provient d’une première migration en profondeur (polyinvagination), dans la cavité sous-germinale, de petits groupes de cellules ou de cellules isolées provenant de l’aire pellucide, c’est l’hypoblaste primaire; elle est suivie d’une seconde migration plus importante, dans le sens postéro-antérieur, d’un feuillet de cellules issues de la partie postérieure de l’aire pellucide, c’est l’hypoblaste secondaire qui rejoint et englobe les îlots de cellules de l’hypoblaste primaire pour former l’hypoblaste (fig. 41). La direction de cette dernière migration est déterminée par la rotation de l’œuf dans l’oviducte (fig. 40), la présence de l’hypoblaste détermine à son tour la migration des cellules du futur endomésoderme dans la moitié postérieure du disque embryonnaire (fig. 43).
Le disque embryonnaire comprendrait, répartis en zones concentriques, des territoires ayant des potentialités endodermiques et mésodermiques, qui ne s’expriment pas naturellement dans la moitié antérieure, mais seulement sous certaines conditions expérimentales. La limite de ces zones est évoquée par un tracé en pointillé fig. 43 A.
Formation de la ligne primitive
La symétrisation de l’œuf a lieu environ 5 heures avant la ponte et les territoires de l’endoblaste se condensent à l’arrière du blastoderme (fig. 43 A). Dans les premières heures de l’incubation qui, chez la poule, dure 21 jours à 38 0C, il se forme, dans la zone marginale postérieure de l’aire pellucide, un épaississement qui progresse d’arrière en avant et se referme comme un éventail dont l’extrémité serait au centre du blastoderme, et les bras aux limites extrêmes du mésoblaste présomptif (fig. 43, 44). Cet épaississement résulte de la migration, vers l’arrière du disque embryonnaire, de certaines cellules dispersées dans l’épiblaste. Ces cellules dont la membrane contient un acide glycuronique sulfaté particulier seraient guidées (chimiotactisme) par une substance émise par l’hypoblaste et dont la concentration est maximale dans la zone marginale postérieure. Les cellules qui s’enfoncent alors sous l’épiblaste formeront l’endoblaste et du mésoblaste (Stern, 1991). Tandis que le blastoderme s’allonge dans le sens antéro-postérieur, cet épaississement en éventail s’allonge également et se referme en une ligne primitive avec un sillon médian, trace de l’immigration en profondeur des cellules du mésoblaste; elle sera terminée par un renflement antérieur, le nœud de Hensen. Son développement est à son maximum après 18 heures d’incubation. Au fur et à mesure que la gastrulation se déroule, cette ligne régresse et le prolongement céphalique constitué par le mésoderme axial invaginé devient visible par transparence.
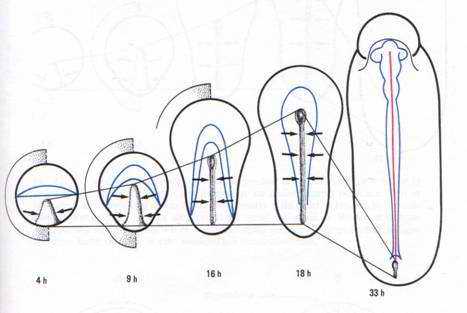
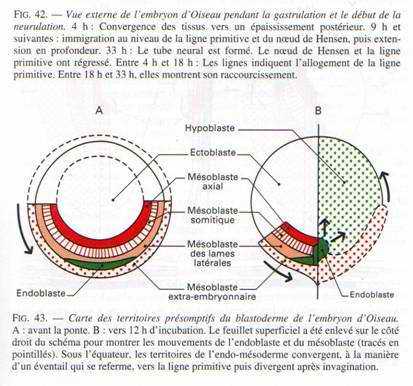
Mise en place de l’endoblaste et du mésoblaste
L’embryon se développe uniquement à partir de l’épiblaste de la blastula. Les tissus de l’aire opaque constituent l’ectoderme extra-embryonnaire dont les cellules du front migrent activement à la surface du jaune, prolifèrent et tendent à l’envelopper par épibolie. Elles sont à l’origine de l’ectoderme des annexes. Ce feuillet est doublé intérieurement par l’expansion du mésoderme extra-embryonnaire.
Les mouvements gastruléens peuvent se décomposer comme chez les Amphibiens (fig. 44) convergence des cellules du blastoderme vers la zone de formation de la ligne primitive; immigration en profondeur des cellules de l’endoblaste et du mésoblaste au niveau de la ligne primitive, ces cellules migrant isolément ou sous la forme d’un mésenchyme lâche; divergence du mésoblaste extra-embryonnaire et des lames latérales de part et d’ autre de la ligne primitive (les cellules de l’endoblaste et du mésoblaste axial migrent vers l’avant au niveau du nœud de Hensen et restent dans la zone médiane) ; les mouvement d’élongation de l’embryon se poursuivent pendant toute la gastrulation ; celle-ci ne s’achève, à l’arrière de l’embryon, qu’avec la disparition totale de la ligne primitive, tandis que la neurulation est déjà terminée dans la région antérieure.
— Les cellules de l’endoblaste qui migrent les premières, à partir de la 10ème heure, au niveau du nœud de Hensen, se dirigent vers l’avant (fig. 44); elles écartent l’hypoblaste, le remplaçant dans l’axe antéro-postérieur de l’embryon et formant l’ébauche du tube digestif antérieur; l’hypoblaste, repoussé dans l’aire extra-embryonnaire, forme vers l’avant et latéralement le croissant germinal contenant les cellules germinales primordiales (v. p. 264); il va prolonger l’endoblaste dans l’aire extra-embryonnaire. De l’endoblaste migre aussi latéralement, de part et d’autre de la ligne primitive; à l’arrière de l’aire pellucide, de l’endoblaste de jonction a une destinée extra-embryonnaire.
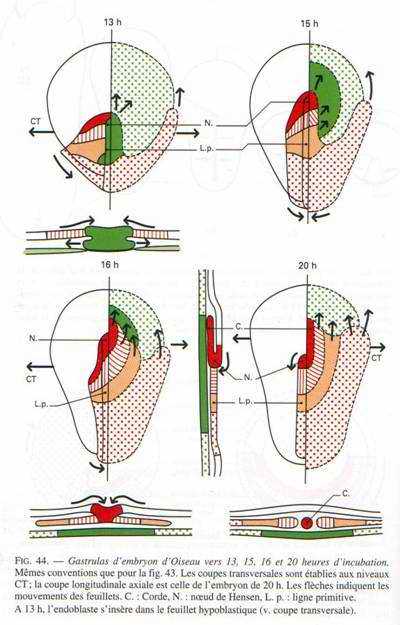
— La migration du mésoblaste débute vers la 14ème heure, tous ces tissus se mettent en place dans le blastocœle, entre l’épiblaste et le feuillet interne (fig. 44). Elle commence dans la moitié postérieure de la ligne primitive par l’invagination et l’extension vers l’avant du mésoderme extra-embryonnaire. Lorsque commence le recul de la ligne primitive, le mésoblaste axial, précordal et cordal, s’invagine au niveau du nœud de Hensen à la suite de l’endoblaste et migre dans l’axe de l’embryon ; la corde forme un axe dense, visible par transparence, le prolongement céphalique. De part et d’autre du nœud de Hensen et de la moitié antérieure de la ligne primitive migrent successivement le mésoblaste des lames latérales et celui des pièces intermédiaires qui divergent vers l’avant et latéralement; le mésoderme des premiers somites s’installe en dernier lieu, sans s’étaler.
— Fin de la gastrulation: vers la 20ème heure d’incubation, il ne reste en surface que le l’ectoblaste, à l’exception d’une zone de prolifération intense au niveau du nœud de Hensen, où continuent à se former du neuroblaste et de la corde, et au niveau des parois de la ligne primitive, où se forment les mésodermes latéral et somitique de la partie postérieure de l’embryon.
L’ectoblaste comprend le neuroblaste qui s’étend dans l’axe de l’embryon, au dessus de la zone de migration du mésoblaste cordal et précordal (fig. 42); le reste de la surface de l’aire pellucide correspond à l’épiblaste. Le mouvement de recul du nœud de Hensen et de la ligne primitive ne s’achève que vers la 48ème heure d’incubation, alors que l’organogenèse a déjà commencé.
A 18 heures, sont déjà en place les ébauches présomptives des divers organes sensoriels (placodes), des territoires organo-formateurs comme ceux du cœur etc. On peut considérer que ce stade correspond à celui de la fente blastoporale chez les Amphibiens.
NEURULATION
(fig. 45-46)
Les plis neuraux apparaissent après 20-21 heures d’incubation, de part et d’autre du neuroblaste, délimitant la plaque neurale et se rencontrent dans l’axe médian au niveau du cerveau moyen après 26 heures. La fermeture progresse vers l’avant, isolant le cerveau antérieur vers 30-33 heures. La fermeture du tube neural s’achève au niveau caudal après 44 heures d’incubation.
L’embryon commence à se détacher de la masse de l’œuf: la région antérieure se soulève au-dessus du blastoderme. Il se forme alors un repli céphalique ectodermique ventral qui entraîne la délimitation de l’intestin antérieur en repliant avec lui l’endoderme sous-jacent. Le même pincement délimitera plus tard l’intestin postérieur; les 2 ébauches se rencontrent au bout de 4 jours; la communication entre le tube digestif et le vitellus est alors réduite à un simple tube, le pédicule vitellin.
Les somites se différencient à partir de la 20ème heure d’incubation, la métamérisation découpant le mésoblaste somitique à raison de 1 paire par heure d’incubation. Les pièces intermédiaires s’individualisent. Les lames latérales se rejoignent ventralement sous le pharynx en avant de la zone des somites. Des ébauches paires qui s’en détachent fusionnent pour former le tube cardiaque.
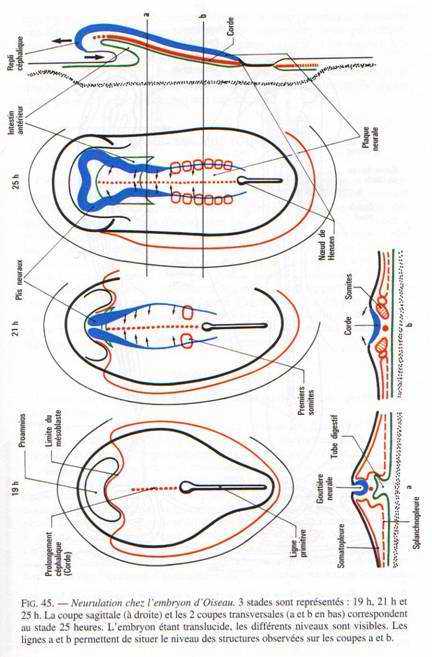
Les lames latérales extra-embryonnaires s’insinuent dans l’aire opaque à la périphérie du blastoderme. C’est dans la paroi de leur splanchnopleure que se différencient les îlots sanguins avec les premières cellules sanguines. Ces îlots se ramifient et fusionnent en une aire vasculaire extra-embryonnaire. Les lames latérales extra-embryonnaires entreront dans la constitution des annexes embryonnaires.
La ligne primitive continue de reculer et de se raccourcir en direction caudale, tandis que la gastrulation se poursuit. Elle se trouve finalement enserrée dans une région légèrement déprimée, le sinus rhomboïdal, délimitée vers l’avant par les plis neuraux; cette région contient des tissus qui complèteront en surface le tube nerveux, en profondeur, la corde et les somites. Les plis neuraux n’achèvent de se rejoindre qu’au bout de 44 heures.
Au bout de 33 heures, l’embryon se tord dans sa partie antérieure et se couche sur la gauche, tandis que les vésicules cérébrales et la région cardiaque se différencient et croissent rapidement.
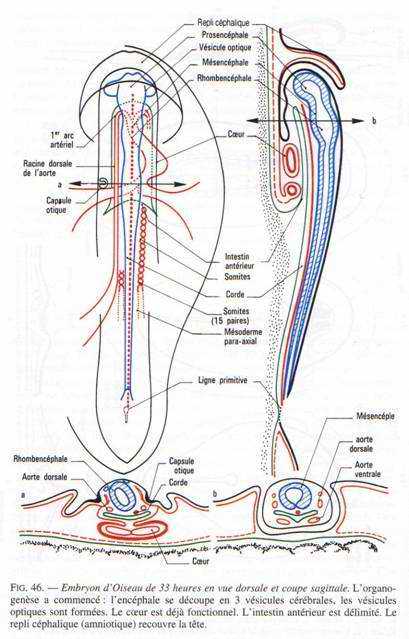
ANNEXES EMBRYONNAIRES
(fig. 47 et 48)
Ce sont des formations d’origine ectodermique, mésodermique et endodermique qui se développent hors du corps de l’embryon proprement dit, assurent sa protection, l’absorption des réserves, la respiration, l’élimination des déchets. Vers 2O-24 heures d’incubation, le corps de l’embryon commence à se distinguer des tissus périphériques; les plis antérieurs, plis postérieurs et plis latéraux le soulèvent et l’isolent de la masse vitelline. Pendant ce temps, les feuillets embryonnaires s’étendent hors du corps de l’embryon et vont continuer à former les annexes : vésicule vitelline, amnios et allantoïde. Celles-ci s’individualisent tandis que l’isolement de l’embryon par rapport à la masse de l’œuf s’accentue rapidement. A 96 heures d’incubation, il n’est plus relié à la vésicule vitelline et à l’allantoïde que par les pédicules vitellins et allantoïdiens. La cavité amniotique l’entoure alors complètement. Ces mêmes annexes vont se retrouver au cours de l’ontogenèse des Mammifères.
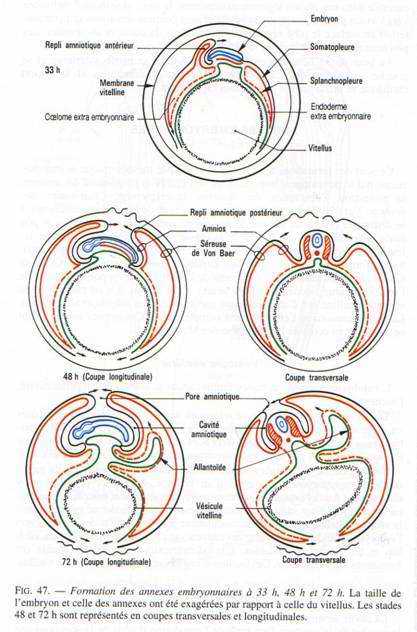
VESICULE VITELLINE
L’endoblaste n’est qu’un mince feuillet aplati au-dessus d’une petite cavité, l’archentéron.
Tandis que l’archentéron en se refermant vers l’avant, l’arrière et les côtés va donner le tube digestif de l’embryon, les tissus endodermiques et l’hypoblaste qui le prolongent vont proliférer hors de l’embryon, s’étaler à la surface du jaune, tendre à l’englober et à constituer la vésicule vitelline (fig. 47).
Cet endoderme extra-embryonnaire est suivi dans sa croissance par le mésoderme extra-embryonnaire, creusé d’un cœlome extra-embryonnaire; on y distingue un feuillet interne ou splanchnopleure et un feuillet externe ou somatopleure. Des vaisseaux sanguins se différencient dans le mésoderme splanchnique:
La vésicule vitelline est richement vascularisée pour le transfert des réserves vers l’embryon. L’endoderme sécrète des enzymes qui fragmentent les granules vitellins et les rendent assimilables. L’ectoderme extra-embryonnaire double ces formations vers l’extérieur. Ces feuillets n’englobent jamais totalement le vitellus.
Cavité amniotique
La cavité amniotique se forme à partir de 30 à 33 heures d’incubation. C’est le résultat de la soudure d’un repli de l’ectoderme doublé de la somatopleure
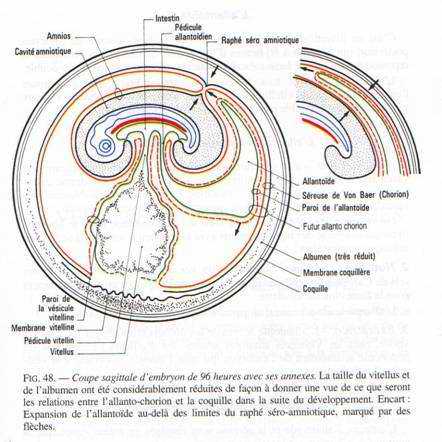
L ‘allantoïde
C’est un diverticule endodermique, issu de la face ventrale de l’intestin postérieur, qui apparaît à 60 heures d’incubation. Sa croissance est rapide. Il repousse devant lui une lame mésodermique, la splanchnopleure, qui le double.
L’allantoïde envahit tout le cœlome extra-embryonnaire et entoure l’amnios et la vésicule vitelline en refoulant l’albumen. L’embryon à 14 jours sera entouré d’une double enveloppe l’amnios et l’allantoïde.
L ‘allantoïde a plusieurs fonctions:
1. Respiratoire. — Sa doublure mésodermique, ou splanchnopleure, est vascularisée, elle s’applique contre la séreuse (c’est-à-dire ectoderme extra-embryonnaire + somatopleure) et l’ensemble formera un allanto-chorion, très vascularisé où se feront les échanges respiratoires à travers la coquille.
On retrouve les mêmes feuillets chez les Mammifères, dans le placenta fœtal qui contracte des rapports étroits avec la muqueuse utérine où se font les échanges respiratoires.
2. Nutritive. — L’allanto-chorion est un site d’absorption d’une partie des sels de Ca2+ de la coquille à laquelle il est accolé; ils sont utilisés notamment pour la formation du squelette.
L’allantoïde absorbe aussi en partie l’albumen, ou blanc de l’œuf.
3. Excrétrice. — L’allantoïde accumule les déchets éliminés par les reins (la vessie, chez les Vertébrés amniotes adultes, est d’ailleurs l’homologue du pédoncule allantoïdien de l’embryon qui relie l’intestin postérieur à la vésicule allantoïdienne).
Destinée des annexes après l’éclosion
L’amnios, l’allantoïde et la séreuse sont éliminés en même temps que la coquille. L’albumen a été totalement utilisé.
Il reste 1/3 à 1/5 du jaune. Il se rétracte à l’intérieur de la cavité abdominale de l’embryon et se trouve incorporé à l’intestin moyen; il sera utilisé dans les deux premières journées de la vie libre.
Conclusion
Cette description des premiers stades du développement montre que, à partir d’un plan d’organisation différent de celui de l’œuf d’Amphibien, on aboutit à de grandes similitudes et à des homologies parfaites entre l’organogenèse des Oiseaux et celle des Amphibiens.
Une différence essentielle est liée au mode de segmentation dû au vitellus et au développement d’organes provisoires, les annexes, qui protègent l’embryon et lui permettent d’utiliser les réserves vitellines qui restent externes au corps de l’embryon proprement dit.
TP 5 :
LA DIFFÉRENCIATION DE L’OEIL.
Cet exemple d’organogenèse permet de mettre en évidence des interactions inductrices complexes entre les constituants d’un futur organe; des synthèses d’ARN et protéines spécifiques en résultent.
Description sommaire de la morphogenèse de l’œil
(fig. 87)
Cet organe comprend des formations ectodermiques et mésodermiques la rétine et l’iris, expansions de la vésicule cérébrale, le cristallin et la cornée sont dérivés de l’épiderme céphalique. Les enveloppes de l’œil, choroïde et sclérotique, sont mésodermiques.
Au stade bourgeon caudal, la vésicule antérieure du futur encéphale, le prosencéphale, forme latéralement deux expansions, les vésicules optiques, qui sont réunies entre elles par la bandelette chiasmatique. Ces vésicules s’étranglent au niveau de leurs pédoncules qui deviendront les nerfs optiques.
Elle se creuse en cupules dont la concavité est tournée vers l’extérieur. Les cupules sont formées de deux feuillets accolés, l’un se différencie en rétine sensorielle tournée vers l’épiderme, il est doublé vers l’intérieur par le second qui devient le feuillet pigmentaire. La périphérie de la cupule formera l’iris. Les cupules optiques s’appliquent contre l’ectoderme céphalique latéral qui s’épaissit en une ébauche, la placode cristallinienne à l’origine du cristallin. Cette placode s’invagine, se referme en vésicule cristallinienne et s’isole de l’épiderme. L’épiderme refermé au-dessus de la vésicule forme la cornée transparente. Les espaces entre cristallin et cupule optique sont envahis par du mésenchyme qui se différencie en corps vitré. Le globe oculaire acquiert sa rigidité grâce à la différenciation d’une enveloppe mésodermique à forte trame de collagène: la sclérotique, cartilagineuse ou porteuse d’éléments osseux dans certaines espèces (oiseaux).
Inductions
Les interactions actuellement connues entre les différents éléments formateurs de l’œil sont très nombreuses. Il n’en sera examiné que quelques-unes.
1. La formation de deux vésicules optiques latérales est induite par le mésoderme précordal
A la fin de la gastrulation, l’ensemble de la plaque neurale antérieure possède des potentialités uniformes. Le toit de l’archentéron, sous la plaque neurale, est constitué par du mésoderme précordal qui va se dissocier ensuite pour former du mésenchyme céphalique. C’est sa présence qui induit le plancher du diencéphale à former des vésicules optiques, puis réduit Ces potentialités à deux aires latérales de cette région. Si on fait l’ablation du mésoderme précordal, l’embryon sera anophtalme, c’est-à-dire dépourvu d’yeux ou sera cyclope et ne formera qu’une vésicule optique médiane. Les parois des vésicules optiques induites sont le siège d’une activité mitotique accrue et une certaine turgescence interne du tube neural favorise leur expansion.
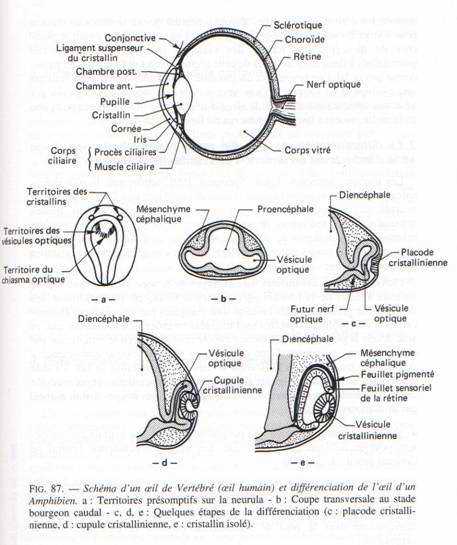
2. La différenciation du cristallin est le résultat le l’action d’une série d’inducteurs en direction de l’épiderme céphalique
Les travaux antérieurs, depuis Spemann, 1901, attribuaient le rôle inducteur essentiel à la vésicule optique et considéraient que tout l’ectoderme de la neurula était compétent pour former un cristallin. Ces conclusions, basées souvent sur des expériences de transplantation et de greffe, ne peuvent être retenues. Les techniques de marquage des tissus du donneur et du receveur ainsi que les méthodes purement morphologiques pour détecter un cristallin étaient insuffisantes.
Plus récemment, des travaux sur l’embryon de xénope entre les stades de la gastrula âgée et de la neurula âgée (Henry et Grainger, 1990) utilisent des donneurs de greffes dont les cellules sont marquées par un marqueur fluorescent non diffusible. Les greffes sont réalisées en enlevant l’ectoderme qui, in situ, donne la placode cristallinienne puis le cristallin, et en le remplaçant par de l’ectoderme provenant d’une autre région dont on teste la compétence à donner du cristallin. L’identification d’ébauche de cristallin se fait à l’aide d’anticorps dirigés contre les cristallines, protéines spécifiques et précoces du cristallin, identifiées par immunoélectrophorèse ou, sur coupes histologiques, par immunohistochimie.
• a) L’ectoderme céphalique à la périphérie de la plaque neurale est compétent pour se différencier en cristallin. Les greffes d’ectoderme ventral ne donnent jamais de cristallin.
• b) Cette compétence de l’ectoderme est acquise sous l’effet de premières inductions qui proviennent essentiellement de la plaque neurale céphalique (à un moindre degré, également de l’endoderme céphalique) et qui ont diffusé latéralement dans le plan de l’ectoderme pendant la gastrulation et la neurulation.
• c) Quand les vésicules optiques se forment, elles induisent, à elles seules de petites formations de cristallin ; si on fait l’ablation des vésicules, le cristallin ne se différencie pas.
• d) Le mésenchyme céphalique, combiné à du tissu neural augmente la capacité de l’ectoderme compétent à former un cristallin, mais, à lui seul, il n’est pas inducteur.
Il existe cependant, d’une espèce à l’autre, des variations de l’importance relative de ces différents inducteurs, ce qui contribue à la diversité des résultats.
3. Différenciation de la vésicule optique
La présence de mésenchyme céphalique et celle de l’ectoderme céphalique superficiel induit à former une placode cristallinienne sont nécessaires à la croissance de la vésicule optique et à sa différenciation. En leur absence, la vésicule ne forme qu’un épithélium pigmenté et ne se creuse pas en une cupule. Dans les conditions normales, le cristallin induit à se différencier par la vésicule optique rétroagit sur celle-ci en provoquant la différenciation du feuillet interne de la vésicule optique en rétine sensorielle : la différenciation se manifeste par un accroissement de l’activité mitotique dans la future rétine sensorielle qui a pu être détectée par histo-autoradiographie après injection de thymidine 3H. Le feuillet s’épaissit, les cellules filles migrent pour se placer à des niveaux qui correspondent aux différentes couches de la future rétine. La différenciation progressive qui suit s’achève par celle des cellules visuelles. Le feuillet épithélial externe de la cupule rétinienne se pigmente en présence du mésenchyme céphalique. Cette différenciation reste un certain temps labile. On peut en effet, expérimentalement, transplanter les deux couches de la cupule optique non différenciée au contact d’une vésicule cristallinienne, en les retournant, et inverser ainsi la destinée de chaque feuillet: ce qui devait devenir sensoriel devenant rétine pigmentée, et réciproquement. L’environnement tissulaire est donc fondamental dans l’orientation de la différenciation.
4. Différenciation de la cornée transparente
L’ectoderme situé au-dessus du cristallin devient la cornée transparente. Elle est formée de cellules transparentes avec des espaces interstitiels réduits.
Elle ne contient pas de cellule glandulaire. Le rayon de courbure de la cornée transparente est très précis. Il est plus tard doublé d’un mésenchyme sous épithélial et d’une trame régulière de collagène élaborée par des fibroblastes. Cette différenciation peut être provoquée sur n’importe quel épiderme compétent de neurula au contact d’un cristallin ou d’un fragment de rétine. L’induction doit alors être permanente pour maintenir la transparence; après ablation du cristallin, la cornée s’opacifie.
La sclérotique se différencie dans le mésenchyme autour de la cupule optique. De couleur blanche, elle réfléchit totalement la lumière. Riche en collagène et parfois en cartilage ou tissu osseux, elle est précocement déterminée mais on ne connaît pas son tissu inducteur.
Conclusion
Cet exemple, exposé ici de façon simplifiée, montre que, dans toute organogenèse, les interactions tissulaires ou inductions sont réciproques et se succèdent suivant un programme parfaitement réglé. Là aussi des anomalies dans le déroulement des inductions peuvent déclencher des malformations, comme la cyclopie ou l’anophtalmie.
Les interactions tissulaires sont tout à fait générales, on les a mises en évidence par exemple dans le cas de la formation du foie, du poumon, du rein, du pancréas, des dents, des plumes, etc. On y retrouve toujours une dualité épithélium et mésenchyme et le rôle de chacun d’eux a pu parfois être précisé en pratiquant des recombinaisons, en culture in vitro, entre épithélium d’une origine et mésenchyme de l’autre. Les résultats sont très variables suivant les protagonistes de l’association. Le mésenchyme joue le rôle inducteur dans la différenciation des plumes; c’est l’épithélium qui a de fortes capacités d’autodifférenciation dans le pancréas, avec un mésenchyme apparemment passif; les deux composants ont une influence égale dans la différenciation d’une dent. Ces quelques exemples montrent la grande délicatesse de l’équilibre qui aboutit à une différenciation.
L’œil fournit par ailleurs un excellent exemple pour étudier les effets de l’induction sur les synthèses d’ARN et de protéines spécifiques.