Sexualité - Reproduction.
Le Sommaire.
| Lignée germinale et Gamétogenèse. |
La Fécondation. |
La Parthénogenèse. |
Les déterminismes du sexe. |
|
I Introduction.
II Les cellules germinales et leur saga.
III La spermatogenèse.
IV L'ovogenèse.
V Annexes sur la lignée germinale.
|
Introduction.
I Les modalités de la fécondation.
II Mécanismes de la fécondation.
|
I Introduction.
II Parthénogenèse thélytoque ou constante.
III Parthénogenèse arrhénotoque (ou facultative).
IV La parthénogenèse cyclique.
V La paedogenèse.
VI La parthénogenèse naturelle chez les vertébrés.
|
I Historique.
II Déterminisme chromosomique du sexe.
III Rappels de la structure des chromosomes sexuels X et Y.
IV Compensation du dosage génique et empreinte génomique parentale (EGP).
V La détermination du sexe chez les mammifères.
|
Chapitre 1 :
Lignée germinale et Gamétogenèse.
I Introduction.
A Définitions.
Sexualité : mécanismes cellulaires de différenciation sexuelle.
Multiplication asexuée : formation de clones (par exemple, les bactéries).
Reproduction sexuée : gamètes mâle et femelle qui vont se recombiner.
Remarque : chez les bactéries, il existe une reproduction sexuée par envoi de l’épisome (une partie du génome) d’une bactérie HFr (ou mâle) dans une bactérie F- (ou femelle). Il y a recombinaison et formation d’un génome original.
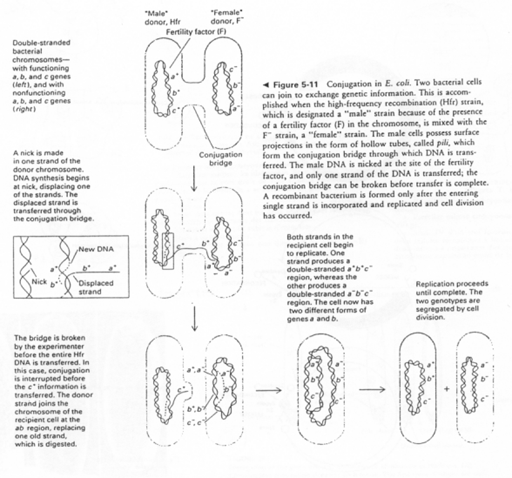
On voit les différents mécanismes permettant de faire passer (transmettre) des mutations à la descendance : c’est un facteur d’évolution de la reproduction sexuée.
B Sexualité, méiose et système reproducteur.
Pour les organismes supérieurs, il y a utilisation de la méiose afin de former des cellules haploïdes.
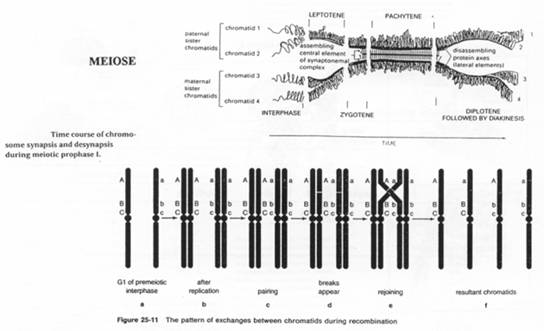
Le phénomène de crossing-over va intervenir dans la recombinaison. Il y a formation d’individus différents et aussi des combinaisons de mutations (Fav/Fav ou Défav/Défav en Fav/Défav).
Remarque : le problème de chromosomes supplémentaires concerne le phénomène de translocation.
La méiose est un phénomène nécessaire pour assure la diversité mais elle peut causer des problèmes.
Les complexes synaptonémaux : ce sont des appariements de chromosomes, base à base : cela forme très souvent des barrières entre les espèces.
Les cycles haplobiontiques, diplobiontiques et haplodiplobiontiques.
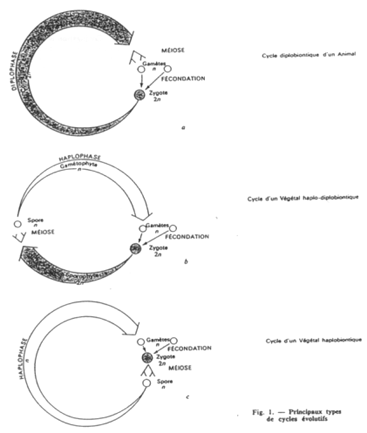
Les différences entre cycles proviennent de l’importance (de durée) des phases. On trouve des différences selon les espèces.
Les gamètes viennent de précurseurs diploïdes (les gonocytes primordiaux). Ceux-ci peuvent se localiser en différents endroits. Ces endroits peuvent être différents du lieu de différenciation.
Ces précurseurs germinaux primordiaux (formant une population cellulaire et non un tissu) se différencient pendant le développement embryonnaire précoce. Toujours durant le développement, ils migrent ensuite vers les ébauches des organes génitaux.
Une fois arrivés, les précurseurs germinaux primordiaux se multiplient par mitose et donneront des ovogonies/spermatogonies.
Cas de l’espèce Humaine : c’est une espèce anisogame à organismes gonochoriques.
Dans les ovaires, il y a croissance des gamètes (développement+croissance).
Pour les gamètes mâles, on ne retrouve presque plus de cytoplasme (pas de réserves). Il n’y a que les « outils » pour le déplacement et la pénétration des spermatozoïdes dans l’ovule.
Autres cas :
- Hermaphrodisme : il y a moins de dépenses énergétiques pour la reproduction grâce à l’autofécondation mais la fécondation croisée est souvent nécessaire.
- Parthénogenèse : on peut citer l’exemple des abeilles. Ici la fécondation par les spermatozoïdes n’est pas tout le temps obligatoire.
 La reproduction sexuée présente de nombreux avantages mais elle est biologiquement chère. Toutefois, la loterie génétique permet une adaptation rapide.
La reproduction sexuée présente de nombreux avantages mais elle est biologiquement chère. Toutefois, la loterie génétique permet une adaptation rapide.
II Les cellules germinales et leur saga.
A Introduction.
Les gamètes haploïdes sont produits à partir de gonocytes primordiaux (qui sont différents des cellules somatiques).
Dans le cytoplasme de ces cellules, il existe une coloration différente, mais l’on retrouve aussi : plus de mitochondries et de granules ribo-nucléo-protéiques. Un granule ribo-nucléo-protéique est la phosphatase alcaline.
Les gonocytes présentent une taille importante. Ils se divisent peu pendant la gastrulation (ils ne forment pas de tissu).
Une fois qu’ils ont migré, les gonocytes vont former les gonades : les cellules sont attirées par chimiotactisme par les crêtes génitales et y subiront une différenciation:
- Prolifération (pour atteindre la masse critique),
- Réalisation de la méiose (ce sont els seules cellules à pratiquer ce type de division).
Les gonocytes primordiaux sont immortels : ils ne peuvent pas subir la mort par sénescence. Ils possèdent des télomérases qui compensent la dégradation des télomères.
Remarque : on retrouve ces télomérases dans les cellules embryonnaires, durant le développement embryonnaire.
B Ségrégation Soma/Germen.
Cas du nématode : Parascaris equorum.
Dès le stade 2 cellules, on peut distinguer deux lignées (une somatique / une germinale).
Les déterminants maternels sont primordiaux pour cette différenciation.
Cas de la souris, mammifère.
Jusqu’au stade morula, toutes les cellules peuvent avoir tous les devenirs. Il y a des besoins d’interaction cellulaire pour le développement des lignées.
Les premières cellules de la lignée germinale apparaissent à 7,5 jours.
Cas de « Dolly », clone de mammifère.
Il y a formation de cellules germinales à partir de cellules somatiques.
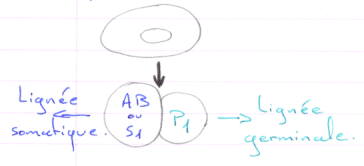
Cas d’Ascaris.
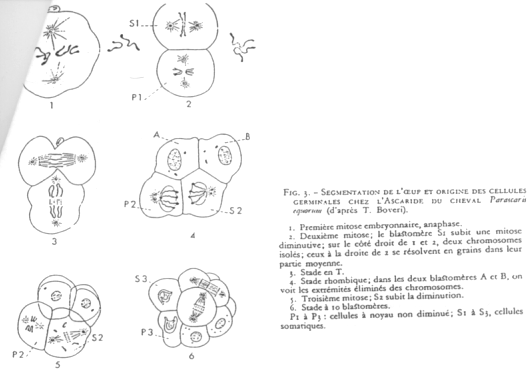
En 1 : le zygote. En 2 : 1er clivage horizontal.
La cellule S1 voit ses chromosomes qui subissent une diminution chromosomique.
S1  A-B par clivage vertical (chromosomes diminués)
A-B par clivage vertical (chromosomes diminués)
P1  P2+S2 (S2 verra son noyau diminuer). Les cellules Px héritent de la partie végétative.
P2+S2 (S2 verra son noyau diminuer). Les cellules Px héritent de la partie végétative.
On a un lignage Px où le noyau est entier. Les autres lignées ont un noyau diminué.
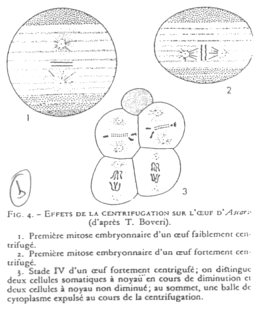
On centrifuge des œufs d’Ascaris. On change ainsi l’axe du fuseau de division et les deux cellules ont leur noyau préservé.
Il y a une détermination germinale par le cytoplasme avec les déterminants végétatifs.
Le « plasme germinal » est ce qui permet de donner la différenciation de la lignée germinale.
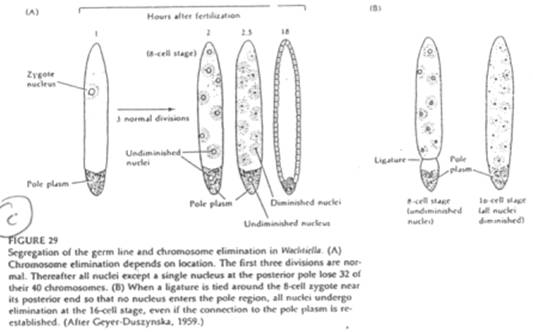
Cas de Wachtiella.
Le développement de cet animal est comparable à celui de la drosophile. On trouve ici un plasme polaire avec de nombreuses mitochondries et de nombreux granules.
Les noyaux du plasme postérieur sont protégés de la diminution chromosomique.
Cas de la Drosophile.
Ici, il n’y a pas de diminution chromosomique mais le plasme germinal postérieur existe toujours. C’est aussi le cytoplasme qui permet la différenciation de la lignée germinale.
Cas des Amphibiens.
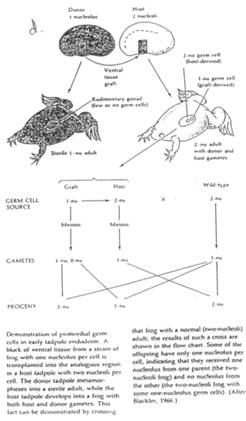
La zone végétative, ventrale, contient les cellules de la lignée germinale. Si l’on irradie cette zone germinative de la blastula, on obtiendra des individus stériles.
C Plasme germinal et déterminants germinaux.
Les cellules germinales sont souvent associées aux tissus endodermiques, indispensables à la formation des cellules polaires (germinales primordiales).
Pendant l’ovogenèse, chez la Drosophile, il y a différenciation du cytoplasme postérieur par stockage de Granules ribo-nucléo-protéiques.
On voit l’intervention de microtubules pour réaliser le déplacement des granules et des ARNm.
- La Kinésine permet un déplacement vers le pôle + ;
- La Dynéine permet un déplacement vers le pôle -.
Le messager Oskar est transcrit dans les cellules nourricières. Il va se localiser dans la partie postérieure. Il s’ancre ensuite dans le cytosquelette cortical d’actine grâce à la protéine Vasa.
Oskar et Vasa forment les premiers granules ribo-nucléo-protéiques.
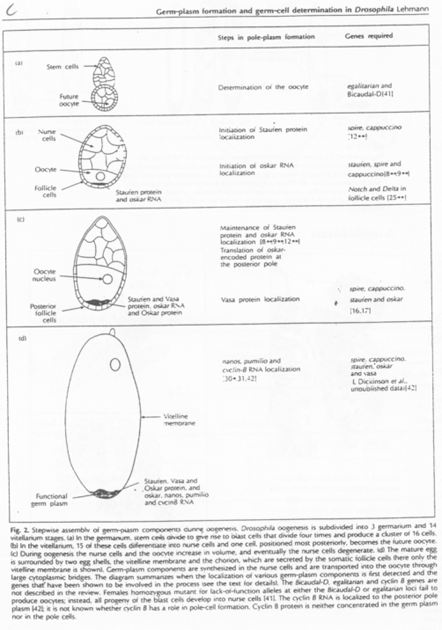
D’autres messagers comme Valois, Tudor, vont constituer les autres molécules qui interviendront dans cette différenciation.
Quand les cellules nourricières se déversent dans l’ovocyte, Nanos et Germ-cell-less y sont également propulsés. Ils vont migrer sur des microtubules vers la partie postérieure. Ils finissent par s’y ancrer grâce aux molécules déjà présentes.
Il y a ensuite ponte puis fécondation…
Si l’on irradie la partie postérieure du zygote juste pondu, il y aura stérilité par dégradation des ARNm. Si à la même place, on injecte Germ-cell-less, on récupèrera un peu de cellules germinales.
Ces cellules possèdent de nombreuses mitochondries. Des ARN mitochondriaux sont produits, dont le Mt-L-rRNA (Mitochondrie Large ARNr) qui est très majoritairement associé aux cellules polaires.
L’injection de Mt-L-rRNA dans le plasme germinal va entraîner la formation de cellules polaires, mais pas de cellules germinales.
Mt-L-rRNA intervient dans la ségrégation cellulaire.
Les Mt-L-rRNA s’associent avec un MTOC (centre organisateur des microtubules) et donnent un côté qui va suivre la voie germinale (l’autre coté, non) avec une division asymétrique.
Chez les amphibiens, la ségrégation est asymétrique pendant le début des divisions (de 8 à 64 blastomères). Les cellules germinales récupèrent des fragments de cytoplasmes spécifiques.
D Migration des cellules germinales.
Pendant l’ovogenèse, les ARNm se stockent dans la partie végétative avec les mitochondries.
Il va ensuite y avoir divisions puis migration vers les gonades.
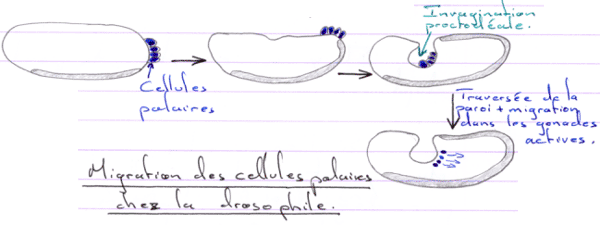
La migration est un mécanisme passif, sauf pour la sortie où le phénomène est actif. Les gonades en développement synthétisent des substances chimiotactiques.
Cas des Amphibiens.
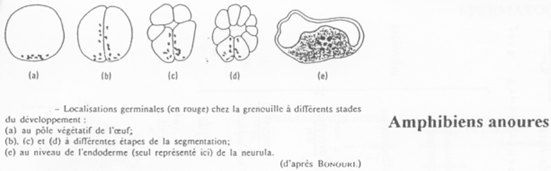
On retrouve ici des granules ribo-nucléo-protéiques mais aussi des équivalents de Vasa (et également chez les mammifères). Quand la gastrulation commence, les cellules germinales se divisent peu et se mettent à migrer.

Cas des Oiseaux.
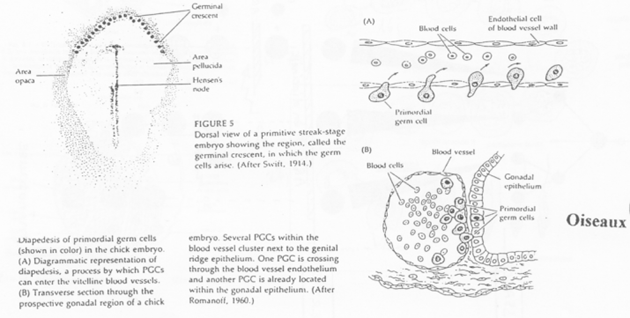
Au niveau des îlots sanguins, on note la présence d’hémangioblastes formant un appareil circulatoire.
Le croissant germinal contient les cellules primordiales germinales.
Ces cellules primordiales germinales entrent dans les vaisseaux en cours de formation et sortiront par diapédèse. Un chimiotactisme est exercé par les gonades.
Cas des Mammifères.
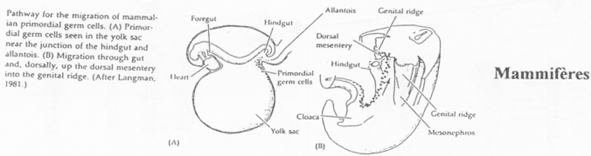
Chez la souris, les cellules primordiales germinales apparaissent tardivement (vers 7 jours et demi). Elles vont synthétiser des molécules semblables aux déterminants maternels de la drosophile.
L’endoblaste envoie des signaux vers l’épiblaste (BMP2, BMP4) qui vont modifier les cellules qui les captent (les cellules primordiales germinales).
Ces cellules primordiales germinales vont se rassembler au niveau de l’allantoïde, passer dans le tube digestif, remonter celui-ci pour atteindre les crêtes génitales.
Les restes des extensions cytoplasmiques des premières cellules primordiales germinales servent de « fil d’Ariane », de route, pour les cellules primordiales germinales suivantes.
Au cours de la migration des cellules primordiales germinales, ces cellules vont se diviser car elles sont déterminées. Leur prolifération sera forte dans les gonades. Elles pourront subir la dégénérescence puis l’apoptose.
Chez le mâle, 70% des cellules germinales disparaissent par apoptose. Elles reprendront leur développement à la puberté.
Chez la femelle, 30% de ces cellules disparaissent. Leur diminution continuera au cours du temps.
E Différenciation des cellules germinales / Aspects généraux de la gamétogenèse.
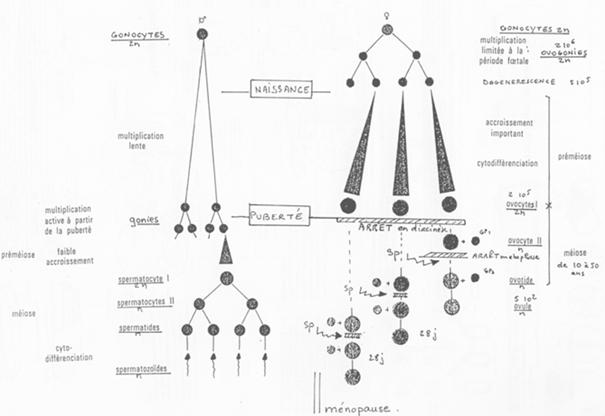
La spermatogenèse est un phénomène continu. L’ovogenèse voit son déroulement interrompu (phénomène discontinu).
La différenciation des cellules germinales fait appel à un processus complexe.
La comparaison des deux mécanisme (spermatogenèse et ovogenèse) se fait selon :
- Le phénomène continu ou discontinu ;
- La taille et la mobilité des cellules ;
- La période de cytodifférenciation.
La cytodifférenciation se déroule avant la méiose dans les cellules germinales femelle et après la méiose dans le cas des cellules germinales mâles.
Les points communs aux deux mécanismes sont :
- La régulation par l’axe hypothalamo-hypophysaire;
- Les facteurs moléculaires impliqués et les cellules mises en jeu (quasi identiques).
III La spermatogenèse.
A Description du testicule.
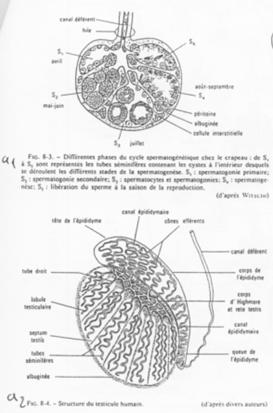
En a1, on voit l’organisation d’un testicule d’amphibien. En a2, on se trouve dans le cas de l’Homme, mammifère.
Dans ce dernier cas, le testicule est constitué de lobules séparés les uns des autres par des septa testis.
Dans chaque lobule, les tubes séminifères sont serrés, denses.
La zone de production des spermatozoïdes est coiffée par l’épididyme.
Le tissu conjonctif du testicule regroupe les cellules de Leydig.
Le testicule est un organe endocrine et exocrine gamétogène.

Dans l’épididyme, les spermatozoïdes seront modifiés pour devenir efficaces. Ils vont ensuite être stockés dans la partie large du canal déférent.
Chez les amphibiens mâles, dans chaque cyste, toutes les cellules sont au même stade de développement. Les stades dépendent des saisons.
B Cinétique de la spermatogenèse.
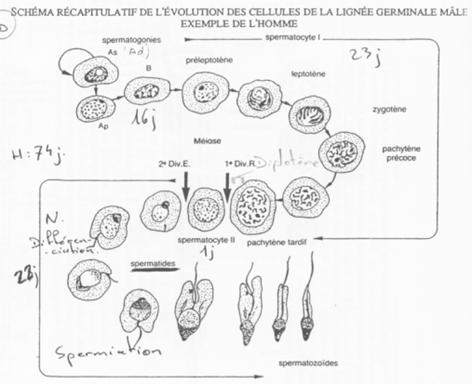
Les spermatogonies (2N) sont en nombre faible. Elles vont se diviser asymétriquement et donner :
- Des spermatogonies souches (Ad)
- Des spermatogonies qui évolueront en spermatozoïdes (Ap).
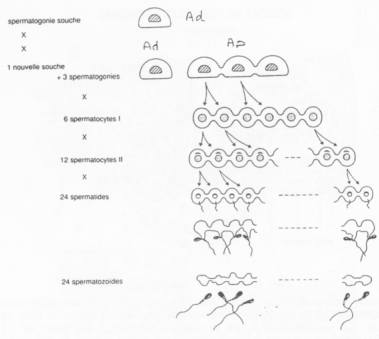
La cytodiérèse des cellules Ap est incomplète : les cellules sont reliées par des ponts cytoplasmiques.
Le stade pachytène.
La cellule B donne des spermatocytes 1 qui vont entrer en méiose (prophase I).
Il va y avoir appariement des bivalents grâce à des complexes synaptonémaux chez les espèces qui les possèdent.
On aperçoit une vésicule germinative ; les chromosomes X et Y (deux par paires) vont se condenser afin d’éviter une recombinaison accidentelle.
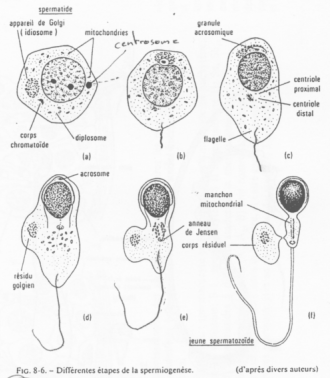
On peut observer de nombreuses mitochondries périphériques (autour du flagelle).
En a et b, on trouve, à l’opposé du flagelle, l’idiosome (le Golgi). Le centrosome est du côté du flagelle. Le Golgi permet la production des vésicules pro-acrosomiques.
En c, c’est la phase de « Cap » : fusion des granules pro-acrosomiques en une seule. On obtient une grosse vésicule qui vient se coller au noyau et modifier l’enveloppe nucléaire qui est à son contact.
En d, cette coiffe s’étend et recouvre encore plus le noyau. Ce dernier va être modifié.
La polarisation est maintenant poussée. Le noyau se colle contre l’acrosome ; le flagelle pousse ; le cytoplasme se réduit ; les mitochondries se rassemblent autour du flagelle.
En e, f, le cytoplasme va être éliminé.
On observe un « manteau » de mitochondries autour du flagelle.
L’acrosome :
Il contient des granules pro-acrosomiales qui renferment des enzymes permettant la lyse de multiples objets (action protéolytique, de dégradation).
Le noyau du spermatozoïde :
Il est hyper condensé, de structure presque cristalline. Cette modification de condensation vient du remplacement d’histones par des protamines.
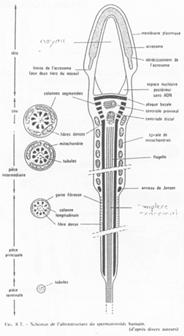
Fonctionnement du flagelle.
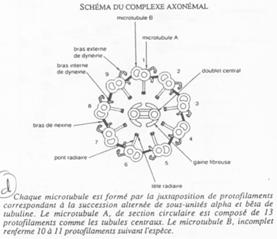
On trouve 9 doublets de microtubules AB :
- 13 protofilaments A ;
- 10 protofilaments B ;
- Un doublet central (2x10).
Un bras de nexine permet de relier les doublets entre eux. Un pont radiaire vient, lui, mettre en relation les doublets externes au doublet central.
La dynéine vient donner le mouvement au flagelle (Cf. BGU10).
Etude de tubes séminifères.
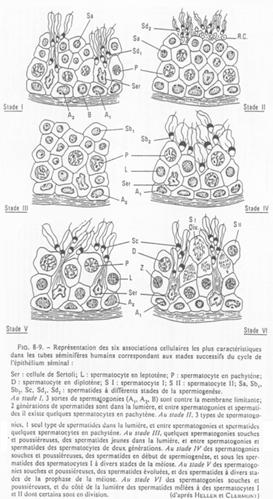
Les différents stades s’organisent selon 6 combinaisons. Tous les 16 jours, une spermatogonie s’engage dans la différenciation.
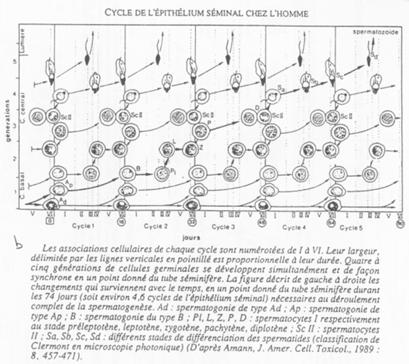
On peut donc définir une onde spermatique avec 6 combinaisons cellulaires possibles.
C Expression génique au cours de la spermatogenèse.
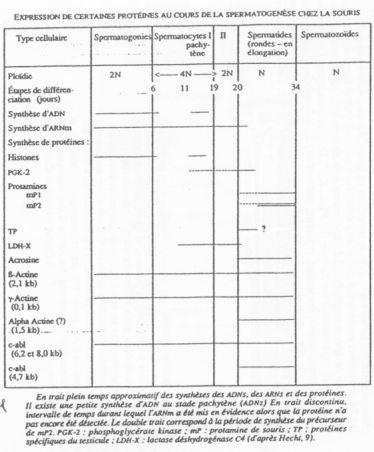
Il y a expression typique de molécules à des moments donnés, nécessaires.
On retrouve l’existence d’isoformes d’enzymes de cellules somatiques.

Il y a existence de gènes tissus-spécifiques ainsi que d’isoformes selon le groupe de cellules germinales/de cellules somatiques.
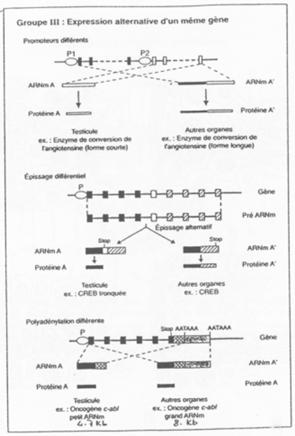
Il y a expression alternative d’un même gène.
D Contrôle de la fonction testiculaire : cellule de Leydig et de Sertoli / Maturation des spermatozoïdes.
Les cellules de Sertoli sont au milieu des cellules germinales en cours de différenciation.
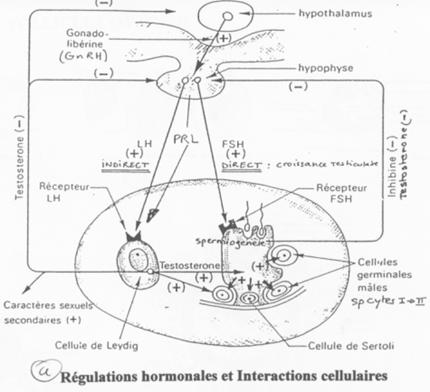
L’action de la FSH est de provoquer une stimulation du testicule en ciblant des récepteurs à 7 segments transmembranaires.
L’action de la LH est d’être captée par les cellules de Leydig et de provoquer alors l’activation de l’Adenylyl cyclase (et donc la synthèse d’AMPc).
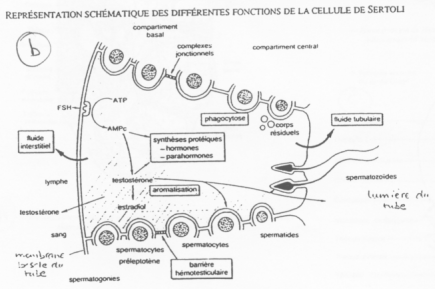
Les cellules de Sertoli créent des compartiments où la spermatogenèse se produit.
Entre deux spermatogonies, il y a formation d’une barrière hémato-testiculaire grâce à des jonctions étanches.
La barrière s’ouvre pour laisser entrer les spermatogonies. Le passage de la barrière se fait quand la méiose débute (réplication de l’ADN). Du côté du sang, on trouve des cellules à 2N alors que du côté du testicule, on trouve des cellules à N. Les cellules de Sertoli régulent la spermatogenèse et les spermatogonies renvoient le message aux cellules de Sertoli.
Cellules de Leydig ó Cellules de Sertoli ó Cellules Germinales.
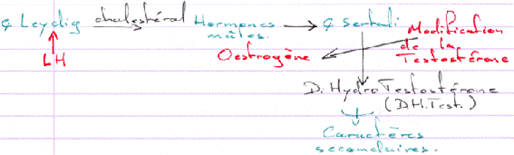
Les facteurs produits par les cellules de Sertoli vont activer les spermatogonies mais aussi aller réguler le reste du contrôle de différenciation.
La dH-Testostérone a un rôle dans la différenciation de l’épipidyme.
L’Hormone Anti-Mullerienne, de la famille TGFβ, sert à la mise en place des organes mâles.
IV L’ovogenèse.
L’ovogenèse est un processus discontinu.
Dans les gonades, les ovogonies vont se multiplier. Elles vont entrer en phase d’accroissement de taille (préméiose) ou phase de cytodifférenciation.
Il y a ensuite un blocage. Le développement reprend à la puberté où l’on a maturation d’un ovocyte tous les 28 jours puis ovulation. L’ovule libéré est bloqué en ovocyte 2 (métaphase 2).
A Ovaire et follicule ; contrôle hormonal de l’ovogenèse.
Représentation théorique d’un ovaire de mammifère.
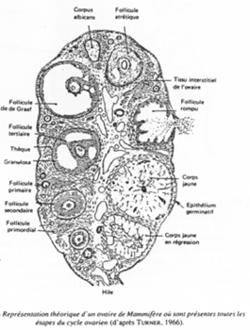
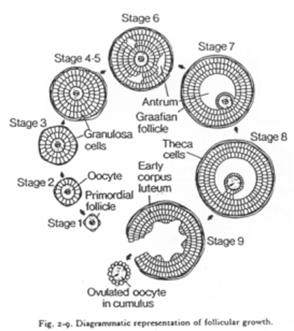
C’est un organe complexe où les ovocytes s’organisent en follicules primordiaux accompagnés d’une sorte de « cocon ».
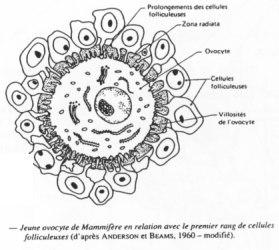
Un follicule primordial = ovocyte + cellules folliculaires.
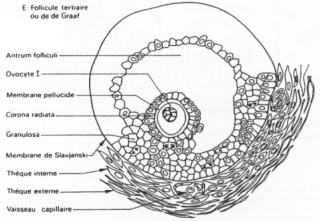
Un follicule de « De Graaf ».>
Ici, l’ovocyte est entouré par les cellules de la granulosa. La membrane basale est appelée membrane de Slajvanski. Le tissu conjonctif est irrigué et forme deux ensembles : la thèque interne et la thèque interne.
L’ovocyte repose sur l’atrium folliculi.
Les cellules qui accompagnent l’ovocyte lui permettent d’avoir un développement correct.
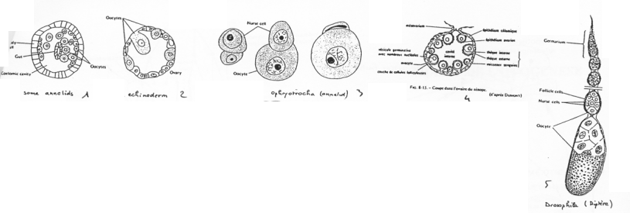
En 1, on a la forme simple. L’ovocyte est produit par délamination dans le coelome.
En 2, un échinoderme. Un ovaire est mis en place mais il reste simple.
En 3, l’ovocyte est associé à une cellule nourricière.
En 4, on est chez l’amphibien. On trouve un organe particulier. On distingue des ovocytes entourés par une couche de cellules folliculaires, d’une thèque et de la granulosa. Il y a multiplication du stock d’ovocytes pour chaque saison de ponte.
En 5, l’ovariole de drosophile. L’ovariole est constituée des chambres ovariennes et du germarium. An final, dans une chambre, on trouve 15 cellules nourricières et l’ovocyte (1 cellule).
Le contrôle hormonal.
Le contrôle hypothalamo-hypophysaire.
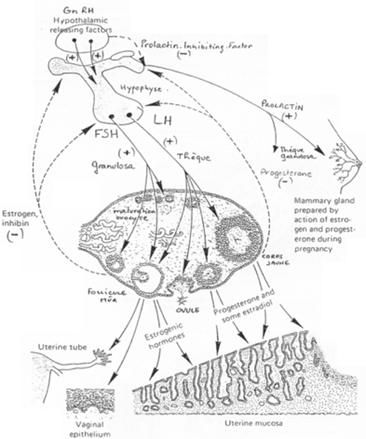
L’hypothalamus libère le GnRH (neurotransmetteur) sur l’hypophyse (antérieure). Il y a alors libération de FSH et de LH. Ces deux hormones vont se fixer sur des récepteurs à 7 segments transmembranaires et provoquer la formation d’AMPc.
- La FSH agit sur la granulosa (« l’épithélium »).
- La LH voit son action sur les cellules de la thèque.
Les oestrogènes sont libérés partiellement vers le liquide antrique mais vont également exercer un rétrocontrôle sur l’adénohypophyse.
Il y a, par le rétrocontrôle, inhibition de FSH et activation ou inhibition de LH selon la concentration (pour une concentration inférieure à 200ρg/mL de LH, on a inhibition et pour une concentration supérieure, on aura une activation).
L’ovocyte présente de nombreux récepteurs aux hormones et aux facteurs de croissance.
B Les grandes phases de l’ovogenèse.
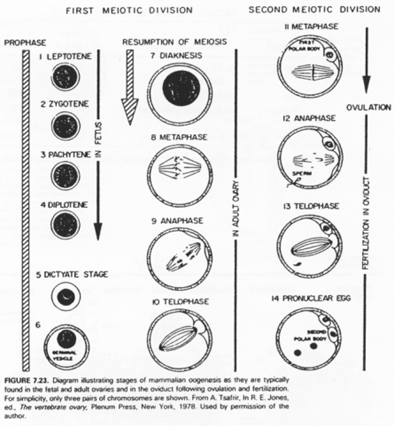
Les cellules germinales sont immortelles par sénescence mais peuvent subir l’apoptose (ce qui permet de réguler leur nombre).

On compare la multiplication cellulaire et l’apoptose chez trois espèces différentes.
Quand un follicule s’engage dans la croissance, un certain nombre de ses semblables va dégénérer (compétition pour poursuivre leur développement) : c’est l’atrésie.
Cette atrésie est une sélection par dominance d’un ovocyte. Le nombre d’ovocytes arrivant finalement en activité (sur une vie) est faible.
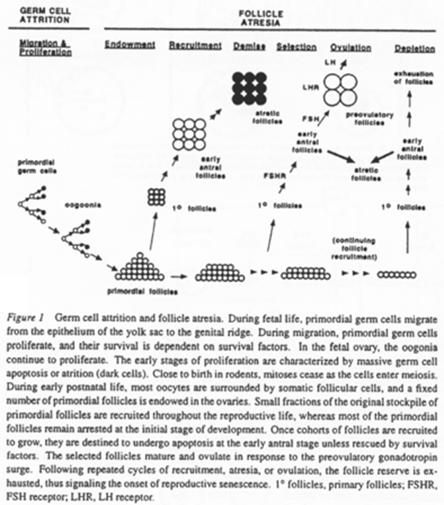
A chaque étape, on note une perte de follicules.
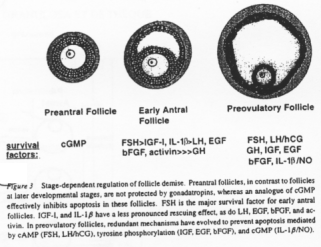
Différents facteurs interviennent pour empêcher les follicules d’entrer en apoptose. Ils peuvent varier selon le stade de développement de l’ovocyte :
- GMPc,
- FSH, LH, IGF1, EGF, FGF…
C Phase d’accroissement / de cytodifférenciation.
L’entrée en prophase méiotique marque le début du déroulement de la phase de croissance.

Il y a un blocage au stade diplotène chez les amphibiens grâce à une grosse accumulation de molécules.
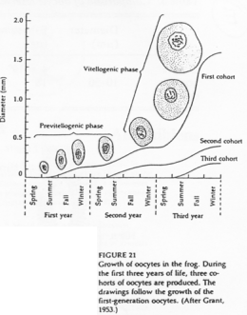
On distingue deux phases : le petit et le grand accroissement. Cette croissance se fait sur trois ans chez Rana pipiens. Deux ans puis un an. On passe, pour l’ovocyte, de 150µm à 1.5mm.
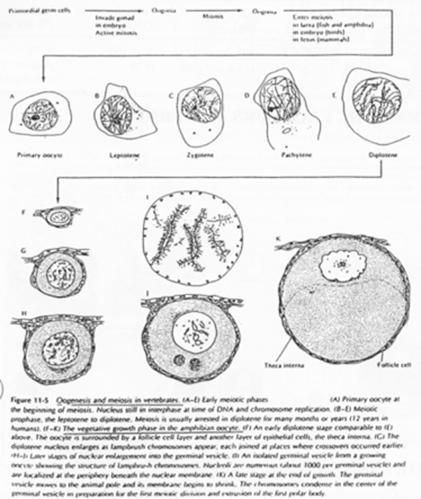
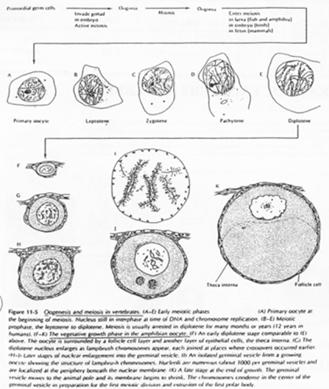
La phase leptotène correspond à la réplication des chromosomes.
La phase Pachytène : noyau diploïde avec des chromosomes étant ancrés sur l’enveloppe nucléaire, au pôle du noyau.
La phase Diplotène correspond à la phase de fort grossissement.
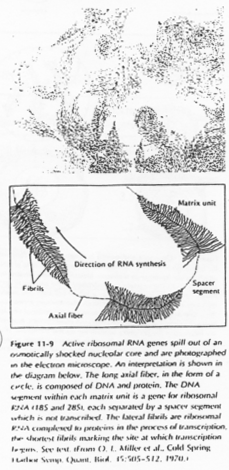
L’ovocyte 1 montre un noyau à organisation particulière avec des petites tâches (les nucléoles). La chromatine des divalents prend une forme en écouvillon (= lampbrush). Les micro-nucléoles servent à l’amplification de l’ARNr.
Dans l’espèce Humaine.
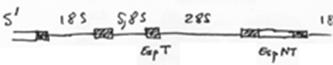
Chez les amphibiens, on trouve environ 300 cistrons chromosomiques. L’amplification (production d’ARN) se fait par rolling circle.
Il y a une production « industrielle » d’ARNr qui sera stockés dans l’ovocyte.
Remarque : Les ARN 5s ne sont pas amplifiés mais ils ont une très bonne efficacité de transcription.
Chez l’Homme, il n’y a pas d’amplification mais les nombreux cistrons existant seront tous utilisés (transcrits), ce qui permet le stockage d’ARN.
Les boucles observées sur l’ADN sont des zones de fortes transcriptions : une importante quantité d’ARN est produite. Ces ARN vont passer dans le cytoplasme pour y être stockés ou bien traduits en protéines qui, elles, seront stockées.
La production d’histones est également très importante.
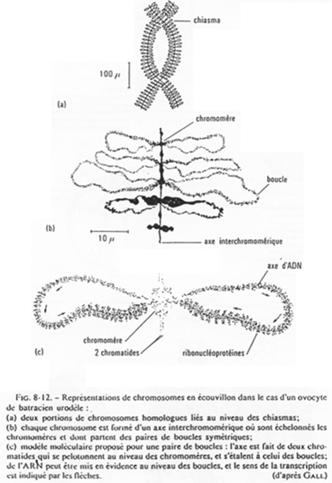
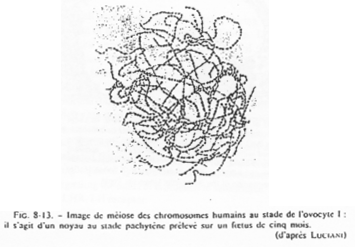
Chez la femme, les chromosomes d’ovocytes n’ont pas la même forme que les chromosomes de cellules somatiques.
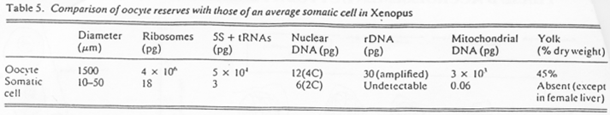
Comparaison des contenus de cellules somatiques avec le contenu de cellules ovocytaires, entre espèces.
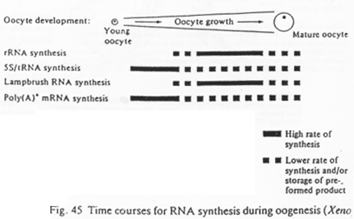
Répartition temporelle de la production de différents d’ARN.
La phase de gros accroissement.
Il y a accumulation du contenu ovocytaire. La majeure partie des molécules nutritives sont produites par le foie maternel et forme le vitellus.
Des oestrogènes de rétrocontrôle sont captés par le foie et déclenchent la production de vitellogénine. Cette molécule est un dimère de 470kDa codé par un ARN unique. Elle entre dans l’ovocyte par micro-pinocytose en lipovitelline et phosphvitine.
Ces deux molécules s’amalgament en plaquettes vitellines. Le vitellus contient des lipides, des protides et des glucides.
Remarques :
- Chez la drosophile, la vitellogénine est à peu près identique et est produite par le « corps gras ».
- Chez les mammifères, il y a un blocage au stade « diplotène avancé ».
- La puberté correspond au relancement de la méiose avec la phase de « gros accroissement » (diacynèse).
- La division méiotique est asymétrique.
L’asymétrie de l’œuf.
Pour les amphibiens, l’œuf est anisotrope. Sous la membrane plasmique, on trouve les pigments corticaux qui marquent la partie animale. Les plaquettes vitellines sont principalement retrouvées dans la partie végétative. Les ARN sont plus retrouvés dans le pôle animal mais sont quand même bien présents dans la partie végétative.
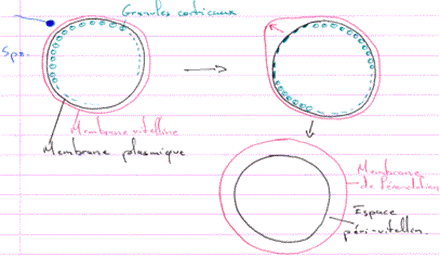
L’espace périvitellin est occupé par les pieds des cellules folliculaires et des microvillosités de l’ovocyte. Des granules corticaux vont aussi se disposer en périphérie de l’œuf.

Chez la drosophile, une cellule polaire va donner les cystoblastes, des cellules souches pour l’ovogenèse.
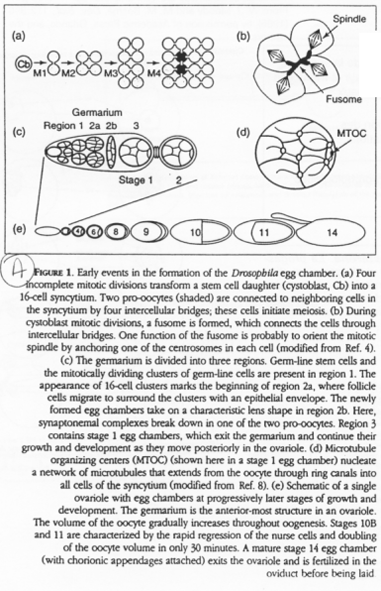
Les cystoblastes (ou cystocytes) se multiplient et donnent 16 cellules (15 cellules nourricières et un ovocyte) qui seront reliés par des ponts cytoplasmiques. Ce réseau ainsi formé par les ponts cytoplasmiques est appelé le « fusome ».
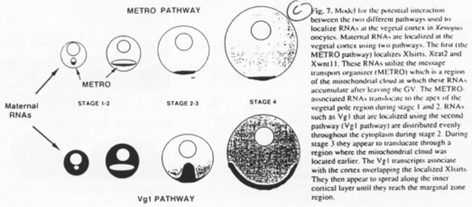
Les messagers migrent sur les microtubules :

La région 3’UTR permet l’adressage en interagissant avec soir la dynéine (vers le pôle -) soit avec la kinésine (vers le pôle +).
Le cas des amphibiens.
On trouve un phénomène comparable à celui de la drosophile.
Les divisions goniales donnent des cystoblastes qui subissent 4 divisions incomplètes : on a 16 cellules accrochées : un cyte.

Le stade diplotène.
Le noyau est central, les chromosomes décondensés. Le centrosome et les mitochondries forment le corps de Baldiani.
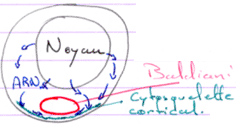
Les ARN produits par le noyau vont, au niveau du corps de Baldiani, se retrouver piégés dans le cytosquelette cortical.
La seconde phase d’accroissement.
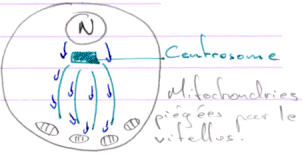
Les ARN sont localisés par les microtubules en fonctions des régions 3’UTR.
Les mitochondries vont être utilisées pour la formation du plasme germinal : elles sont un déterminant de la lignée germinale.
Remarque : chez la souris, il y a également formation d’un cyste à 16 cellules.
La méiose est asymétrique dans l’ovocyte : elle donne l’ovocyte 2 (de très grande taille) et le globule polaire (minuscule).
D Blocage et reprise de la méiose.
Chez la femelle, ce processus est lent (un an environ). Il y a besoin de l’association ovocyte + follicule. Au début, on a le blocage en prophase 1. L’ovocyte n’a subit que le petit accroissement.
Chez les mammifères, le fort accroissement est faible.
- La phase pré-antrique dure environ 300 jours.
- La phase antrique dure environ 65 jours.
La phase pré-antrique.
Cette phase n’est pas sous contrôle de la FSH ni de la LH (des hormones hypothalamo-hypophysaires). En réalité, l’ovocyte prépare les cellules folliculaires à répondre aux hormones hypothalamo-hypophysaires. Deux molécules sont importantes dans cette phase : GDF9 et BMP15, toutes deux de la famille TGFβ.
Les cellules folliculaires vont grossir, se multiplier (les cellules de la granulosa) : c’est la folliculogenèse. Une fois ces cellules en nombre suffisant, il va y avoir creusement de l’antrum.
La phase antrique.
Cette phase est sous contrôle de la FSH et de la LH.
A ce moment, la prolifération cellulaire continue encore.
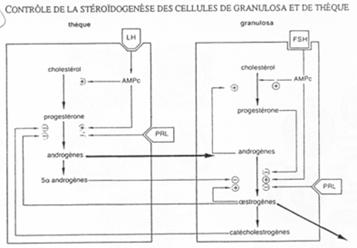
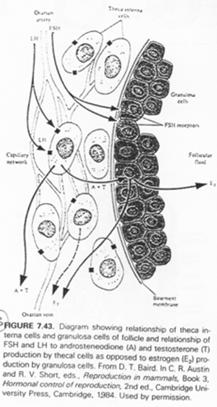
La LH agit sur les cellules de la thèque en induisant la synthèse d’hormones mâles, qui, dans la granulosa, seront aromatisées en hormones femelles (oestrogènes).
La FSH agit sur :
- Les cellules de la corona radiata en provoquant leur multiplication et l’apparition à leur surface de récepteurs ;
- Les cellules de la granulosa ; il y a induction de l’apparition de récepteurs à LH et augmentation des récepteurs à FSH ;
- De nombreux ovocytes en initiant leur développement.
Sur l’ensemble des ovocytes qui se lancent dans la maturation, il va y avoir :
- Recrutement d’ovocytes et de leur follicule ;
- Sélection de l’ovocyte ;
- Dominance d’un ovocyte sur les autres ;
- Atrophie des ovocytes dominés : il n’en reste qu’un qui pourra suivre sa maturation.
Le rétrocontrôle de FSH agit par :
- Une diminution de la production de FSH (sur l’hypophyse) ;
- Une diminution de la quantité de FSH produite pour de plus en plus de récepteurs à FSH;
- Le manque de FSH pour tous les follicules : un seul arrive à capter assez de FSH. Ce follicule domine les autres. Les follicules dominés entrent en atrésie.
Le pic de LH, capté par les cellules de la thèque et de la granulosa va provoquer des modifications des relations entre ces cellules et l’ovocyte.
On passe maintenant à la phase de diacynèse.
Pincus a enlevé toutes les cellules folliculaires autour d’un ovocyte, ce qui a provoqué son entrée en méiose.
Chez les mammifères, les cellules folliculaires bloquent le développement de l’ovocyte.
Chez les amphibiens, cette inhibition folliculaire n’est pas observée.
La zone pellucide sépare les cellules folliculaires de l’ovocyte. Des « pieds » relient ces deux types cellulaires et forment des jonctions communicantes limitant le passage à des molécules de PM inférieur à 1kDa.
Le pic de LH provoque la libération d’acide hyaluronique par les cellules de la granulosa mais aussi la rupture des jonctions communicantes entre ces cellules et l’ovocyte.
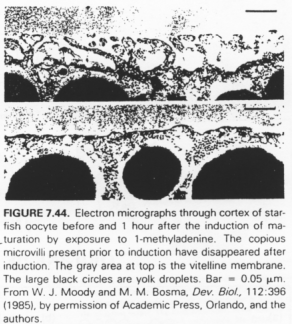
Il y a un changement de morphologie après le pic de LH.
OMI (Oocyte Maturating Factor).
L’OMI est caractérisé par :
- De petits peptides à rôle inhibiteur mais pas total ;
- De l’hypoxanthine (acide nucléique) dont le rôle est important par action inhibitrice de l’AMPc phosphodiestérase (qui dégrade l’AMPc).
L’AMPc est synthétisé dans les cellules folliculaires vers l’ovocyte et joue un rôle dans le blocage de la maturation.
Il y a également des signaux qui sont envoyés de la granulosa vers l’ovocyte pour lui faire produire de l’AMPc.
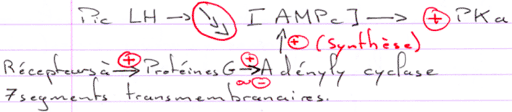

Le MPF intervient également sur la maturation de l’ovocyte et sur sa transition G2/M.
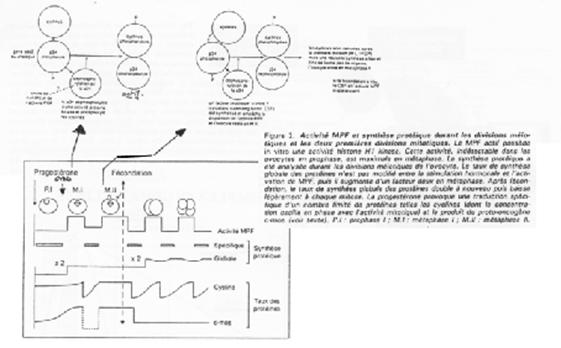
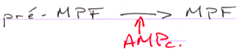
Le MPF est constitué de deux sous unités :
- p34cdc2 (Histone H1 kinase) et
- cycline B.
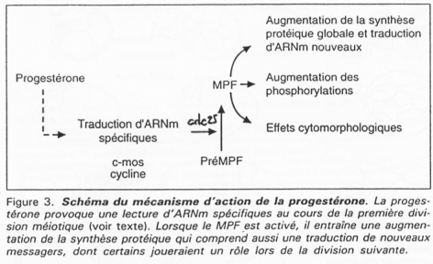
P34cdc2 est déphosphoration par cdc25, ce qui active le MPF.
Les cibles/effets de p34cdc2 sont :
- Le noyau qui se décondense ;
- La rupture de la vésicule germinative par modification des lamines (PAGE 20. C) ;
- La condensation par phosphorylation de l’histone H1 ;
- L’activation des microtubules pour la formation du fuseau de microtubules.
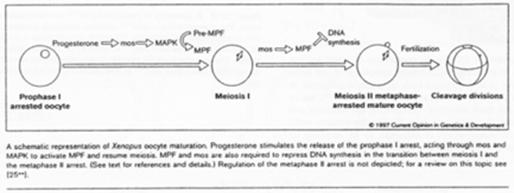
Chez les amphibiens, la maturation de l’ovocyte est différente.
Le déblocage nécessite le signal progestérone. Pour l’ovocyte, le récepteur à cette hormone est transmembranaire alors que normalement, les hormones stéroïdes ont un récepteur nucléaire.
La progestérone va activer c-mos (une kinase) qui va lancer la voie des Map-Kinases.
Chez la souris femelle, c-mos est déjà présent ; il n’y a pas besoin de le traduire.
La fin de la 1ère division se déroule ; il y a dégradation des cyclines ; une mini interphase de déroule ; la seconde division de méiose débute et se bloque en métaphase 2 ; le MPF reste actif.
C-mos = CSF (CytoStatic Factor).
C-mos entraîne la non dégradation des cyclines : le MPF reste actif et bloque en métaphase 2.
La fécondation.
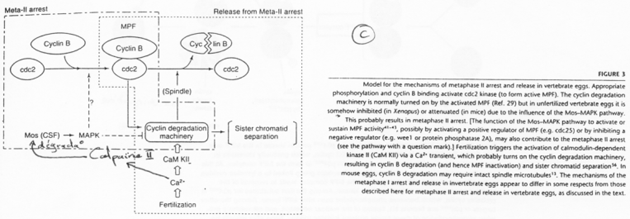
Les spermatozoïdes arrivent à la zone pellucide. Il y a entrée de l’un d’eux et activation de l’ovocyte. Cette activation provoque l’apparition d’une vague calcique (par PiP2). Celle-ci aboutit à la dégradation des cyclines par la dégradation de c-mos et à son action sur les cyclines.
C-mos est un garde-fou contre la parthénogenèse.
Quand les cellules de la granulosa reçoivent le pic de LH, elles vont synthétiser de l’acide hyaluronique (un carbo-hydrate) qui sera stocké dans l’antrum : il va y avoir gonflement de la cavité :
- Perte du contact entre les cellules du follicule et l’ovocyte ;
- Rupture du cumulus oophorus.
La rupture du follicule libère l’ovocyte.
E L’ovulation.

La synthèse de prostaglandines va déclencher sur les cellules de la granulosa stimulées, la production de métalloprotéines (des MMP) qui vont dégrader la lame basale du follicule.
Il y a une explosion folliculaire et donc, ponte ovulaire.
Remarque : avec l’ovocyte, il reste des cellules de la corona radiata.
Une fois libre, l’ovocyte se met à arborer des récepteurs à la LH.
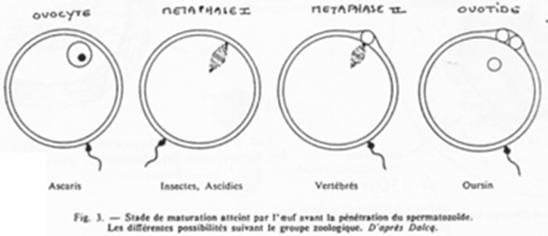
Les différents moments de fécondation en fonction du groupe zoologique.
Remarque sur les différents types d’œufs et leurs membranes protectrices.

Tableau de définitions.
Le chorion :
- Chez les amphibiens, c’est la membrane vitelline ;
- Chez la drosophile, on parle de coquille ;
- Chez les mammifères, c’est le trophectoderme.
Les membranes peuvent conditionner le développement.
V Annexes sur la lignée germinale.

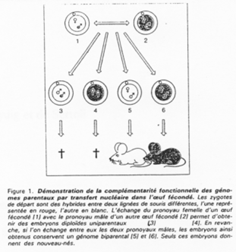
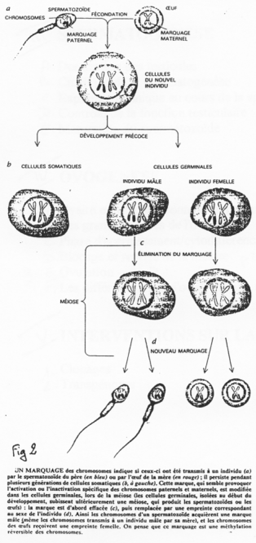
La création expérimentale d’un embryon avec deux pronucléi maternels ou deux paternels va toujours mourir. Ceci est du à l’empreinte génomique parentale.
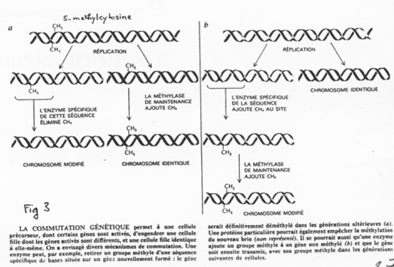
Chez l’Homme on trouve environ 10 zones soumises à cette empreinte. C’est une empreinte épigénétique réalisée par méthylation de cytosines.
Pour les mammifères, il y a inhibition d’un chromosome « X » selon la lignée, au « hasard » (de préférence, celui d’origine mâle), pendant l’implantation du trophectoderme.
Chapitre 2 :
La Fécondation.
Introduction.
La fécondation est une fusion d’un spermatozoïde et d’un gamète femelle suivie de la fusion des deux noyaux (l’amphimixie). Au final, on aboutit à la formation d’un zygote. Elle permet le passage de l’haplophase à la diplophase.
Généralement, la fécondation permet le rétablissement de la diploïdie.
La pénétration du spermatozoïde active l’œuf et met en route le développement embryonnaire.
C’est là que le sexe génétique de l’individu est déterminé.
I Les modalités de la fécondation.
Quelque soit l’espèce, la fécondation se fait toujours en milieu aqueux. La fécondation est externe, dans l’eau, généralement pour les individus ovipares (mais pas tous). La fécondation sera interne (dans les voies génitales femelles) pour tous les vivipares et les ovipares terrestres.
A La fécondation externe.
La plupart des invertébrés et des vertébrés anamniotes a recours à la fécondation externe. Ils vont rencontrer des problèmes spécifiques nécessitant des adaptations particulières.
L’exemple des oursins.
Les oursins vivent en colonie et sont fixés. La rencontre des gamètes va donc impliquer :
- Un regroupement des individus (colonie),
- Des gamètes femelles et mâles émis au même moment et en grand nombre.
B La fécondation interne.
Généralement, il y a différenciation d’un organe copulateur mâle grâce auquel le sperme est introduit dans les voies génitales femelles.
Remarque : on parle de fécondation pseudo-interne chez certains urodèles où le sperme est déposé dans un spermatophore qui sera récupéré et « introduit » dans les voies génitales femelles.
La fécondation interne implique un rapprochement des partenaires sexuels. Il peut y avoir utilisation de signaux de toutes sortes : vocaux, visuels, phéromones sexuelles…
C Les étapes de la fécondation.
La fécondation fait, au minimum, intervenir 4 étapes.
- La reconnaissance et l’adhérence des gamètes.
- La traversée de la (des) enveloppe(s) protectrice(s) de l’œuf.
- La fusion des membranes plasmiques.
- L’amphimixie (ou caryogamie) après l’activation du métabolisme du gamète femelle.
II Mécanismes de la fécondation.
1 Les enveloppes de l’œuf.
L’enveloppe primaire.
Cette enveloppe est généralement mise en place dans l’ovaire, soit uniquement par le gamète femelle, soit avec l’aide de cellules somatiques
- On parle de membrane vitelline chez les oursins et les amphibiens.
- On parle de zone ou membrane pellucide chez les mammifères.
- On parle de chorion chez les poissons.
La ou les enveloppes secondaires.
Souvent, ces membranes secondaires sont mises en place au cours du transit de l’œuf vierge dans les voies génitales femelles. On retrouve :
- la gangue en un ou plusieurs exemplaires chez les amphibiens,
- le blanc dans les œufs de sauropsidés,
- le chorion (poissons insectes). C’est une membrane difficile à traverser et qui demande l’existence d’un micropyle pour permettre la fécondation de l’ovocyte,
- les membranes coquillière et calcaire chez les sauropsidés.
2 Reconnaissance et adhérence.
Les spermatozoïdes sont recouverts de nombreuses protéines de liaison reconnaissant des récepteurs des membranes protectrices de l’œuf.
Si le spermatozoïde possède un acrosome, c’est lors de la traversée des membranes que va se faire la réaction acrosomienne pendant laquelle les enzymes acrosomiales (protéases et hydrolases) sont libérées. Ces enzymes vont protéolyser les constituants des enveloppes, ce qui favorise la progression du spermatozoïde.
Les modalités de la réaction acrosomienne sont différentes selon les espèces (morphologie, constitution, etc. …).
On verra le cas d’un invertébré aquatique et d’un vertébré terrestre.
a Cas de l’oursin.
Il y a attraction du spermatozoïde par le gamète femelle par chimiotactisme.
Ce chimiotactisme est exercé par un peptide émanant de la gangue (membrane secondaire aussi appelée la gelée). Ce peptide a été identifié chez Arbassia punctubata. Il est composé de 14 acides aminés et est appelé le resact. Dans d’autres espèces, le nombre d’acides aminés va varier (jusqu’à 77).
Les resact agissent surtout comme des activateurs des spermatozoïdes en stimulant la chaîne respiratoire. Il y a alors production d’ATP qui sera utilisé pour les mouvements des spermatozoïdes (la mobilité augmente).
Le resact oriente également la nage des spermatozoïdes.
|
|
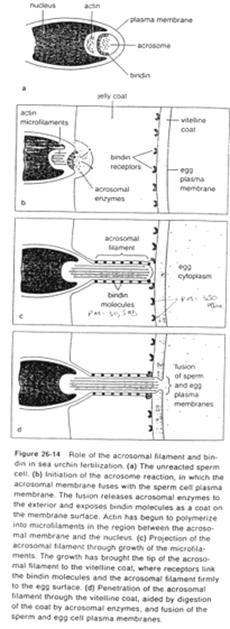
La tête du spermatozoïde possède des récepteurs dont celui du resact. Elle comprend également l’acrosome et le matériel pré-acrosomien.
Les récepteurs sont à différents niveaux (sur différentes membranes), mais principalement, sur la membrane plasmique.
Une fois la reconnaissance effectuée, il semble qu’il y ait action d’un glucide de la gelée, qui déclencherait la réaction acrosomienne.
|
La fusion de la membrane plasmique avec la membrane acrosomienne externe va provoquer la formation de vésicules qui entraîneront la formation (l’ouverture) de pores qui laissent passer les enzymes acrosomiales (pour la digestion de la gangue).
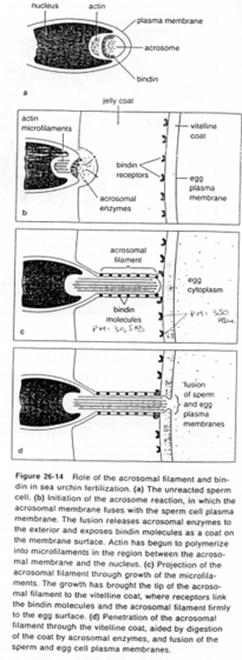
Des enzymes acrosomiales permettent le découplage de l’actine : celle-ci est libérée et va se polymériser en filaments formant le processus acrosomial.
La membrane acrosomienne interne va être refoulée vers l’avant. Des molécules de cette face, les bindines, vont se retrouver exposées le long du processus acrosomien. Les bindines permettent la liaison aux vésicules vitellines.
L’adhérence des gamètes est ainsi assurée par la liaison ligand/récepteur (bindine et récepteur glycoprotéique de la membrane vitelline).
Une fois cette association effectuée, le tubule acrosomien progresse et il y aura fusion de la membrane plasmique avec l’ex-membrane acrosomique interne.
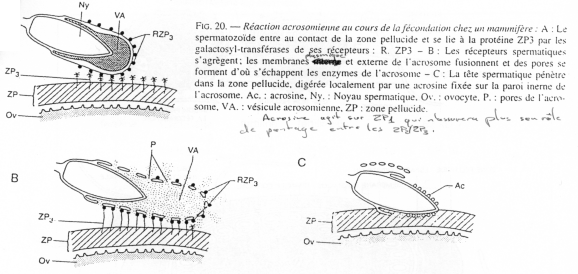
b Cas de la souris (mammifère).
L’ovocyte 2, expulsé, est entouré des cellules de la corona radiata avec, en dessous, la zone pellucide.
La pénétration au travers de la corona radiata est facilitée par la dissociation partielle des cellules, provoquée par des enzymes sécrétées par les cellules oviductaires.
La membrane pellucide possède une macromolécule de reconnaissance et de liaison au spermatozoïde.
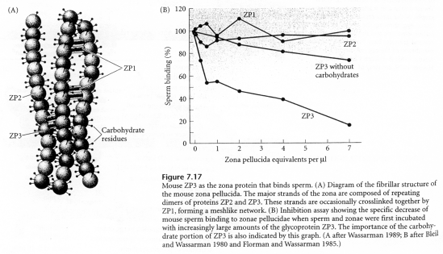
Cette macromolécule est constituée de 3 glycoprotéines. ZP2 et ZP3 sont des hétéropolymères. Il y a une alternance dans l’enchaînement : ZP2-ZP3- ZP2-ZP3- ZP2-ZP3-…
Les chaînes ainsi formées se connectent entre elles grâce à la protéine ZP1.
Avant la réaction acrosomienne, des sites de ZP3 particuliers vont subir des modifications
ZP3 agit en deux temps :
- Fixation par les résidus glucose de ZP3 d’un peptide du spermatozoïde,
- Action d’une glycosyl-transférase de la membrane plasmique du spermatozoïde qui reconnaît les résidus N-acétyl-glucosamine de ZP3.
ZP1 est riche en groupements SH, ce qui permet la formation de ponts di-sulfures entre les dimères de ZP1 mais aussi avec les hétéropolymères ZP2-ZP3.

Les récepteurs à ZP3 du spermatozoïde (RZP3) assurent la liaison entre les résidus N-actéyl-glucosamine de ZP3 et la membrane plasmique du spermatozoïde.
Quand la reconnaissance a eu lieu, la réaction acrosomienne débute. Elle est similaire à ce qu’il se passe chez l’oursin : formation de vésicules, etc. …
Ici, une enzyme, fixée au niveau de la membrane interne de l’acrosome (l’acrosine) va venir modifier localement la protéine ZP1.
D’autres protéines interviennent dans la reconnaissance, mais aussi, dans le phénomène de fusion de la membrane plasmique :
- La partie protéique de ZP3 se lie à deux protéines spermatiques, SP56 et SP95, dont le domaine intracellulaire est à activité tyrosine-kinase ; elles interviennent dans l’ouverture de l’acrosome ;
- La fertiline intervient dans la reconnaissance de la membrane plasmique ; elle se lie à des intégrines de la membrane plasmique de l’ovocyte 2.
La fertiline serait activée par l’acrosine. C’est une protéine dimérique constituée de deux sous unités :
- α : elle contient une région similaire aux virus, codant pour une protéine de fusion ;
- β : elle appartient à la famille des métalloprotéases et contient un domaine intégrine.
Un fois activé, le dimère α6β1 faciliterait la fusion des membranes spermatique et ovocytaire.
c Formation du cône de fécondation (oursin).
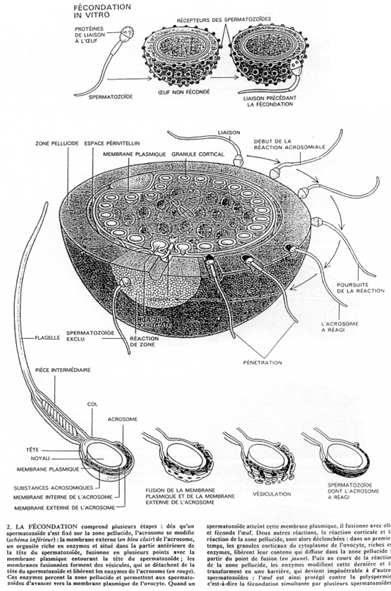
L’oursin présente dans sa zone corticale de nombreux granules corticaux.
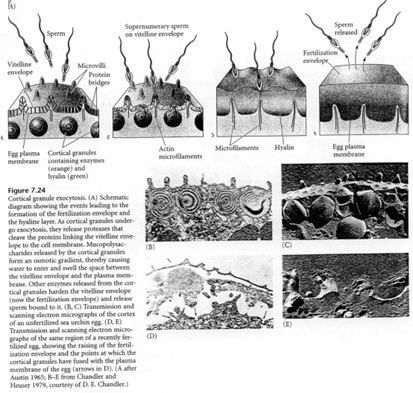
La membrane de l’ovule se hérisse de microvillosités. A l’entrée du spermatozoïde, elle va se soulever. Au point d’impact du spermatozoïde, on retrouve une protubérance, le cône de fécondation.
La première manifestation de la réaction corticale est une décharge calcique qui entraîne la migration des granules corticaux et leur fusion avec la membrane plasmique. Cette réaction se propage à tout l’œuf) partir du point d’impact du spermatozoïde.
d réaction corticale chez la souris.
La souris présente aussi des granules corticaux, mais en nombre plus faible que l’oursin (4000 contre 15.000).
La réaction corticale commence par la fusion de ces granules corticaux avec la membrane plasmique de l’ovocyte 2. Les granules libèrent leur contenu dans l’espace périvitellin (entre la membrane plasmique et la zone pellucide). Ils contiennent des mucopolysaccharides, des glycoprotéines et des enzymes.
Certaines de ces enzymes vont modifier les protéines ZP3 : il y a attaque des O-oligosaccharides responsables de la reconnaissance des spermatozoïdes. Les spermatozoïdes ne peuvent plus se fixer.
C’est un phénomène qui participe au blocage de la polyspermie.
D’autres enzymes cliveraient la partie protéique de ZP3 qui constitue un site de fixation primaire du spermatozoïde.
Cette réaction corticale se propage à partir du point de fusion des membranes des deux gamètes. Il y a mise en place de la membrane de fécondation par décollement de la zone pellucide de la surface de l’œuf.
3 Activation du métabolisme : prélude à l’amphimixie.
a Exemple chez l’oursin.
Les membranes des deux gamètes fusionnent et créent ainsi un canal par lequel pénètre le noyau du spermatozoïde. La tête et la pièce intermédiaire (avec le centriole proximal) entrent dans l’ovocyte. Chez certaines formes d’oursins, la queue peut également entrer.
Les constituants cellulaires du spermatozoïde vont dégénérer, excepté le noyau et le centriole proximal. Moins de 1% des mitochondries sont d’origine paternelle.
Il se produit une forte augmentation de la concentration en Ca2+ qui provient du réticulum endoplasmique. Dans un premier temps, cette augmentation est transitoire.
De plus, il y a un efflux (vers l’extérieur) d’ions H+ qui est compensé par une entrée d’ions Na+. Le pH va ainsi s’accroître, passer de 6,2 à 7,2, et atteindre une valeur de pH permettant presque d’avoir un métabolisme normal.
Ces réactions seraient déclenchées au sein des phospholipides membranaires.
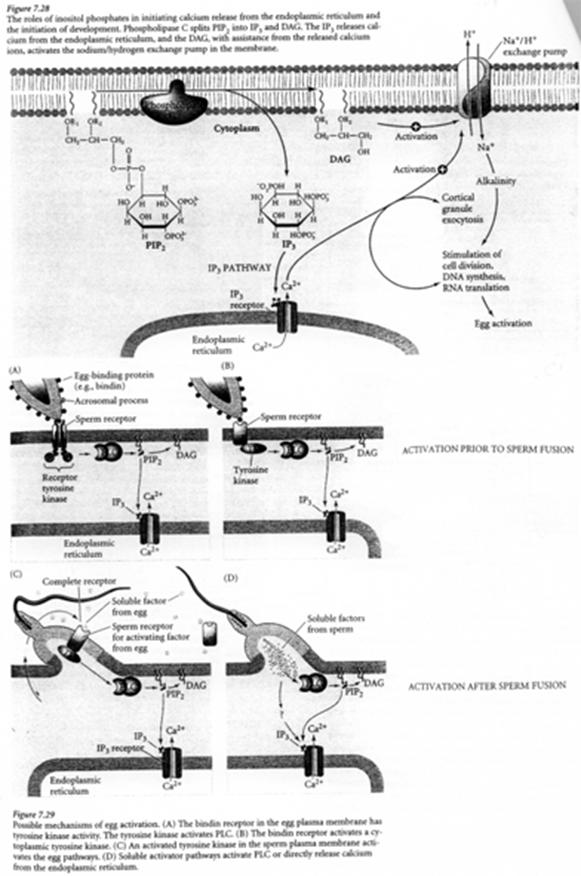
PiP2 est hydrolysé par la PLc (d’une isoforme β et/ou γ) en DAG et IP3. Ce dernier se fixe sur un récepteur présent sur le réticulum endoplasmique et permet la libération de Ca2+.
En synergie avec le DAG, le Ca2+ active une PKc (Ca2+ dépendante). Cette PK lance une cascade de phosphorylation qui aboutit à l’augmentation de la synthèse protéique et d’acides nucléiques (ADN).
Quand le noyau spermatique se retrouve dans le cytoplasme ovulaire, il effectue une rotation de 180° à l’issu de laquelle le pôle postérieur se trouve orienté vers le centre de l’œuf. Le pôle postérieur a, à ses cotés, le centriole proximal. Ce centriole va se dédoubler (c’est la néosynthèse).
Il y a mise en place d’un diplosome (entouré de matériel péri centriolaire) servant de MTOC (centre organisateur des microtubules), donc, de centre de nucléation pour les microtubules.
Pendant la rotation du noyau, il y a un début de formation de fibres astériennes : l’aster irradie dans toute la cellule. Ceci semble permettre la localisation du noyau femelle pour permettre le rapprochement des deux pronucléi.
On a constaté qu’au fur et à mesure que le pronucléus mâle progresse vers le pronucléus femelle, les fibres de l’aster régressent. Quand les deux pronucléi sont presque au contact l’un de l’autre, il ne reste plus aucune fibre.
Il va alors s’édifier deux nouveaux asters qui s’écartent l’un de l’autre et les enveloppes des deux pronucléi fusionnent.
Il y a mise en place du noyau de fécondation qui est un syncaryon diploïde.
En 1, on parle de noyau spermatique : le spermatozoïde vient de pénétrer ; les protamines n’ont pas encore été remplacées.
En 3, on parle de pronucléus mâle car le noyau spermatique a été décompacté : les histones ont remplacé les protamines.
En 5, il y a écartement des asters pour permettre la fusion des pronucléi. On parle ici de stade amphiaster.
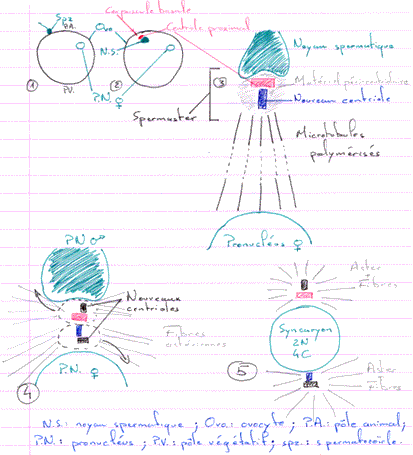
Le SPF agit sur les deux pronucléi avant la fusion.
b Exemple de la souris.
En général, il y a achèvement de la seconde division de maturation du gamète femelle par la pénétration du spermatozoïde dans l’ovocyte 2 (N, 2C, bloqué en métaphase 2).
Cette deuxième division est bloquée par le CSF (cytostatic factor) et le MPF qui sont présents et actifs (il y a aussi la protéine P39mos qui est une protéine-kinase-kinase). C’est la pénétration spermatique qui va débloquer cette situation.
Provenant du réticulum endoplasmique, il y a une importante décharge calcique qui provoque une série de phosphorylation. En bout de chaîne, le CSF et le MPF sont dégradés.
La seconde division de maturation reprend avec l’expulsion du deuxième globule polaire et ainsi, constitution du pronucléus femelle à N, C.
Remarque : chez la souris, on n’a pas pu mettre en évidence de stade syncaryon.
La phase S semble, comme chez l’oursin, se réaliser dans les deux pronucléi.
Le fuseau de première division de segmentation se met en place : on peut enfin trouver une structure hybride (en métaphase de première division de segmentation).
Pour visualiser le noyau hybride, il faut attendre la première division de segmentation : les noyaux des deux premiers blastomères ont un mélange des chromosomes maternels et paternels.
Remarque> : la parthénogenèse chez les mammifères n’existe pas. Les pronucléi ne sont pas équivalents malgré le fait que chacun d’eux soit haploïde. Certains gènes du lot paternel et du lot maternel (mais différents selon l’origine) ne s’expriment pas à cause de l’empreinte génomique parentale par méthylation.
c Cas de l’oursin.
Chez les oursins, la bindine possède plusieurs domaines de liaison aux récepteurs. Il y en a toujours un qui est spécifique de l’espèce.
La bindine de Strongylocentrotus purpuratus a une masse molaire de 30,5kDa. Son récepteur (dans la même espèce) a un poids moléculaire de 350kDa.
Le récepteur de la membrane plasmique du spermatozoïde interagit avec des résidus fucose d’une glycoprotéine : la FSG (Fucose Sulfate Glycoprotéine).
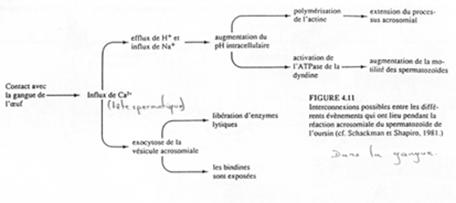
Une fois la reconnaissance faite, il y a dépolarisation de la membrane plasmique du spermatozoïde qui entraîne l’ouverture des canaux calciques voltage dépendants.
Il se crée un influx calcique à la source de deux phénomènes :
- Stimulation d’un antiport Na+/H+ (entrée/sortie) qui provoque l’augmentation du pH intracellulaire. L’actine globulaire va être découplée, ce qui rend possible la polymérisation et l’éversion.
- Exocytose des vésicules acrosomiales : libération d’enzymes lytiques ; exposition des bindines.
Une fois réalisée la fusion membranaire des deux gamètes :
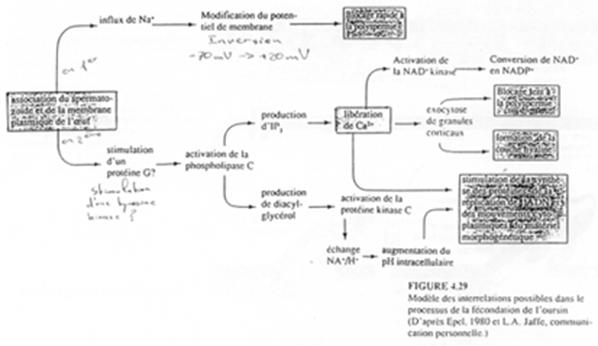
On a un influx de Na+ provoquant l’inversion du potentiel de membrane (de -70mV à +20mV) et une altération des protéines (changement de conformation) nécessaire à la fusion membranaire (avec d’autre spermatozoïdes).
C’est un état transitoire (retour rapide à un potentiel négatif de membrane) qui permet un blocage rapide de la polyspermie.
L’activation.
Il y a activation d’une tyrosine kinase ou d’une protéine G qui activerait une PLc…

En 1, les membranes plasmique et vitelline sont liées avant la fusion des membranes spermatique et ovulaire.
En 2, la liaison lance la réaction corticale et la fusion des granules corticaux à la membrane plasmique de l’ovocyte, puis, leur exocytose.
Chez l’oursin, les granules corticaux sont riches en glycoprotéines, protéases (ovoperoxydases).
- Les glycoprotéines sont importantes pour la formation de la couche hyaline.
- Les hydrolases vont couper les liaisons entre les membranes vitelline et plasmique (de l’ovocyte).
- Les protéases détruisent les récepteurs à la bindine (dans la zone de fécondation).
- Les mucopolysaccharides (comme le GAG) vont créer un gradient osmotique : il y a une entrée locale d’eau par osmose qui décolle les membranes plasmique et vitelline.
Des pontages sont réalisés grâce à des résidus tyrosine. De plus, il y a rigidification de la membrane vitelline.
Certaines glycoprotéines comme l’échinonectine (225kDa) et la hyaline (220kDa) vont se lier à la membrane plasmique pour constituer la couche hyaline dont le rôle est d’assurer la cohésion entre les futurs blastomères pendant la segmentation.
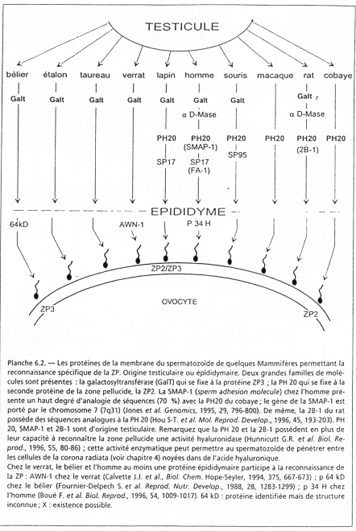
PH20 (64kDa) est une molécule ancrée à la surface post-acrosomiale et aurait deux rôles :
- Un rôle énergétique : elle activerait une hyaluronidase. L’acide hyaluronique participe à la formation d’un ciment intercellulaire comme dans la corona radiata. Cette action a lieu avant la réaction acrosomique ;
- Un rôle de liaison secondaire. Elle se lierait à ZP2 pour permettre la fixation secondaire du spermatozoïde.
Après la réaction acrosomienne, PH20 migrerait vers la membrane interne de l’acrosome où est localisé un autre îlot de PH20.
PH20 (= SMAP1) a une activité tyrosine kinase.
FA1 (= SP17) est une protéine kinase AMPc dépendante.
SP95 a une activité tyrosine kinase.
Ces trois molécules activeraient l’isoforme (γ) de la PLc.
Chapitre 3 :
La Parthénogenèse.
I Introduction.
Définition :
La parthénogenèse est un mode de reproduction indépendant de la fécondation. Ce mode de développement se rencontre beaucoup dans l’embranchement des arthropodes mais aussi chez certains lézards et dans le cas du dindon.
Les modalités de la parthénogenèse sont très diverses et l’on va adopter une classification en fonction du sexe des individus parthénogénétiques obtenus :
- uniquement des femelles : thélytoque ;
- uniquement des mâles : arrhénotoque ;
- des mâles et des femelles : deutérotoque.
On peut considérer le sexe mais aussi l’ensemble de la descendance de la population à laquelle on s’intéresse, dans un cadre spatio-temporel.
· La parthénogenèse thélytoque est une parthénogenèse constante, obligatoire. L’absence de mâle est possible.
· S’il y a apparition de mâles à certaines périodes de l’année, de thélytoque, on passe à deutérotoque avec une parthénogenèse cyclique.
· Pour la parthénogenèse arrhénotoque, les œufs donnent des mâles mais les œufs fécondés donneront des femelles. En fonction de la fécondation ou non des œufs, on aura des mâles ou des femelles. On parle de parthénogenèse facultative.
Si l’on prend en compte la répartition géographique d’une espèce, dans certaines localisations, la reproduction est sexuée, dans d’autre, il y aura un développement parthénogénétique. C’est une parthénogenèse géographique.
On peut également prendre en compte le stade de développement où l’individu réalise la parthénogenèse. C’est en général au stade adulte que celle-ci se déroule. Il y a toutefois des cas originaux où les œufs sont formés et développement leur(s) stade(s) larvaire(s). C’est à ce moment là que peut avoir lieu la paedogenèse. Celle-ci constitue une forme de parthénogenèse cyclique associée à la viviparie (les larves n’ont pas d’orifices de ponte).
Quand la parthénogenèse est cyclique, il faut comprendre le déterminisme des différentes phases du cycle. Ici, on tentera d’expliquer comment se fait la détermination sexuelle.
II Parthénogenèse thélytoque ou constante.
La population n’est pas composée que de femelles. Cette population peut constituer à elle seule une espèce ou bien, une race d’une espèce qui comprend ailleurs une population gonochorique.
Les individus femelles ont une formule chromosomique diploïde. Si la méiose a lieu, il faudra rétablir cette diploïdie à un moment ou un autre.
A Cas du lépidoptère Solenobia triquellelia.
On distingue trois races dans cette espèce :
- une diploïde, bisexuée ;
- une diploïde, thélytoque ;
- une tétraploïde, thélytoque.
Pour les individus gonochoriques, la détermination sexuelle est de type ZW (Abraxas). Les femelles ont deux hétérochromosomes sexuels distincts.
Remarque : pour la détermination sexuelle, si le mâle détermine le sexe, il a les deux hétérochromosomes (X et Y) ; si la femelle détermine le sexe c’est elle qui possède les deux hétérochromosomes sexuels (Z et W).
Au niveau des ovocytes, la méiose débute normalement. Après la phase S (pré leptotène) et avant les deux divisions, il y a une division de maturation (hétérotypique) qui aboutit à la formation d’un globule polaire (haploïde) puis d’un ovocyte 2, également haploïde.
Avant que l’émission du globule polaire ne soit achevée, il y a rétention de celui-ci. La première division avorte. Le fuseau de première division disparaît. Au moment de l’anaphase, des granulations apparaissent. Il y aura mise en place de deux fuseaux de deuxième division méiotique.

On va observer la fusion des deux lots de chromosomes médians (en vert sur le schéma).
Remarque : un bivalent = une tétrade = 4 chromatides.

Les granules ont un rôle inconnu.
L’individu obtenu dans l’exemple est de sexe femelle.
B Cas de Solenobia lichenella.
Ici, la maturation débute normalement. La première division sépare le stock chromosomique en deux lots de tétrades.
Pour une (des) raison(s) inconnue(s), l’anaphase est interrompue et les deux groupes de chromosomes se rassemblent et se disposent sur la plaque équatoriale (le fuseau est reformé).
La seconde division s’enclenche : il y a émission du deuxième globule polaire alors que le premier n’a pas été émis. Ce globule polaire est finalement diploïde (2N, 2C), tout comme le noyau qui présente un apanage ZW (femelle).

Généralement, le premier globule polaire n’est pas émis alors que le second l’est.
Dans certains cas, la diploïdie est rétablie après la méiose : cela se fait plus souvent lors de la première division de segmentation.
En fonction des espèces, lorsque la diploïdie est rétablie par fusion des noyaux des deux premiers blastomères, on aura une détermination sexuelle XX/XY (principalement XX).
C Cas des lézards du genre Lacerta.
La détermination du sexe est épigénétique : il y a intervention de facteurs environnementaux.
Les espèces parthénogénétiques sont principalement présentes dans le genre Lacerta, avec de nombreuses espèces ne présentant que des individus femelles. Ces cas ont été découverts vers la Russie. Aux Etats-Unis et au Canada, on trouve le genre Enemidophorus qui présenterait des cas de parthénogenèse.
La régulation de la diploïdie chez Lacerta.
Il semble que la dernière division ovogoniale soit anormale : il y a une endoréplication, de sorte que l’ovocyte 1 obtenu est tétraploïde.
En réalité, ce sont les équivalents des chromatides sœurs qui se sont dédoublées pour ensuite, se ré-apparier.
Il n’y a finalement aucune variation génétique excepté s’il y a mutation.
C’est une reproduction clonale.
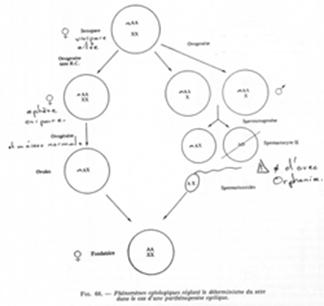
III Parthénogenèse arrhénotoque (ou facultative).
Le développement des individus a lieu avec ou sans fécondation. Ici, l’ovogenèse doit se dérouler normalement. On obtient donc un ovotide haploïde.
S’il y a fécondation, on a une femelle diploïde. S’il n’y a pas fécondation, on obtiendra un mâle.
Ce type de reproduction est rencontré chez les hyménoptères (abeilles, fourmis, vespa…).
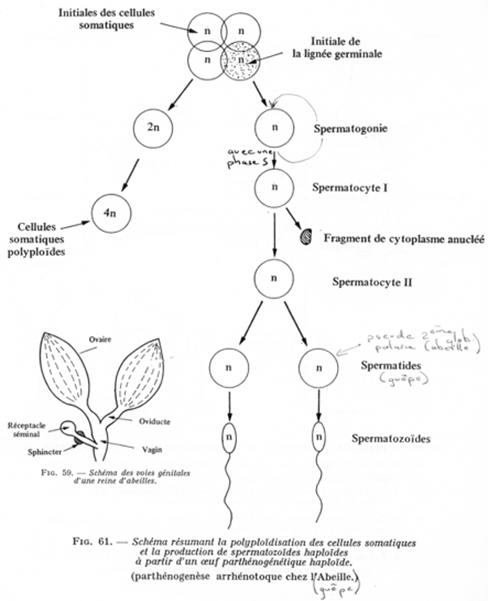
A l’origine de la ruche, on a une reine (femelle féconde). Celle-ci, pendant le vol nuptial, va être fécondée par plusieurs mâles. Les spermatozoïdes recueillis sont stockés dans un réceptacle séminal. Au niveau du conduit allant du réceptacle au vagin, un sphincter est présent :
- Si le sphincter est contracté, l’œuf émis est non fécondé : l’individu obtenu est haploïde.
- Si le sphincter est relâché, l’œuf émis est fécondé : l’individu est diploïde.
Les œufs fécondés sont placés dans alvéoles « banales » et donneront des femelles ouvrières stériles.
Les œufs haploïdes sont placés dans d’autres alvéoles et donneront les mâles (les faux bourdons).
Généralement, l’haploïdie est peu viable et il sera plus ou moins nécessaire de rétablir la diploïdie. Il peut y avoir polyploïdie dans les cellules somatiques.
Les spermatogonies donnent des spermatocytes 1. Pendant la première division, le fuseau est excentré : un des pôles formera une protubérance. Cette division avorte et l’on a un « pseudo globule polaire anucléé ».
La seconde division (homéotypique) est normale (chromosomes en diades).
La cytodiérèse est égale chez la guêpe. Un spermatocyte 1 donne deux spermatozoïdes.
Chez les abeilles, le pseudo globule polaire est anucléé. Pendant la seconde division, le même processus (fuseau excentré) se répète : on aura alors un second pseudo globule polaire : un spermatocyte 1 donne un spermatozoïde.
Chez certains genres (Habrobracon), les mâles sont issus d’œufs fécondés. On n’a encore émis que des hypothèses. Ici, les allèles sexuels détermineraient les sexes de la façon suivante :
- Allèles à l’état haploïde : différenciation mâle.
- Allèles à l’état diploïde :
- Homozygotes (X1X1) : mâle.
- Hétérozygotes (X1X2) : femelle.
Il existe des cas de fécondation artificielle chez les reines abeilles à appareil sexuel atrophié.
Il faut également chercher à savoir pourquoi quelques mâles sont diploïdes et stériles. Ils n’entrent alors pas en concurrence avec les mâles fertiles, haploïdes.
IV La parthénogenèse cyclique.
Il y a ici une alternance entre les phases parthénogénétiques et sexuées.
Ce cas est rencontré chez les Rotifères, des Crustacés (Daphnies), des Aphidiens (pucerons)…
Les conditions de milieu ne semblent pas les seules dans le déroulement du cycle de ces espèces.
A Cas des pucerons.
Les œufs donnent des pucerons femelles à reproduction clonale durant tout le printemps et l’été. A la fin de l’été, il y a apparition de femelles sexupares, ailées et vivipares. Celles-ci vont donner des femelles et des mâles qui participeront à la fécondation.
Le résultat de cette fécondation est la formation d’œufs de durée. Ce sont des formes de résistance aux conditions défavorables. Ces œufs vont éclore au printemps.
Ils sont protégés par une enveloppe protectrice. Ils donneront, après éclosion, des femelles fondatrices, aptères et vivipares.
Ces femelles donnent naissance à des femelles : c’est une parthénogenèse thélytoque.
A l’automne apparaissent les femelles sexupares qui donnent à leur tour, une génération sexuée (mâles et femelles).
Dans de nombreuses espèces, les sexupares sont de deux sortes :
- Celles qui donnent naissance aux œufs se développant en mâle : les femelles andropares.
- Celles qui donnent naissance aux œufs se développant en femelles : ce sont les gynopares.
Ces deux types de femelles sont aptères et ovipares.
La fécondation des individus sexués obtenus engendre les œufs de durée (d’hiver).
B Cas des Daphnies.E
1 Les Cladocères.
Durant la majeure partie de l’année, c’est la parthénogenèse thélytoque qui est utilisée.
L’ovogenèse est particulière : les ovogonies sont regroupées par quatre (des quartets). Une seule de ces quatre cellules donnera l’ovocyte. Les trois autres sont des cellules nourricières.
Les œufs se développent immédiatement après leur arrivée dans une cavité incubatrice, située entre la carapace et la région dorsale du corps.
Dans certaines conditions, une femelle est à l’origine de la génération sexuée (mâles et femelles).
2 Les Moïna.
Dans un genre voisin aux Cladocères (les Moïna), l’ovocyte n’ingère pas que les trois cellules nourricières mais aussi les quartets voisins. On obtient seulement 2 ovocytes arrivant à maturité mais qui seront plus développés, plus gros.
Quand la génération sexuée est créée, les deux œufs se développent dans la poche incubatrice. Les parois de la poche s’épaississent, se pigmentent et sécrètent une coque résistante autour de chacun des deux œufs.
A la mue suivante, qui suit la transformation de la poche, la cavité incubatrice se détache du reste de la carapace et va constituer l’éphippie (qui contient les deux œufs).
Contrairement aux œufs parthénogénétiques, ce type d’œufs devra subir un temps de latence pour pouvoir poursuivre son développement.
Cet œuf représente un mode d’attente pour le retour de bonnes conditions.
Les éphippies donnent toujours naissance à des femelles.
3 Les différents cycles des Cladocères.
- Monocycle : une période sexuelle par an, ayant lieu le plus souvent à l’automne. C’est le mode le plus rencontré.
- Dicyclique : deux périodes par an (automne et printemps).
- Polycyclique : plusieurs périodes sexuelles par an. Ce sont en général des espèces de petites mares.
- Acyclique : la reproduction se fait uniquement par parthénogenèse thélytoque. Les espèces sont souvent planctoniques, dans les grands lacs.
Chez certaines espèces, on trouve des monocycliques, des polycycliques… selon la localité : les conditions du milieu sont importantes dans la fréquence des cycles.
Il y a un phénomène qualifié d’hétérogonies qui consiste en l’alternance d’une génération bisexuelle avec, généralement, uniquement des femelles parthénogénétiques.
4 Déroulement de la reproduction chez les Cladocères.
Le nombre de générations parthénogénétiques est variable selon l’espèce.
Dans ce type de reproduction, un seul globule polaire est émis durant l’ovogenèse. La première division de maturation est escamotée. Finalement, la méiose est réduite à une mitose.
Les œufs montrent l’absence de la division hétérotypique et dont donc diploïdes.
L’ovogenèse des œufs de durée présente les deux divisions méiotiques, normales, de sorte que l’ovotide est haploïde. La fécondation rétablira la diploïdie.
La femelle fondatrice est qualifiée d’amictique ou virginipare. Au cours du cycle, des femelles donneront naissance aux formes sexuées : ce sont les femelles mictiques. Les femelles qui engendrent les œufs de durée sont qualifiées de femelles amphigoniques.
Ces définitions correspondent à des états physiologiques différents.
La détermination chromosomique.
Les femelles gynipares (ou gynéphores) ont une méiose qui est anormale. La division hétérotypique est altérée ; la division homéotypique (la seconde) est normale et asymétrique. Les œufs obtenus sont diploïdes.
Le nombre d’autosomes et d’hétérochromosomes peut varier. Les femelles ainsi obtenues sont aptères, ovipares.
Pour la formation des ovotides, la méiose va être normale : formation de cellules haploïdes nA+X.
Si la femelle est andropare, elle subit une ovogenèse particulière : la première division est diminutive. Pour des raisons inconnues, un X est perdu.
La spermatogenèse est « classique » et se termine par deux types de spermatides :
- Une spermatide avec un chromosome X ;
- Une spermatide sans chromosome X : non viable.
Dans d’autres cas, deux chromosomes X ne migrent pas aux pôles du fuseau.
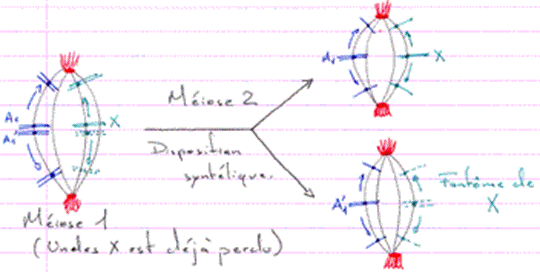
Remarque : s’il y a perte de l’un des hétérochromosomes lors de la première division de maturation, l’unique restant va se disposer à l’équateur du fuseau comme s’il était apparié à un autre chromosome : les kinétochores ont une disposition syntélique (et s’apparient à du vide).
V La paedogenèse.
La paedogenèse est une parthénogenèse se produisant non pas chez l’adulte mais chez les formes larvaires.
Elle se rapproche de la parthénogenèse cyclique. Il existe une série de formes intermédiaires entre ces deux modes de développement.
Chez les cladocères marins du genre Padon, les femelles ont dans leur cavité incubatrice des embryons qui ont déjà, eux-mêmes, des œufs segmentés. Il y a emboîtement de trois générations successives.
La paedogenèse s’accompagne presque toujours de viviparité.
On trouve cette paedogenèse chez des diptères du genre Myastore et les nématodes du genre Rhabditis.
Chez Rhabditis aberrans, le spermatozoïde pénètre dans l’œuf et détermine son activation. Il ne prend pas part au développement de l’embryon : il va dégénérer avant la caryogamie : c’est de la gynogenèse.
Les Malis (poissons) ont besoin d’une fécondation entre deux individus de sexe différent mais seul le génome femelle permet le développement embryonnaire.
Les spermatozoïdes apportent leur centrosome en plus de l’activation de l’œuf.
VI La parthénogenèse naturelle chez les vertébrés.
La parthénogenèse naturelle existe aussi chez certains vertébrés.
Chez le dindon, un certain pourcentage d’œufs présente un début de développement parthénogénétique. Beaucoup de ces œufs vont spontanément arrêter leur développement.
Toutefois, un petit nombre de ces œufs continue leur développement et donne des individus tous diploïdes. Ceux sont tous des mâles.
On suppose qu’il y a eu rétention du deuxième globule polaire, ce qui rétablit la diploïdie.
Il manque une donnée : pourquoi sont ils tous des mâles ?
Il faut admettre que ces individus sont ZZ et que leur détermination sexuelle est de type ZZ/ZW. L’obtention d’individus WW est théoriquement possible par cette méthode mais l’on n’en a jamais trouvé. On pense que cette forme n’est pas viable.
Chapitre 4 :
Les déterminismes du sexe.
I Historique.
Le déterminisme du sexe préoccupe les embryologistes depuis l’antiquité. Aristote est le premier embryologiste connu. Au quatrième siècle avant JC, il pensait que le sexe était déterminé par la température du partenaire mâle, durant le rapport sexuel. L’hypothèse émise est que le gamète femelle était un gamète mâle mutilé dont le développement avait été stoppé car la froideur de la matrice avait dominé sur la chaleur de la semence mâle. Il pensait aussi que les organes sexuels femelles n’avaient pas maturé suffisamment pour donner une semence active.
Claude Galien, un anatomiste, disait que comme l’espèce humaine était la plus parfaite des espèces et que l’homme est plus parfait que la femelle grâce à son excès de chaleur. Les organes de reproduction se forment dans le fœtus mais la formation des organes femelles ne se poursuit pas (neuvième siècle).
Au seizième siècle, un anatomiste, André Vésale, considérait que Galien avait raison à propos des organes génitaux. Il a émis l’idée que les femelles avaient le même nombre de côtes que le mâle.
Les anatomistes ont abandonné l’anatomie femelle proposée par Galien.
Au 17ème siècle, De Graaf considérait que la femelle produisait des œufs ; cependant, on ignorait le rôle des œufs et des spermatozoïdes dans la constitution des descendants.
Au 18ème siècle, Spallanzani émit l’idée des deux gamètes pour la constitution d’un nouvel individu. On pensait aussi que l’environnement où se développait l’œuf pouvait avoir une influence sur le déterminisime du sexe : température et nutrition.
Au 19ème, Geddes et Thomson affirment que les facteurs qui favorisent l’accumulation d’énergie et des éléments nutritifs prédisposent une descendance femelle alors que les facteurs favorisant l’utilisation de ces éléments prédisposent une descendance mâle.
McClung, en 1902 remet en cause la prédominance environnementale. C’est la théorie de la détermination chromosomique du sexe qui apparaît.
Carl Correns émit l’hypothèse que pour la majorité des espèces, on devrait arriver à une proportion de 1/1 pour les femelles/mâles, et ceci en supposant que les mâles sont hétérozygotes et que les femelles sont homozygotes pour les facteurs de détermination du sexe.
Les travaux de Stevens, 1905, et de Wilson ont établi une corrélation entre le sexe femelle et les chromosomes sexuels XX ainsi que la corrélation entre le sexe mâle et les chromosomes XY ou X0. Ils ont supposé qu’un composé nucléaire spécifique était responsable du phénotype sexuel. La détermination est due) des évènements héréditaires et non environnementaux.
Les facteurs génétiques et environnementaux contribuent au déterminisime du sexe selon les espèces considérées (un des facteurs est prédominant).
II Déterminisme chromosomique du sexe.
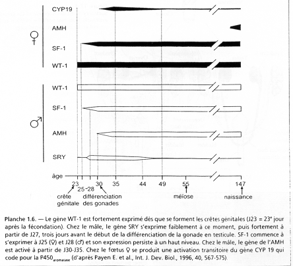
Le sexe chromosomique influence le sexe gonadique qui lui-même influence le développement des organes génitaux : ce sera le sexe phénotypique. Chez de nombreuses espèces, il y aura intervention de centres nerveux qui joueront un rôle.
Dans l’espèce humaine, on parle en plus du sexe phénotypique, de sexe psychologique et de sexe social.
L’individu peut provenir d’un bourgeonnement d’un unique individu : reproduction asexuée, soit du développement d’un œuf : reproduction sexuée. Les deux processus ne sont pas exclusifs l’un de l’autre et peuvent se succéder (exemple : l’hydre).
Dans la reproduction sexuée, il y a présence de gamètes et de la fécondation ou de la parthénogenèse.
Les espèces gonochoriques ont des individus qui sont soit mâle soit femelle alors que les espèces hermaphrodites ont des individus à la fois mâle et femelle.
Chez les insectes, Wilson a trouvé les chromosomes X et Y chez les mâles. Les hétérochromosomes ne sont pas toujours discernables mais dans les espèces gonochoriques, le sexe ratio est de une femelle pour un mâle : une paire de chromosomes doit porter des allèles ou des gènes différents. Une paire de chromosomes porte un segment différentiel : différent entre les deux sexes.
Les hétérochromosomes sont différents des autosomes de par leur comportement lors des divisions cellulaires :
- Les hétérochromosomes migrent aux pôles avant les autosomes (phénomène de précession) ;
- Les autosomes migrent après les hétérochromosomes : phénomène de succession.
La méiose répartie les hétérochromosomes dans les gamètes selon deux possibilités :
- Si l’on a 2 X, l’individu élabore un seul type de gamète : X ; on parle de sexe homogamétique ;
- Si 50% des gamètes héritent d’un X et 50% héritent d’un Y, l’individu élabore alors deux types de gamètes ; on parle de sexe hétérogamétique.
Selon les espèces, c’est soit la femelle, soit le mâle qui est hétérogamétique :
- Hétérogamétie mâle : 2nA + XY ou 2nA + X0
- Hhétérogamétie femelle : 2nA + ZW ou 2nA + Z0
On détermine cela en faisant un caryotype et quand les hétérochromosomes sont discernables des autosomes. Chez Pleurodeles, la paire de chromosomes 4 porte un segment différentiel et la femelle est 2nA + ZW.
Humphrey : quand le caryotype ne permet pas de déterminer le sexe, on peut faire une expérience comme par exemple sur l’axolotl (batracien, urodèle). Au stade embryonnaire, on greffe une ébauche présomptive d’une gonade mâle sur un embryon femelle à la place de son futur ovaire gauche. Au stade larvaire, on enlève cette gonade.
Les résultats :
On a une femelle masculinisée et l’autre gonade élabore des spermatozoïdes : c’est un néo-mâle obtenu à partir d’une femelle génétique. A l’âge adulte, on croise le néo-mâle avec une femelle normale : on obtient alors beaucoup plus de femelles que de mâles : le sexe ratio est donc anormal. Les femelles WW sont normales et fertiles.
|
Femelle/néo-mâle
|
Z
|
W
|
|
Z
|
ZZ
|
ZW
|
|
W
|
ZW
|
WW
|
On a ¾ de femelles et ¼ de mâles.
Si l’on croise des individus entre eux : si l’on croise une femelle WW avec des mâles normaux, on n’aura que des femelles.
|
Mâle / Femelle
|
W
|
W
|
Femelles de la F1
|
|
Z
|
ZW
|
ZW
|
100% de femelles
|
|
Z
|
ZW
|
ZW
|
|
|
Mâle / Femelle
|
Z
|
W
|
Femelles « normales »
|
|
Z
|
ZZ
|
ZW
|
50% de chaque sexe
|
|
Z
|
ZZ
|
ZW
|
|
Si la femelle engendre :
- Les deux sexe : c’est une femelle amphogène ;
- Un des sexes : c’est une femelle thélygène (monogénie) ;
- Uniquement des mâles : c’est une femelle arrhénogène (monogénie).
Les femelles thélygènes se retrouvent aussi chez les poissons où elles sont WW.
Il existe des individus particuliers présentant des parties morphologiquement mâles et des parties morphologiquement femelles : ce sont des individus gynandromorphes. On trouve des exemples de ces individus chez les drosophiles.
Chez les drosophiles, les mâles hétérogamétiques sont 6A + XY et les femelles, homogamétiques, sont 6A + XX. La présence de gynandromorphe est possible car lors de la première caryocinèse (première division de l’œuf) d’un zygote XX, il va y avoir perte de l’un des chromosomes X : un des noyaux fils a alors la constitution X0.
Chez ces drosophiles, les territoires XX donnent des territoires morphologiquement femelles alors que les territoires X0 donnent des territoires morphologiquement mâles.
A Relation entre les hétérochromosomes et le sexe de l’individu.E
Chez les papillons, certains œufs sont binucléés car un premier globule polaire n’est pas émis. Chez les drosophiles, il peut ne pas y avoir émission du globule polaire et l’espèce est monospermique. Les papillons Bombyx sont polyspermiques et de type abraxas pour la détermination du sexe (ZW).
Lors que la fécondation, les deux noyaux femelles peuvent fusionner avec deux pronucléi mâles différents.
Femelle ZW x Mâle ZZ  ZZ et ZW.
ZZ et ZW.
Chez l’abeille, il arrive que certains oeufs soient binucléés:
- Femelle : 32A + XX (2N)
- Mâle : 16A + X (N).
Un noyau spermatique fusionne avec un des noyaux femelles : formation d’un noyau XX : femelle 32A + XX.
L’autre noyau ne fusionne pas avec les spermatozoïdes : formation d’un noyau X : mâle 16A + X.
Le sexe est déterminé au moment de la fécondation. Les individus issus d’un seul œuf sont du même sexe (par exemple, le tatou) : on parle de polyembryonie. C’est le cas des jumeaux dans l’espèce humaine.
B Rôle du chromosome Y chez la drosophile et des autosomes.
Les travaux de Morgan sur l’hérédité liée au sexe montrent que le chromosome Y porte peu de gènes. Les individus XXY sont des femelles alors que les individus X0 ont un phénotype mâle. Y ne porte donc pas de gènes masculinisant. Le chromosome Y intervient très tard dans le développement lors de la spermatogenèse (sur la mobilité des spermatozoïdes) mais Y est utile au mâle pour sa fertilité. Chez les drosophiles polyploïdes, les manipulations montrent que les gènes de la sexualité sont en partie portés des autosomes.
Rapport du nombre de chromosomes X en fonction du nombre de lots d’autosomes (= X/nA)
- Rapport compris entre 0,5 et 1 : individu intersexué. Exemple : 2nA + XY = 6A + XY  X/nA = ½ = 0,5
X/nA = ½ = 0,5
- Supérieur ou égal à 1 : femelle. Exemple : femelle 2nA + WW  2/2 = 1.
2/2 = 1.
Détermination : résultat d’une balance génétique. Les gènes masculinisant sont portés par les autosomes et les féminisant sont portés par le X.
III Rappels de la structure des chromosomes sexuels X et Y.
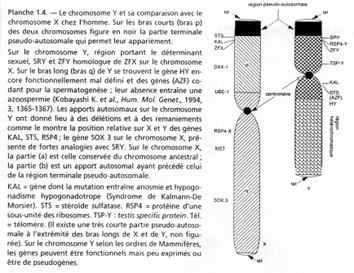
La région en noire correspond à la région pseudo autosomale. Les gènes retrouvés ici ont une origine ancestrale autosomale : sauf mutations, entre le chromosome X et le Y, ces gènes sont équivalents.
C’est ici que se produit un crossing-over (obligatoire). Ces chromosomes sont isolés des autosomes dans une vésicule sexuelle pendant la gamétogenèse.
Sur le X et le Y, certains gènes se retrouvent mais à des emplacements différents : STS, KAL. Au départ, ces gènes étaient dans une région analogue, mais des remaniements sont intervenus : deux cassures sur le bras court de Y  STS et KAL se trouvant entre les deux cassures vont être insérés dans le bras long de Y (grâce à encore une autre cassure).
STS et KAL se trouvant entre les deux cassures vont être insérés dans le bras long de Y (grâce à encore une autre cassure).
Le gène ZFX (sur X) a un homologue sur Y : ZFY. Le gène XIST, sur le bras long de X est un gène intéressant, intervenant dans l’hétérochromatinisation du chromosome X chez les individus possédant deux X. Le gène SOX3, aussi sur le bras long de X, présente une forte homologie avec SRY (SRY est le gène maître de la mise en place du testicule). SOX3 aurait dévié de SRY et il ne s’exprime pas dans le testicule.
Chez les poissons Oryzia latipes, on a transformé des embryons XY (mâles) en femelles fertiles par un traitement (au stade embryonnaire) à la 17β-oestradiol (hormone). Dans la descendance obtenue, on retrouvera des individus YY : chez certains vertébrés, l’absence du X n’est pas létale.
Par la suite, il y a eu évolution (chez les mammifères entre autre) où X et Y se sont spécialisés et où X est devenu indispensable.
Par exemple, chez la souris, 2N = 40 ; chez la femelle, on a 38A (autosomes) + 2X ; chez le mâle, on a 38A + XY.
Il faut noter que chez cette souris, la configuration 38A + X0 donne des femelles normales.  Sans Y, on a une différenciation femelle.
Sans Y, on a une différenciation femelle.
Syndrome de Turner : 38A + XXY : ce sont des individus mâles stériles.  Le chromosome Y porte des gènes de structure et/ou régulateurs, gouvernant la différenciation mâle. Ces gènes sont sur le bras court du Y.
Le chromosome Y porte des gènes de structure et/ou régulateurs, gouvernant la différenciation mâle. Ces gènes sont sur le bras court du Y.  En l’absence du bras court du Y, on notera l’apparition d’un phénotype femelle, comme chez les X0.
En l’absence du bras court du Y, on notera l’apparition d’un phénotype femelle, comme chez les X0.
 Y semble indispensable au bon fonctionnement de la spermatogenèse.
Y semble indispensable au bon fonctionnement de la spermatogenèse.
Chez les marsupiaux (genres Perameles / Isoodon), les cellules somatiques mâles sont X0 ; seules les spermatogonies sont XY.  Il y a élimination du Y des cellules somatiques.
Il y a élimination du Y des cellules somatiques.
Dans les souris mosaïques, on retrouve 39A, X / 41A, XYY (obtenue après une première division de segmentation normale de zygote normal). Les deux chromatides sœur du Y vont dans un seul pôle du fuseau  Les spermatogonies seront uniquement XYY (les spermatogonies X0 étant éliminées).
Les spermatogonies seront uniquement XYY (les spermatogonies X0 étant éliminées).
Chez l’Homme, la perte de la région distale du bras long du Y est compatible avec la différenciation de la gonade mais sans spermatogenèse.
Sans le gène AZF, ou le gène HY, il n’y a pas non plus de spermatogenèse. On parle d’anosmie.
Les cellules initiales germinales XX ne peuvent accomplir les stades précoces de la spermatogenèse et les cellules initiales XY de femelle dégénèrent avant la puberté (il n’y a pas de phase de grand accroissement : blocage au stade dychtié).
Toutes les données obtenues ne constituent que des preuves indirectes du chromosome Y (de son rôle) et il faut bien penser qu’il existe une interaction entre les cellules germinales et somatiques pendant la gamétogenèse.
Le rôle fondamental de SRY a été mis en évidence en 1990.
Le génotype X0 (syndrome de Turner) donne des individus de phénotype femelle, stérile, avec de nombreuses anomalies dont des anomalies cardio-vasculaires.
Le génotype XXY (syndrome de Klinefelter) donne des individus de phénotype mâle, stérile. Les tubes séminifères sont présents, mais sans cellules germinales. On trouve des traits féminins comme la gynécomastie. La présence des deux chromosomes X n’est pas anodine. Un de ces X va être inactivé comme chez les femelles « normales » et donner un corpuscule de Barr.
Malgré l’inactivation de l’un des deux X, des gènes peuvent continuer à fonctionner.
IV Compensation du dosage génique et empreinte génomique parentale (EGP).
A Compensation du dosage génique.
Chez les mammifères, les femelles ont deux X et les mâles, un seul. Il va y avoir mise au silence de l’un des deux X chez la femelle, par inactivation. Ce phénomène rétablit à peu près la quantité de produits synthétisés à partir du seul X actif des mâles.
B L’empreinte génomique parentale.
Cette empreinte se concrétise par l’expression mono-allélique de certains gènes. Pour certains de ces gènes, seul l’allèle paternel sera exprimé ; et inversement. Ces gènes sont soumis à ce phénomène d’EGP ; on dit aussi qu’ils sont « imprimés ». Ces gènes peuvent aussi bien être portés par les autosomes que par les chromosomes sexuels (X).
 Ces deux phénomènes présentent une similitude pour les mécanismes mis en œuvre pour la répression des gènes : méthylation, ARN non-codant.
Ces deux phénomènes présentent une similitude pour les mécanismes mis en œuvre pour la répression des gènes : méthylation, ARN non-codant.
Remarques : Tous les gènes portés par le X inactivé ne sont pas inactifs ! Certains s’expriment, comme ceux de la région pseudo-autosomiale, mais aussi certains gènes portés par le bras court du X (KAL, STS, ZFX).
Xi (X inactivé) est sous forme hétérochromatique (Corpuscule de Barr). On constate qu’il est constitué d’hétérochromatine facultative et de chromatine constitutive.
C L’Inactivation du X.
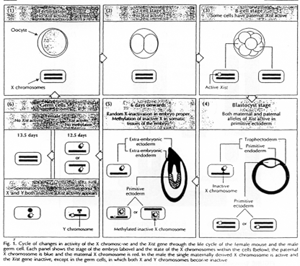
L’inactivation du X, comme l’EGP est un phénomène épigénétique : modification de l’expression des gènes, sans modifier la séquence de nucléotides.
L’inactivation du X est transmise clonalement.
Dans les cellules somatiques, l’inactivation est stable et irréversible. L’inactivation du X et l’EGP sont réversibles dans les cellules de la lignée germinale (pendant la gamétogenèse).
Chez les marsupiaux, l’inactivation du X fait intervenir l’EGP : c’est le X d’origine paternelle qui va préférentiellement être inactivé.
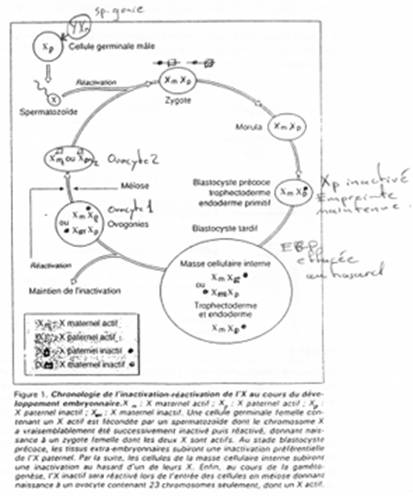
Normalement, l’EGP ne sera pas effacée dans le trophectoderme. Dans le bouton embryonnaire, l’inactivation du X est aléatoire. Dans le trophoblaste, c’est le X paternel qui sera préférentiellement inactivé.
1 Mécanismes d’inactivation du chromosome X..
Deux gènes principaux sont impliqués dans l’inactivation : XIST (chez l’Homme et Xist chez la souris) et TSIX (chez l’Homme et Tsix chez la souris). TSIX : Transcrit spécifique du X inactivé.
Ces deux gènes sont proches l’un de l’autre, dans la région « XIC » (Centre d’inactivation du X) du chromosome.
On pense que dans XIC, se localise Xce (éléments de contrôle de X) mais aussi d’autres gènes à découvrir.
Cette inactivation semble comporter trois étapes : l’initiation / la propagation / la stabilisation.
La délétion de la région XIC de l’un des deux chromosomes X protège le délété de l’inactivation.
Le gène XIST est constitué de plusieurs exons. Le transcrit primaire subit un épissage et une polyadénylation (en 3’). Toutefois, l’ARN de XIST ne sera pas traduit en protéine.
 C’est un ARN non-codant (de grande taille). Chez la souris, il représente 15.000 nucléotides et 17.000 nucléotides chez l’Homme.
C’est un ARN non-codant (de grande taille). Chez la souris, il représente 15.000 nucléotides et 17.000 nucléotides chez l’Homme.
Le gène TSIX est traduit en sens inverse de XIST. C’est aussi un ARN non-codant, antisens.
Le gène XIST n’est transcrit qu’à partir du X inactif (souvent du chromosome d’origine femelle). Son expression précède l’inactivation du X, qu’elle soit liée à l’EGP ou bien qu’elle soit aléatoire.
De nombreux travaux ont montré une corrélation entre le degré de méthylation des îlots CPG (au niveau des régions régulatrices) et l’activité transcriptionnelle des gènes.
Si le promoteur et/ou l’enhancer (amplificateur) sont méthylés, il y aura « silence » du gène.
Quand le promoteur XIST est méthylé, le gène XIST est réprimé.
Par ailleurs, des équipes, en travaillant sur des cellules mâles, en milieu de culture, mettant de la 5-asa-cytidine (inhibiteur de la méthylation sur le carbone 5 de la cytosine) observent que le gène XIST s’expriment initialement mais que dans les cellules qui se divisent, ce gène va cesser de s’exprimer.
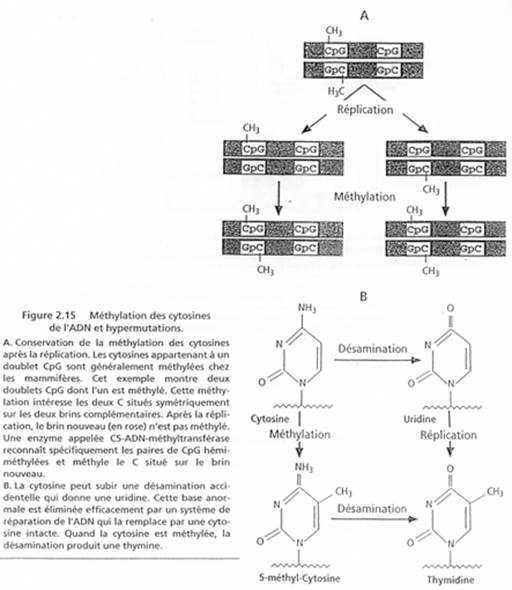
Les deux brins d’ADN sont méthylés. Si XIST s’exprime, le X sera inactivé.
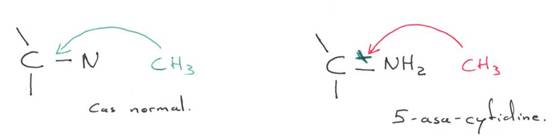
2 La phase de propagation.
Au début, les ARN sont instables. Ils doivent être stabilisés. L’ARN de XIST agit comme s’il habillait le chromosome.
Des protéines vont intervenir pour stabiliser cette ARN de XIST. Ces protéines de stabilisation entrent en contact avec les protéines de la chromatine.
3 La phase de stabilisation.
La stabilisation demande des modifications de la chromatine :
- Méthylation des promoteurs.
- Dé-acétylation des histones.
- Modification de la chromatine (dont l’intervention de macro H2A).
Dans les embryons normaux, au stade blastocyste, les cellules du trophoblaste des embryons mâles et celles des embryons femelles, expriment le gène TSIX et ce, uniquement à partir du chromosome maternel.
 Pour les embryons mâles, le X maternel est actif (Xa)
Pour les embryons mâles, le X maternel est actif (Xa)
 Pour les embryons femelles, le X maternelle est également actif (Xa) mais le X d’origine paternelle est inactif (Xip).
Pour les embryons femelles, le X maternelle est également actif (Xa) mais le X d’origine paternelle est inactif (Xip).
On a une expression exclusive de XIST ou de TSIX. Sur le X maternel, TSIX ne s’exprime pas.
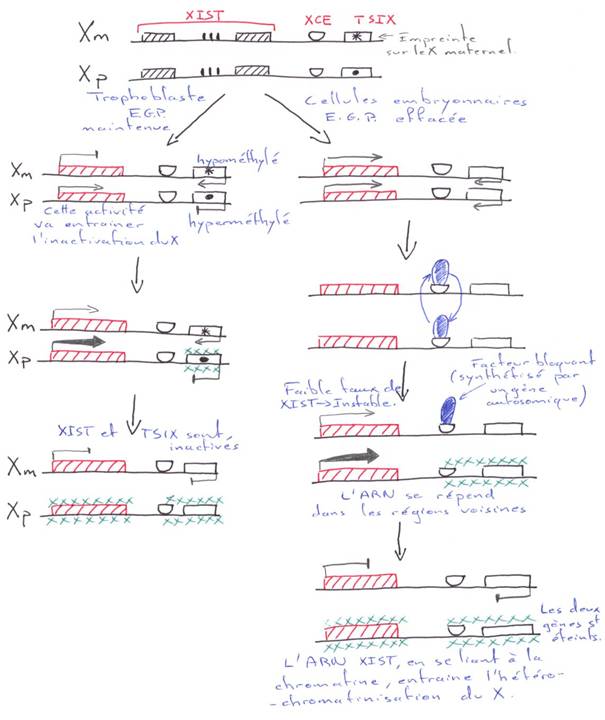
4 Dans les cellules embryonnaires.
L’ARN de XIST est instable (< XIST trophoblastique).
Sur le X qui ne va pas être inactivé, un « facteur » vient arrêter le fonctionnement de XIST.
Lorsque l’on a un surnombre de X, on peut se demander comment se fait « le comptage » des X. En fait, on suppose que le fonctionnement de ce comptage est similaire au mécanisme vu précédemment.
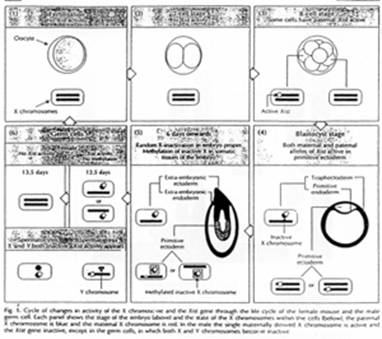
Pendant la méiose, il y « réactivation » du X pour la mise en place de l’EGP.
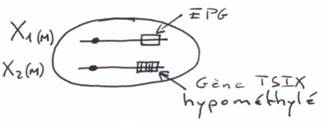
Chez le mâle :
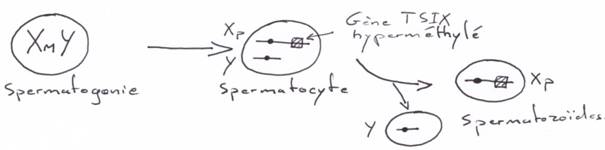
5 La fécondation.
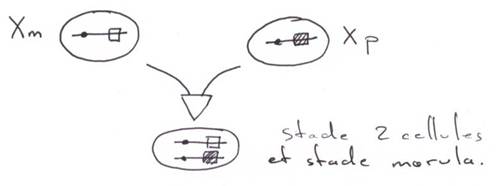
Au stade deux cellules, les gènes zygotiques ne s’expriment pas encore.
Au stade morula (8 cellules), il y aura début de transcription des gènes qui nous intéressent.
Au stade blastocyste, deux mécanismes interviennent : au niveau du trophectoderme, il y a inactivation du X grâce à l’EGP.
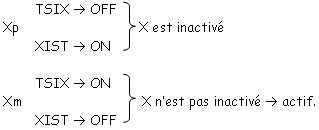
Dans le cas du blastocyste tardif, on a ici une inactivation du X au hasard, après l’effacement de l’EGP.
Dans l’endoderme primaire et les cellules trophoblastiques, voir le cas au-dessus.
Quand XIST est ON, cela entraîne un Xi (inactif) ; quand XIST est OFF, on a Xa (actif).
TSIX régule négativement XIST.
:
Si l’EGP n’est pas effacée, il y a des problèmes du développement embryonnaire.
V La détermination du sexe chez les mammifères.
Le TDF (Facteur Déterminant la formation du Testicule) est porté sur le bras court du Y. Plusieurs gènes ont été supposés être ce TDF : HY (avec des essais sur le bras court uniquement), puis ZFY (mais ZFY est absent chez les marsupiaux, donc ce n’est pas ça).
Les caractéristiques du TDF :
- Il doit se trouver sur le Y de tous les mammifères,
- Il doit être dans le segment chromosomique déterminant le sexe,
- Il doit être absent ou modifié chez un individu XY de phénotype femelle,
- Il doit être exprimé pour permettre la différenciation testiculaire.
SRY a été identifié et localisé en 1990. On parle de SRY chez l’Humain et de Sry chez la souris. SRY : Région du Y déterminant le Sexe.
On a utilisé un transgène pour vérifier que c’était bien SRY qui correspondait au TDF. On a pu isoler un fragment d’ADN de 24 à 25kB (séquence identique chez l’Homme et la souris).
Les souris transgéniques réalisées avaient un caryotype XX avec le gène supposé être le TDF  Souris XX-Sry+ : c’étaient des souris avec des gonades mâles (testicules).
Souris XX-Sry+ : c’étaient des souris avec des gonades mâles (testicules).
On trouve ailleurs des cas « intéressants » chez des individus XX mâles ou XY féminins, etc.… Ces individus ont permis d’isoler la séquence de 24kB portant SRY.
A Relations génotypes/phénotypes.
Le 1er cas est celui d’un mâle normal, XYSRY+.
On peut ensuite trouver un mâle XX. En réalité, cet individu n’a pas SRY (cas C). Dans le cas d’un individu mâle XX-SRY-, il va y avoir une mutation d’un gène porté par le X (DAX1).

Les gènes mâles spécifiques s’expriment si les produits de « Z » sont inhibés par SRY. SRY est monoexonique. C’est une protéine faisant 233 acides aminés. SRY possède une boite de fixation à l’ADN (boite HMG : High Mobility Group). Cette boite provoque une courbure de l’ADN  c’est un facteur de transcription.
c’est un facteur de transcription.
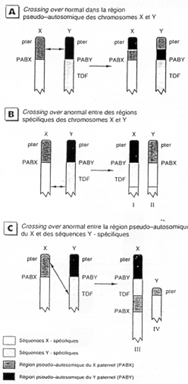
En A, on a un cas normal.
En B, on observe un crossing-over en dehors de la région pseudo-autosomale. Le gène SRY se retrouve sur le chromosome X (X-SRY+ et Y-SRY-).
Le gène SRY se retrouve sur le chromosome X (X-SRY+ et Y-SRY-).
En C, on a un crossing-over très inégal où SRY se retrouve sur X.
Dans le cas d’un individu femelle XY-SRY+, il va exister des mutations ponctuelles, toutes localisées dans la boite HMG.
Il existe également le cas d’individus XY qui présentent une duplication de XP21. SRY est présent. Cette duplication d’une région du chromosome X entraîne l’expression de DSS ( DAX1) Dosage Sensitive Sex reversal.
DAX1) Dosage Sensitive Sex reversal.
Dans le cas des femelles XY-SRY+, le gène Sry donne un produit anormal ou pas de produit du tout : les gènes mâles spécifiques sont donc réprimés.
Normalement, le sexe génomique est responsable du sexe gonadique (du phénotype de l’individu).
1 Cas « normaux » de l’espèce humaine.
On prend une femme (XX). On suppose qu’elle possède un gène (Z) qui est porté par un chromosome X. Le produit de Z est responsable de la répression des « gènes mâles » spécifiques.
Chez un homme normal, l’action de Z est contrée par la protéine Sry.
2 Cas présentant des anomalies sur les hétérochromosomes.
- Femmes XY : il y a mutation sur Z, de sorte que Sry ne puisse plus contrer les produits de Z. Les gènes mâles spécifiques sont inhibés.
- Hommes XX : les produits de Z ne se fixent pas : il y a répression des gènes mâles spécifiques.
- Les individus X0 : ils présentent un développement des ovaires.
- Cas de Xp21 : il y a duplication de la zone Xp21 du bras (sur le bras court). Ceci provoque une ambiguïté sexuelle ou une réversion totale. On observera un phénotype femelle.
3 Cas mettant en cause un gène porté par un autosome.
Les gènes pouvant intervenir dans la différenciation sexuelle « normale » sont des gènes appartenant à la famille SOX (SRY HMG box containing). Ils codent pour des protéines non histones de la chromatine. A l’heure actuelle, on connaît une vingtaine de gènes SOX.
- SOX9 : quand ce gène est muté, il est responsable de campomélisme (ou dysplasie campomélique) : anomalies osseuses, cartilagineuses et inversion sexuelle. Il y a une homologie d’environ 50% entre les boites HMG SOX9 et HMG SRY.
- SOX3 : il est porté sur le bras long du chromosome X. Les boites HMG SOX3 et HMG SRY ont une homologie d’environ 74%. On pense que SOX3 et SRY dériveraient d’un ancêtre commun. SOX3 s’exprime dans les crêtes génitales, comme SRY, mais aussi dans d’autres tissus, comme le cerveau (cellules nerveuses).
Remarque : en général, les gènes cibles des protéines SOX sont inconnus. Dans le cas de SOX2, on connaît la cible. Il s’exprime notamment au niveau du cristallin.
B Différenciation sexuelle.
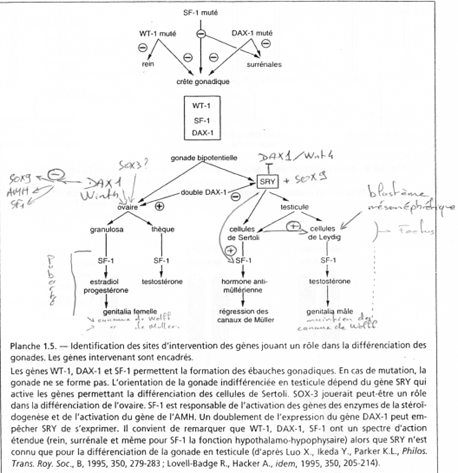
Si SF1 est muté, les surrénales et les crêtes génitales ne se forment pas. Si WT1 est muté, il n’y a développement, ni des reins, ni des crêtes génitales. WT1 : sur le bras long du chromosomes 11 humain. SF1 : sur le bras long du chromosome 9 humain. DAX1 : sur le bras court du chromosome X humain. SOX3 : localisation ? Fonction précise ?
Chez les vertébrés, la gonadogenèse implique l’activité de gènes régulateurs de la différenciation sexuelle, mais aussi, l’action de certaines hormones participant à la formation et au développement des organes sexuels à partir d’ébauches « neutres ».
1 La formation des gonades.
a Les crêtes génitales.
Les ébauches apparaissent sous la forme de deux invaginations de la somatopleure initiale, de part et d’autre du mésentère dorsal.
Il va y avoir un épaississement et un creusement de l’épithélium coelomique.
Dans l’embryon humain, les crêtes génitales se forment au stade neurula âgée (4 semaines) sur la bordure interne du mésonéphros. Les premières ébauches sont dépourvues de cellules germinales. Les gonocytes primordiaux colonisent les crêtes vers 6 semaines. Dès la troisième semaine, les gonocytes sont repérables dans l’embryon.
Les cellules primordiales migrent le long du mésentère dorsal de l’intestin postérieur vers les crêtes génitales. Elles sécrètent un facteur chimiotactique : le GDF9 (famille TGFβ).
On est au stade des gonades indifférenciées qui dure un certain temps.
Pendant la colonisation par les gonocytes, l’épithélium coelomique prolifère : il va former les cordons sexuels primitifs.
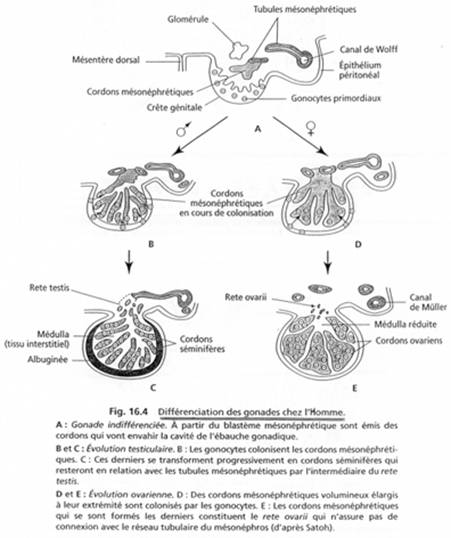
Les cellules épithéliales vont entourer un certain nombre de gonocytes. Dans les deux sexes, ces cordons sont en relation avec la surface épithéliale.
b Evolution testiculaire.
Si l’individu est XY, les cordons sexuels primitifs vont continuer de proliférer et envahir la médulla de la gonade. Ils forment les cordons de la gonade. Ces cordons vont perdre leur connexion avec le cortex ; ils s’étirent en profondeur, jusqu’au hile de la gonade.
Entre les cordons et le cortex se glisse une couche épaisse de mésenchyme qui deviendra l’albuginée.
Le cortex involue car les gonocytes sont tous passés dans les cordons testiculaires médullaires.
Vers le 4ème mois, les cordons testiculaires prennent l’aspect de anse dont les extrémités se rapprochant donnent les tubes droits. Pendant la vie fœtale, on ne parle que de cordons testiculaires (ils ne sont pas encore creusés).
Les gonocytes primordiaux, entourés de cellules de soutien donneront les cellules de Sertoli.
Les cordons restent pleins jusqu’à la puberté. Là, ils vont se creuser et devenir les tubes séminifères. Ils se connectent également au Rete testis. Les canalicules de ce Rete testis s’accrochent aux tubules mésonéphrétiques et donnent ainsi les canaux efférents. Ces canaux vont rejoindre le canal de Wolff qui donnera le canal déférent.
Les cellules de Leydig apparaissent avant les tubes séminifères. Elles sont abondantes entre 4 et 6 mois de gestation. Elles forment le tissu endocrine du testicule.
c Evolution ovarienne.
Les cordons sexuels primitifs se fragmentent en amas dans la zone médullaire. L’épithélium gonadique reste épais et continue à proliférer.
Il se passe une nouvelle poussée de cordons sexuels secondaires (ou corticaux). La région corticale prolifère. Ces cordons vont se détacher légèrement puis se fragmenter.
Les ovogonies se divisent par mitose et entrent vite en prophase 2 de méiose. Cette entrée en méiose s’accompagne d’un « encerclement » de cellules venant de l’épithélium coelomique (les cellules folliculaires). Les follicules primordiaux sont dans la région corticale.
Les cellules folliculaires vont ensuite s’entourer de cellules issues du mésenchyme mésonéphrétique (les cellules médullaires) qui donneront les thèques.
Les gonoductes présents sont :
- Le canal de Wolff (qui donnerait les spermiductes chez un mâle) ;
- Le canal de Muller qui donnera un oviducte chez la femelle.
L’évolution de ces canaux est en relation avec les cellules permettant la néphrogenèse.
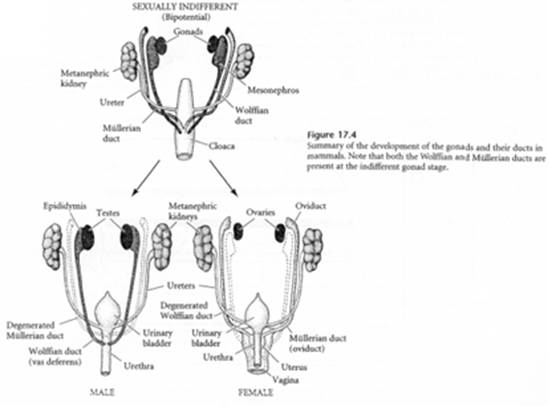
Au début, on a la coexistence et du canal de Muller et du canal de Wolff. Ils auront par la suite des évolutions distinctes.
· Chez le mâle, les cellules de Sertoli sécrètent une hormone anti-Mullerienne (AMH). C’est une lipoprotéine homodimérique avec des cystéines (qui permettent la formation de ponts di-sulfures entre les 2 sous unités). Les cellules de Leydig sécrètent tôt la testostérone qui permet de maintenir les canaux de Wolff et de les faire évoluer en canal déférent, vésicule séminale…
· Chez la femelle, il n’y a pas de synthèse d’AMH (sinon, à un taux insignifiant) ni de testostérone : les canaux de Wolff dégénèrent alors que ceux de Muller persistent.
d La gonade bipotentielle.
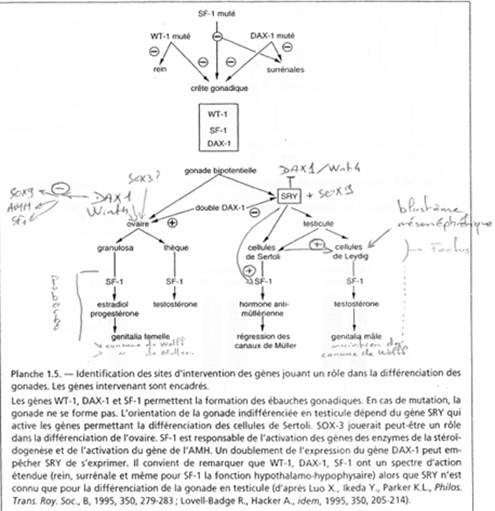
· Le cas des mâles.
Il y a expression de SRY et de SOW9 avant la différenciation des cellules de Sertoli (cellules pré-Sertoliennes). Les cellules du blastème mésonéphrétique sont induites par les cellules de Sertoli en cellules de Leydig. Les cellules de Sertoli expriment le gène SF1 dont le produit a pour cible un récepteur nucléaire.
Chez le mâle, ceci a lieu au stade fœtal ; SF1 est stimulé par SRY (par l’intermédiaire d’un récepteur nucléaire).
Les cellules de Leydig produisent SF1 qui va stimuler les gènes de la stéroïdogenèse, et donc, la synthèse de testostérone. Cette dernière stimule le développement et maintient les canaux de Wolff.
Pour la mise en place des organes externes, la testostérone, sous l’action de 5-alpha-réductase, est modifiée en 5-diHydroTestostérone (5dHT). C’est cette dernière qui favorise la mise en place des organes génitaux externes mâles.
· Le cas des femelles.
Revoir le schéma précédent
DAX1 stimule la formation de l’ovaire. Comme chez le mâle, SF1 s’exprime. A la puberté, SF1 va stimuler la stéroïdogenèse qui aboutira à la synthèse de progestérone et d’oestradiol.
Remarque : On a prouvé chez la souris que Wint4 était nécessaire à la différenciation ovarienne. S’il est délété ou muté, on observera une différenciation testiculaire.
2 Rôle du X sur l’expression de SRY.
Les travaux de Fregdor ont confirmé ses hypothèses sur le lemming (Myopus schisticolor). Il existe chez ces animaux 3 types de caryotypes femelles : XX, X*X et X*Ysry+.
X* est un X résultant de l’inversion du bras court du X avec une mutation qui réprime l’effet masculinisant de Y.
La non disjonction des XX au moment de la méiose a une fréquence assez élevée dans cette espèce.
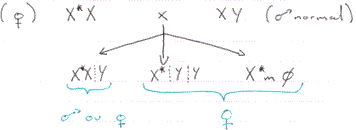
Dans le cas de X*XY, tout dépend du X qui sera inactivé :
- X* est inactivé : on a XY : phénotype mâle.
- X est inactivé : on a X*Y : phénotype femelle.
Remarques :
- On ne connaît pas le déterminant sexuel dans le déterminisme de type Abraxas (ZW) Sox3 est tout de même présent.
- Contrairement à la drosophile où la différenciation sexuelle est mâle par défaut, il n’y a pas de sexe par défaut chez les mammifères.
Le facteur de transcription Gata.
Le facteur Gata4 est impliqué dans l’hématopoïèse (chez la drosophile comme chez l’Homme). Sa structure est très conservée.
(A) : Sox9 se lie à l’ADN (sur le promoteur du gène codant pour l’AMH). La synthèse est minimale (basale).
(B) : Plus tard, SF1 se fixe sur le promoteur avec Wt1 (sur SF1). Ce complexe permet une transcription active.
(C) : L’intervention de Gata4 est finale et rend très active la transcription d’AMH.
Remarque : l’inversion sexuelle par SOX9 se fait avec une mutation ponctuelle dans l’enhancer du gène codant pour SOX9.
Dans le fœtus mâle, après quelques semaines, il y a une forte sécrétion de testostérone par les cellules de Leydig. Elles sont stimulées (et leur libération de testostérone également) par l’HCG libéré par le trophoblaste. Il va ainsi y avoir une imprégnation des centres nerveux par la testostérone. Ceci permet de donner le sexe psychique (social) à l’individu.