• La fixation des Ag est réalisée sur une plaque spécialement traitée pour fixer les protéines. Cette fixation est en général réalisée par un tampon basique.
• Les étapes de lavage sont effectuées avec des tampons contenant des détergeants doux qui permettent de retirer tout ce qui est fixé de manière non-spécifique. Pendant le lavage, on ajoute des protéines de saturation.
• Le conjugué : c’est un complexe entre un Ac ou un Ag et une enzyme. On utilise la péroxydase du radis (raifort)  H2O2
H2O2  H2O + ½ O2. La phosphatase alcaline qui enlève les protéines si elle est en milieu basique. Ces enzymes sont fixées de manière covalente grâce au glutaraldéhyde qui forme un pont entre l’enzyme et l’Ac ou l’Ag. Quand on doit fixer des sucres, on utilise le périodate de sodium.
H2O + ½ O2. La phosphatase alcaline qui enlève les protéines si elle est en milieu basique. Ces enzymes sont fixées de manière covalente grâce au glutaraldéhyde qui forme un pont entre l’enzyme et l’Ac ou l’Ag. Quand on doit fixer des sucres, on utilise le périodate de sodium.
Etude du système du complément.
Introduction.
La découverte de ce système du complément remonte à la fin du 19ème siècle et fait suite à plusieurs observations concernant l’activité bactéricide de sérum provenant d’animaux immunisés.
Cette activité disparaît après un chauffage (30 minutes à 56°C). L’activité de ces sérums chauffés peut être restaurée par addition de sérum non immun, fraîchement prélevé.
Le sérum non immun est ainsi considéré comme un complément à l’activité bactéricide des anticorps présents dans le sérum immun.
Remarques :
Cette découverte coïncide avec la découverte de la phagocytose par Elie Metchnikoff (en 1880). Il travaillait sur des étoiles de mer dont les cellules mésodermiques pouvaient avaler et dégrader des cellules étrangères (vivantes et inertes).
Pasteur a réalisé le 1er vaccin le 6 juillet 1885.
Le complément était considéré comme une seule substance thermolabile, mais il est apparu comme un système complexe de substances plasmatiques présentes dans tous les sérums, à l’état inactif. L’activation de ce système est consécutive à la pénétration d’un élément antigénique. L’activation aboutit à l’apparition de facteurs activés, solubles, et de facteurs activés, fixés sur des particules antigéniques qui rendent compte de 3 grandes fonctions effectrices de ce système.
- L’opsonisation (très particulièrement) des particules antigéniques,
- Une activité pro-inflammatoire permettant un afflux localisé du système immunitaire,
- Une activité lytique.
I Les différents facteurs et voies d’activation.
A Nomenclature.
Les protéines solubles plasmatiques de ce système du complément concernent l’activation. Elles peuvent être regroupées en trois grandes unités fonctionnelles :
· Deux unités d’activation, qui, chacune, se caractérise par une série d’étapes protéolytique au cours desquelles, une sérine-protéase (forme proenzyme) est clivée et donne un facteur activé (avec activité enzymatique) qui activera à son tour un autre facteur.
· Une de ces voies est appelée la voie classique alors que l’autre voie est la voie alterne. Ces voies impliquent des facteurs distincts mais toutes deux génèrent une même activité enzymatique, liée (fixée) à la surface antigénique (C3C5 convertase). Cette activité va initier la deuxième étape d’activation du complément : la troisième unité fonctionnelle è l’unité effectrice. Cette dernière unité est appelée ainsi car cette étape aboutit à la formation d’un complexe d’attaque membranaire (CAM) qui est responsable de la lyse des microorganismes.
1 Les composants de la voie classique.
Ces composants sont désignés numériquement de C1 à C9. Ils réagissent dans un ordre bien précis : C1 – C4 – C2 – C3 – C5 – C6 – C7 – C8 – C9.
Ce sont des protéines ou des glycoprotéines comportant de 1 à 3 sous-unités polypeptidiques (α, β et γ). L’activation de ces facteurs par des protéases, libère deux types de fragments activés : un fragment de petite taille (forme a) et un grand fragment (forme b). Par exemple, C3 donne C3a (petit) et C3b (grand).
Une exception existe pour C2 où C2a est le grand fragment et C2b est le petit fragment.
2 Les composants de la voie alterne.
Ces composants sont désignés par des lettres : B, D, H, I et P.
B La voie classique.
Cette voie est la voie déclenchée suite à la présence de complexes Antigène/Anticorps (solubles ou particulaires). C’est une voie qui se réalise dans le cadre de la réponse spécifique, adaptative.
Remarque : L’IgG4 n’active pas le complexe.
Cette voie est initiée par la fixation de C1 (C1q) au domaine constant des chaînes lourdes des Ig. : au CH2 des IgG (ont trois domaines constants et un variable) ou au CH3 des IgM (ont quatre domaines constants et un variable).
Remarque : Les IgM interviennent dans la réponse primaire alors que les IgG interviennent plus particulièrement dans la réponse secondaire.
Cette voie est également activée lors de la réponse immunitaire immédiate (non spécifique) par l’interaction du C1 à divers composants de microorganismes (bactéries, virus) selon deux mécanismes nécessitant l’implication des protéines de l’inflammation de phase aiguë. Il est sous l’action de cytokines (synthétisées par les macrophages) : IL1, IL6 et TNFα. D’autres protéines vont être synthétisées par le foie (protéines de l’inflammation de phase aiguë).
· La CRP (sert à diagnostiquer un état inflammatoire) va se lier à des résidus de phosphorylcholine de la paroi des microorganismes. Quand elle est liée, elle active le C1 (elle a une activité enzymatique).
· La MBP (ou MBL) a une structure proche de la sous unité C1q, constitutive du facteur C1. Associée à cette structure, on trouve une sérine-protéase. En se liant aux résidus mannose de la surface des microorganismes, l’activité sérine-protéase est démasquée et l’activité enzymatique libérée est proche de l’activité de C1. IL y aura donc une activation du facteur C4. La liaison au mannose provoque une activité opsonisante directe car il y a interaction avec un récepteur au mannose des cellules phagocytaires.
Cette cascade aboutit, dans un premier, à la génération d’une activité sérine-protéase (la même que l’activité du C1). Dans une deuxième temps, on observe une activité C3/C5 convertase.
 C’est un système bis C1.
C’est un système bis C1.
C’est la voie nommée « troisième voie » ou « voie des lectines ».
1 L’activité C1 – Sérine-protéase.
L’activation se fait sur la surface antigénique.
Le C1 est un complexe moléculaire composé de trois types de molécules Ca-dépendantes (sous unités réunies par le calcium).
C1q (interagit avec l’antigène via l’Ig), 2 fois C1r et 2 fois C1s. C1r et C1s sont des proenzymes. Le poids moléculaire du complexe est environ de 750.000Da.
C1q est une molécule composée de 18 chaînes polypeptidiques réunies 3 par 3. Cet ensemble a une conformation spatiale rappelant celle d’un « bouquet de 6 tulipes ». Chaque « fleur » comprend 3 chaînes polypeptidiques. Dans la partie C-terminale, on observe une conformation globulaire. LA région centrale et la région N-terminale sont en triple hélice (liaisons par des ponts di-sulfures).
Dans la région centrale viennent se disposer deux molécules de C1r et de C1s. L’interaction des régions C-terminales de C1q à au moins deux molécules d’IgG ou à une IgM (pentamérique, avec domaine CH3) entraîne une modification conformationelle du C1 qui est responsable d’une auto-activation des deux sous-unités C1r. Ces deux sous-unités vont alors démasquer leur site actif de sérine-protéase. Cette activité clive (protéolyse) les sous-unités C1s et génère alors une nouvelle activité enzymatique sérine-protéase, capable de cliver une gamme de protéines : il va y avoir clivage des facteurs C4 et C2 de ce système et génération d’une activité C3 et C5 convertase.
2 L’activité C3 et C5 convertase.
Ces enzymes ont pour substrat le C3 et le C5.
Sur le complexe C1-Ig vient se fixer le C4. Ce dernier est une glycoprotéine de 3 chaînes polypeptidiques (α, β et γ) reliées par des ponts di-sulfures.
Le C1s va cliver la chaîne α du C4 (la grande chaîne) et libérer un petit peptide (le C4a, une anaphylatoxine) et un petit peptide, le C4b qui se fixe sur la surface activatrice (antigénique) par liaison covalente.
La chaîne α a une liaison thioester interne qui s’établit enter le groupement carbonyle de l’acide glutamique et le groupement SH d’une cystéine.
Le clivage de la chaîne α va entraîner la coupure de ce pont et le groupement C=O va aller agir avec les groupements aminés des protéines antigéniques ou bien avec les groupements hydroxyles de glycoprotéines et de glucides.
Une grande partie du C4b réagit avec les molécules d’eau environnantes : il y a de cette manière formation d’un composé inactif, le C4bi.
La fixation sur l’antigène libère le site de fixation de C2 qui agit avec du Mg. Il se forme ainsi, à proximité de C1, les complexes C4bC2. Au niveau de ces complexes, le C2 est clivé par l’action de l’activité sérine-protéase du C1s. Il y a libération d’un petit fragment, le C2b, et d’un grand fragment (le C2a).
Au niveau de C2a, il y a un nouveau site enzymatique qui est démasqué (site sérine-protéase) quand il se fixe au C4b.
Les complexes C4bC2a, à proximité du C1, correspondent à la C3 convertase classique : c’est un complexe qui va catalyser le clivage du C3 et aboutir à la génération d’une activité C5 convertase et à un dépôt sur la surface antigénique d’un grand nombre de molécules de C3b.
Le C3 est le facteur plasmatique le plus abondant et celui dont l’effet biologique est le plus important (par sa qualité d’opsonisant). Ce facteur est formé de deux chaînes polypeptidiques. C4bC2a fixe une molécule de C3 et clive la chaîne α, libérant ainsi le C3a (petit fragment) soluble (et anaphylactique) et le C3b (le grand fragment) qui établit une liaison à la surface antigénique (même chose que pour le C4).
Cette fixation prévient d’une dissémination dans l’organisme du C3b (qui est opsonisant). C3b peut être inactivé, comme le C4, avec des molécules d’eau et formant alors le C3bi.
La C3 convertase est très active et génère jusqu’à 200 molécules de C3b fixées sur la paroi antigénique. Certaines de ces molécules restent fixées au complexe C4bC2a et donnent C4bC2aC3b aussi appelé C5 convertase.
Par activité de la sérine protéase de C2a, d’autres molécules de C3b vont activer la voie dite « alterne » du complément, résultant en une auto-amplification considérable de la formation du C3b.
Le complexe C4bC2aC3b va cliver le C5 et participer ainsi à la première étape de formation du CAM (complexe d’attaque membranaire) qui est commun aux deux voies d’activation.
C La voie alterne d’activation.
Cette voie est activée en absence du complexe Antigène/Anticorps. Elle constitue un évènement déterminant (central) de la réponse immunitaire non spécifique (et immédiate). En parallèle, on aura déclenchement de la réaction inflammatoire et accroissement de la phagocytose.
1 Activation basale du C3 en solution.
Cette voie est initiée par la fixation du C3b sur toute une variété de surfaces antigéniques (bactéries, virus, champignons) ou par la présence de complexe Antigène/IgA.
La présence du C3b est liée à une activation permanente basale du facteur C3 quand il est présent dans le plasma.
En solution aqueuse, C3 présente une faible hydrolyse de sa liaison thioester, donnant un composé (C3-H2O), instable mais capable de lier (fixer) un facteur soluble de la voie alterne, B.
Au niveau de ces complexes, le facteur B (homologue structural et fonctionnel de C2) est clivé sous l’action d’une enzyme plasmatique (enzyme D). B est clivé en Ba et Bb restant lié au C3-H2O. Bb présente une activité sérine-protéase (comme C2a).
 Il va y avoir formation de C3 convertase soluble (très instable) qui peut fixer du C3 et cliver cette molécule en C3b et C3a.
Il va y avoir formation de C3 convertase soluble (très instable) qui peut fixer du C3 et cliver cette molécule en C3b et C3a.
2 Apparition de l’activité C3 etC5 convertase alterne (Anticorps / Antigène).
En présence d’éléments étrangers, C3b se fixe sur l’antigène par l’intermédiaire d’un groupement carboxyle et fixe alors une molécule de B (formation de C3bN*). Il y a ensuite action de D qui libère Ba (soluble) et Bb qui présente une activité sérine-protéase (C3bBb*).
Ces complexes vont lier un autre facteur (le facteur P ou Properdine) qui rallonge la ½ vie de ces complexes (passe de 5 minutes à 30 minutes) dont le substrat sera le C3 (c’est une boucle d’amplification).
 C3 est à la fois produit et activateur.
C3 est à la fois produit et activateur.
Ceci permet d’avoir un dépôt d’un grand nombre de molécules de C3b sur les antigènes.
Certaines molécules de C3b restent fixées en complexes trimoléculaires ou tétramoléculaires, correspondant à la C5 convertase alterne.
 C’est la 1ère étape du CAM (complexe d’attaque membranaire).
C’est la 1ère étape du CAM (complexe d’attaque membranaire).
D Formation du CAM.
Sous l’action de la C5 convertase classique ou alterne, vient se fixer une molécule de C5 (deux chaînes) qui subit un clivage par l’action de C2a (ou Bb) sérine-protéase. Il y a alors libération de C5a (anaphylatoxine) et de C5b restant lié au complexe et ayant un site de fixation spécifique (mais relativement labile) pour le C6.
A partir de là, on n’aura plus de clivage enzymatique.
Le complexe C5bC6 (lié au C3b) fixe une molécule de C7 et forme le complexe C5bC6C7 qui est amphiphile. Ce complexe va ainsi pouvoir s’insérer dans les membranes.
C5bC6C7 va fixer une molécule de C8 qui interagit avec le C9 ; ce qui déclenche la polymérisation de plusieurs molécules de C9 dans la membrane de l’antigène (on retrouve de 11 à 16 molécules de C9 agrégées). Ainsi, il se forme (grâce au C9) des pores d’environ 10 nanomètres de diamètre qui sont responsables de la lyse des cellules (et donc de la mort des cellules).
E Mécanismes de contrôle (régulation) des voies d’activation.
Les facteurs activés sont fixés sur la surface antigénique par des liaisons covalentes (C4b et C3b). Toutefois, l’activation en solution de certains facteurs (dont le C3) pourrait aboutir à un dépôt sur nos propres cellules et les détruire. En fait, nos propres cellules sont protégées par la présence d’inhibiteurs physiologiques qui vont limiter les effets des facteurs activés aux surfaces du non-soi (antigénique), tout comme de nombreux facteurs qui limitent le processus de la coagulation sanguine aux surfaces endothéliales lésées.
Les effets biologiques de l’activation du complément sur les particules antigéniques n’apparaissent que lorsque la concentration en facteurs activés atteint localement un niveau suffisant pour déborder l’action des inhibiteurs physiologiques (même principe que pour la coagulation sanguine).
1 Contrôle de l’activation des voies classiques et alternes.
Plusieurs inhibiteurs physiologiques, soit solubles, soit membranaires, s’opposent à ces deux voies où inhibent l’activité des convertases.
a C1 inhibiteur (soluble).
Cette molécule fixe la sous-unité C1q et donc, provoque une dissociation des 23 sous-unités et bloque l’apparition de l’activité du C1s.
Le C1 inhibiteur fait parti de la famille de SERP IN qui est un inhibiteur des sérines-protéases. è Il y a action contre la voie classique.
b Inhibition des C3 et C5 convertases (classique/alterne).
· C4-BP (soluble)
Cette molécule est une protéine liant le C4.
· DAF.
C’est l’équivalent membranaire du C4-BP.
Ces deux facteurs ont une affinité pour le C4 et dissocient les complexes C4bC2a (inhibent l’activité C3 convertase).
DAF est sur les cellules sanguines, endothéliales, épithéliales. Ce sont des compétiteurs du C2a pour le C4b.
La liaison du C4b au C4-BP forme un complexe devenant sensible à la protéolyse par une enzyme plasmatique (l’enzyme I) qui est constitutivement active. Le complexe formé est C4BPC4b. Il y aura ensuite clivage du C4b en petits fragments inactifs : C4c + C4d.
Un mécanisme analogue intervient pour inhiber le C3b au sein des complexes convertasiques. Sur les cellules, il existe une molécule (CR1 : récepteur du complément) qui lie le C3b en le dissociant des complexes convertasiques : le CR1C3b est sensible aussi à l’enzyme I qui clive le C3b en fragments inactifs (C3c et C3dg)
Comme pour le C4b, il existe un inhibiteur soluble : le facteur H qui est plasmatique. Le complexe formé est C3bH qui est également sensible à I.
2 Contrôle de l’activation du CAM.
Le principal facteur est plasmatique : facteur S ou vitronectine. Il va se lier au C7 dans les complexes C5bC6C7 et donner des complexes hydrophiles solubles incapables de s’insérer dans la membrane.
Le contrôle se fait aussi par des facteurs membranaires : par la Protectine (ou CD59). Cette molécule est fortement exprimée sur la membrane de nos cellules. Elle lie le C8 dans des complexes, ce qui empêche la polymérisation et l’insertion dans les membranes.
HRF (ou Facteur de Restriction Homologue) a la même activité que CD59 mais est membranaire.
Certains individus ont une absence congénitale de certains facteurs inhibiteurs comme le CD59 et le DAF. Ils vont développer une pathologie caractéristique : l’hémoglobinurie. Celle-ci va atteindre des paroxysmes nocturnes.
L’absence de ces deux facteurs et l’activation nocturne du complément par une diminution du pH durant la nuit entraîne une lyse de globules rouges.
II Les activités biologiques du complément.
A La lyse des agents pathogènes.
La destruction des agents pathogènes se fait par formation du PolyC9 au CAM. L’insertion du polyC9 va permettre la mise en place de larges pores déstabilisants les membranes. Les cellules atteintes par cette attaque vont perdre leur homéostasie (sortie de K+, entrée de Na+, d’eau) mais aussi par la pénétration d’enzymes (comme dans les lysosomes) qui sont responsables de la destruction des pathogènes.
Cette activité lytique est spectaculaire quand elle concerne la lyse des globules rouges mais le complément ne reste pas moins qu’un élément mineur dans le système de défense et, ainsi, les individus ayant une déficience congénitale en C9, ne montrent pas de sensibilité plus grande aux infections, quelles qu’elles soient.
Ceci n’est pas le cas pour le deux autres effets du complément : l’opsonisation et l’inflammation.
B L’opsonisation.
L’opsonisation est l’effet central, capital, de ce système. C’est le processus qui facilite la capture et la dégradation des antigènes par les cellules phagocytaires. Ce processus résulte de la reconnaissance spécifique de divers facteurs du complément par des récepteurs dits « CR » présents sur les cellules phagocytaires.
L’opsonisation est une fonction majeure du C3b qui est fixé en grand nombre sur une particule antigénique. Le C4b est aussi opsonisant mais avec un plus petit effet (car il est moins présent).
Sur ces cellules, quatre récepteurs (CR) ont été caractérisés (de CR1 à CR4).
1 Le CR1 (ou CD35).
Le CR1 est le récepteur au C3b et au C4b (les facteurs fixés). Il est exprimé sur presque toutes les cellules phagocytaires (monocytes sanguins, macrophages, polynucléaires neutrophiles et éosinophiles) mais aussi sur les cellules non phagocytaires comme les globules rouges, les lymphocytes B et les cellules dendritiques folliculaires.
L’interaction CR1-C3b sur les cellules phagocytaires va renforcer l’immunodéficience des phagocytes sur la cellule antigénique (et aussi la phagocytose). Cette activité opsonisante de C3b est fondamentale au début de la réponse immunitaire en l’absence d’Ig directement opsonisante (IgG).
Cette classe d’Ig est fortement présente en réponse secondaire (les IgG). En réponse primaire, on trouvera plutôt des IgM qui ne sont pas directement opsonisante (pas de récepteur au fragment Fc des phagocytes). Les IgM sont indirectement actives par activation du complément.
Certains individus ont une déficience en C3 : ils vont avoir de graves infections pouvant être létales. On parle dans ce cas d’une réelle immunodéficience.
Sur les globules rouges, l’expression membranaire de CR1 permet la fixation et le transport des complexes Ag/Ac circulant, recouverts par C3b. Ce transport ira jusqu’à la rate ou bien au foie (action des macrophages spléniques ou celles de Kuppfer).
La clearance est une fonction des complexes immuns qui prévient d’un dépôt de ces complexes dans les capillaires sanguins et particulièrement dans les capillaires des glomérules rénaux. S’il y avait des accumulations dans ces capillaires, cela pourrait provoquer de graves atteintes rénales.
Pour les lymphocytes B, le CR1, en se liant au C3b, transduit un signal intracellulaire d’activation de ces lymphocytes.
Pour les cellules folliculaires dendritiques (cellules au niveau d’amas lymphoïdes, notamment dans les ganglions lymphatiques), grâce à CR1, il n’y a quasiment pas de phagocytose : elles vont fixer les antigènes recouverts de C3b et ceci, pendant de longues périodes. Ceci permet de stimuler de manière prolongée les lymphocytes B (rôle dans la mémoire immunitaire).
2 Le CR2 (ou CD21).
Le CR2 présente une expression restreinte aux lymphocytes B et aux cellules folliculaires dendritiques.
Ce récepteur interagit avec les fragments inactivés du C3 (C3bi, C3d et C3dg).
La fonction de cette molécule est une activation des lymphocytes B par un mécanisme qui est non connu. Le CR2 est le récepteur d’un virus à herpès (EBV : virus d’Epstein Barr) qui provoque la mononucléose infectieuse.
Dans ce cas, la multiplication des lymphocytes B est indépendante de celle des lymphocytes T auxiliaires.
3 Le CR3 et le CR4.
Le CR3 appartient à la famille des intégrines (hétérodimaires). Celui-ci est exprimé sur la membrane des monocytes, des macrophages, des polynucléaires neutrophiles et sur les cellules NK. Le CR3 a comme ligand le C3bi. Ce CR3 a des propriétés de lectine (liaison à des résidus glucidiques de la paroi des microorganismes). Le CR3 interagit aussi avec le LPS (lipopolysaccharides) des bactéries.
Le CR4 est fortement exprimé sur les macrophages tissulaires : ce sont des récepteurs aux antigènes opsonisés par le C3bi.
4 L’activité pro-inflammatoire.
Cette activité pro-inflammatoire relève de la libération des petits fragments qui vont se lier à des récepteurs cellulaires sur la membrane des cellules phagocytaires et sur des polynucléaires neutrophiles non phagocytaires (les basophiles sanguins) et sur les mastocytes (tissulaires).
On trouve également des récepteurs sur les plaquettes.
La fixation se fait par l’extrémité C-terminale (arginine). L’activité de ces trois fragments est sous le contrôle d’enzymes sériques (= du sérum) qui sont des carboxypeptidases, ce qui diminue ou annule l’activité biologique de ces trois facteurs.
Leur activité biologique est le déclenchement de la réaction inflammatoire dont les manifestations évoquent celles du choc anaphylactique (provoqué par des anaphylatoxines).
L’anaphylaxie a été découverte au début du 20ème siècle : c’est une réaction inflammatoire extrême (hypersensibilité) dont le mode d’action sera détaillé dans un chapitre spécifique.
5 Génétique et codage du complément.
A l’état basal, les facteurs du complément sont synthétisés par le foie. Lors d’une réponse immunitaire, ces facteurs sont aussi produits par des leucocytes comme les macrophages et les monocytes mais également par une catégorie cellulaire plus « originale », les fibroblastes.
Il existe un polymorphisme de structure de presque tous les facteurs du complément. Par exemple, pour C4, il existe 40 variants allèliques connus.
Un certain nombre de gènes du complément sont présents au niveau du CMH et sont appelés « la classe 3 ».
Il existe de nombreux déficits génétiques qui concernent pratiquement tous les facteurs du complément, ce qui provoque des immunodéficiences et des pathologies (notamment l’absence de clearance).
Réaction Inflammatoire
Et Migration Leucocytaire
Introduction.
Le système immunitaire a deux missions essentielles :
- La surveillance permanente de tout l’organisme afin de détecter le plus rapidement possible un agent étranger (Ag), et,
- Combattre l’agresseur et l’éliminer.
La surveillance est le fait de deux catégories de cellules : les leucocytes sentinelles (fixes) et les leucocytes patrouilleurs (circulants).
Les leucocytes fixes : ils sont disséminés dans tout l’organisme mais préférentiellement concentrés aux frontières de l’organisme. Par exemple, on trouve les cellules dendritiques au niveau de la peau (les cellules de Langerhans), les macrophages tissulaires résidants sont abondants au niveau des muqueuses, les cellules de Kuppfer (ou macrophages spléniques) sont au niveau du foie et préviennent d’une entrée par la voie sanguine par l’intermédiaire du système porte. On peut également considérer les polynucléaires neutrophiles qui adhèrent à la paroi des capillaires sanguins (c’est le secteur marginal des polynucléaires neutrophiles).
Le leucocytes circulants : ils se déplacent en permanence dans le système sanguin et lymphatique. Il s’agit surtout des macrophages, des polynucléaires neutrophiles, des monocytes sanguins (en grand nombre) mais aussi d’une catégorie de lymphocytes appelée « naïfs » car ils n’ont jamais été au contact de l’antigène. Ils circulent en permanence, gagnent les organes périphériques, pénètrent dans les structures particulières (les HEV : veinules à endothélium haut).
Ces cellules retournent dans le sang par des vaisseaux lymphatiques efférents, puis dans le canal thoracique, puis dans la veine sous-clavière gauche.
C’est grâce à cette circulation, et avec une spécificité donnée qu’ils peuvent découvrir un antigène et déclencher la réponse immunitaire spécifique.
Concernant la deuxième mission, le système immunitaire va être alerté par tout un système de signaux de la présence et de la localisation de l’agresseur. Il va réagir pour acheminer le plus rapidement possible, au bon endroit, tout son arsenal défensif, puis offensif.
I La réaction inflammatoire aigue.
A Définition.
La réaction inflammatoire est une réaction physiologique due à la présence d’un agresseur ou d’un traumatisme et qui met en jeu une accumulation localisée de cellules du système immunitaire. , au même titre que l’organisme réagit à l’exercice en augmentant les apports sanguins.
Cette réaction inflammatoire est le moyen de la défense immunitaire innée et l’étape de déclenchement de la réponse immunitaire spécifique.
Trois évènements caractérisent cette réaction inflammatoire :
- Augmentation de l’irrigation sanguine locale (rougeur plus chaleur),
- Augmentation de la perméabilité vasculaire, accompagnée du passage de plasma dans les tissus : provoque un gonflement, œdème et douleur,
- Afflux des leucocytes : polynucléaires, monocytes et lymphocytes. Il y a diapénèse des monocytes (traversée de la paroi). Ces cellules sont guidées dans leur déplacement par de nombreux signaux (gradient de facteurs chimiotactiques et augmentation des molécules d’adhérence).
B Mécanismes moléculaires et cellulaires.
Déclenchement de l’étape initiatrice.
Dans tous les cas, il y a des lésions tissulaires s’accompagnant de lésions vasculaires qui déclenchent la coagulation sanguine.
Le premier temps de la coagulation sanguine est dit « temps endothélio-thrombocytaire : il va y avoir attraction et activation des plaquettes au niveau des capillaires endommagés, ce qui prévient de l’hémorragie.
Le deuxième temps est le temps plasmatique. Il va y avoir activation en cascade de facteurs solubles contenus dans le sang (fonctionnement comparable au complément). Il y a activation de facteurs de contact (XI et XII), ce qui va activer des kinines.
Le facteur XII va activer une proenzyme plasmatique, la prékallicréine et la faire passer sous sa forme de kallicréine (forme active). C’est une protéase qui a comme substrat le kininogène qui sera clivé en deux substances (kallidine et badykine), deux petits peptides, qui provoquent une forte vasodilatation, ce qui accentue la vasodilatation due à l’histamine libérée par les plaquettes activées.
L’histamine provoque aussi une contraction des cellules endothéliales et des muscles lisses sous-épithéliaux : il y a augmentation de la perméabilité vasculaire.
La vasodilatation permet un ralentissement du flux sanguin et une accumulation de leucocytes circulants (surtout pour les polynucléaires neutrophiles). Ces polynucléaires vont ensuite traverser les vaisseaux et atteindre le site inflammatoire : c’est une extravasation.
Le processus s’amplifie rapidement à la suite de l’activation des facteurs du complément qui gagnent le tissu enflammé. Au contact de l’antigène, il va y avoir activation du complément par les voies et alterne et classique. Il y a donc opsonisation et augmente de la présence des anaphylatoxines. Celles-ci vont exercer localement un chimiotactisme à l’égard des leucocytes sanguins circulants (présentant des récepteurs adéquats) et vont activer les mastocytes et les polynucléaire basophiles.
Les leucocytes activés vont libérer des substances à forte activité inflammatoire (histamine et sérotonine) ainsi que des substances regroupées sous le nom de médiateurs lipidiques de l’inflammation.
Ces facteurs sont produits par une phospholipase membranaire qui libère un acide gras à longue chaîne (acide arachidonique, un C20) et un lysophospholipide qui donnera le PAF.
Avec l’acide arachidonique, on aura deux voies différentes :
- action de la cyclo-oxygénase qui fournira du thromboxanne et des prostaglandines ;
- action d’une lipoxygénase qui formera des leucotriènes.
Remarque : L’aspirine va acétyler la cyclo-oxygénase et ainsi l’inactiver.
D’autres substances accroissent cette réaction. C’est par exemple le cas des produits de clivage du fibrinogène (dont les fibrinopeptides) et de la fibrine : il va y avoir augmentation de la perméabilité des vaisseaux mais aussi augmentation du chimiotactisme pour les polynucléaires neutrophiles.
Sous l’action de plasmine (qui dégradent la fibrine), il y a activation du complément : il y a augmentation de la concentration en produits actifs du complément.
A la fin de ces cascades, la perméabilité est maximale : on a alors des cellules sanguines et des substances plasmatiques à activité antimicrobienne qui s’accumulent des les zones inflammatoires (complément, anticorps, lactoferrine [complexe Fe] et céruléoplasmine [complexe Cu]).
Après l’action des macrophages tissulaires, et par la libération de cytokines inflammatoires (IL1, IL6, TNFα), il y a synthèse hépatique accrue de protéines inflammatoires de phase aigue.
 Les produits synthétisés vont permettre le maintien de l’inflammation.
Les produits synthétisés vont permettre le maintien de l’inflammation.
II Migrations leucocytaires et molécules de signalisation.
Dès les premiers instants de la réaction inflammatoire, les leucocytes circulants affluent en grand nombre au site inflammatoire sous l’effet et de l’intense vasodilatation et d’une signalisation par les cellules endothéliales endommagées.
Ces cellules « stoppent » la circulation sanguine et dirigent les leucocytes vers les tissus sous-endothéliaux enflammés.
Le passage trans-endothélial des leucocytes concerne dans un premier temps les polynucléaires neutrophiles, puis les macrophages et les lymphocytes B. La signalisation se fait selon deux types.
· Premier type de signalisation.
Il y a signalisation par expression de molécules membranaires complémentaires appariées sur les cellules endothéliales et sur les leucocytes circulant : ce sont des molécules d’adhérence endothélio-leucocytaires.
· Deuxième type de signalisation.
Ce second type met en jeu tout un « cocktail » de produits libérés au site inflammatoire, avec activité chimio-attractive sur les leucocytes circulants (substances bactériennes, chimiokines synthétisées par les cellules de l’hôte).
A Molécules d’adhérence leuco-endothéliales.
Ces molécules forment un ensemble de substances classées en quatre grandes familles : les intégrines qui agissent avec les molécules de la superfamille des Ig. On trouvera aussi les sélectines qui interagissent avec les sialoglycoprotéines.
1 Les intégrines.
Les intégrines sont des glycoprotéines membranaires, hétérodimériques (association de façon covalente d’une chaîne polypeptidique α et d’une β).
Une dizaine de chaînes α ont été caractérisées, pareillement aux chaînes β. On trouve environ 20 intégrines différentes car toutes les combinaisons n’existent pas.
La sous-unité α possède 3 à 4 sites de fixation d’ions bivalents qui stabilisent la fixation de la chaîne avec son ligand.
Deux groupes d’intégrines ont un rôle important dans la réaction inflammatoire.
a Les intégrines β1.
Ces intégrines sont reconnues par CD29. Elles sont impliquées dans l’interaction des leucocytes activés aux protéines de la matrice extracellulaire (collagène, laminine et fibronectine).
Α4β1 è Protéine VLA (Very Late Antigene).
b Les intégrines β2.
Ces intégrines sont reconnues par CD18. Elles s’associent à une chaîne α de trois types : CD11a, CD11b ou CD11c.
Le complexe CD18-CD11a a initialement été appelé LFA1. LFA1 est exprimé à niveau élevé sur les leucocytes, sur la membrane des lymphocytes T auxiliaires activés et va interagir avec les molécules de la superfamille des Ig (I-CAM 1, 2 ou 3).
Les I-CAM sont exprimées sur la membrane des CPAg et permettent de retenir les lymphocytes T auxiliaires sur les CPAg. Il va ainsi y avoir transduction des signaux d’activation des T auxiliaires.
CD18/CD11a forme le CDR3 du complément.
CD18/CD11c forme un récepteur de type 4.
Ces deux ensembles jouent un rôle primordiale dans le fonctionnement leucocytaire, comme le montre, chez certains individus, l’absence congénitale de chaîne β2 (déficience de l’adhésion leucocytaire : LAD).
2 La superfamille des Ig.
Les molécules de cette famille sont transmembranaires, caractérisées par la présence de 2 à 5 domaines extracellulaires, homologues aux domaines de Ig.
Ces molécules interagissent avec les intégrines et cette superfamille comprend principalement des molécules d’adhésion intercellulaire (I-CAM1, 2 et 3). I-CAM1 et2 sont exprimées sur les cellules endothéliales (intactes ou activées). Les CPAg expriment aussi, généralement ces trois types d’I-CAM et vont agir avec l’intégrine LFA1, exprimée par les lymphocytes T.
La cellule endothéliale activée exprime une I-CAM appelée V-CAM, ayant pour ligand une intégrine exprimée par les leucocytes (VLA4).
Cette nomenclature est confuse car la découverte des molécules a été réalisée par diverses approches :
- approche structurale (avec des anticorps monoclonaux)
- ou par approche de test fonctionnels d’interaction entre cellules.
3 Les molécules apparentées à la mucine.
Dans ce groupe on retrouvera des sialoglycoprotéines (comportent une chaîne polypeptidique qui ancre ces molécules dans la membrane où se branchent de nombreuses chaînes glucidiques riches en acide sialique)
Ces molécules ont une expression constitutive ou induite. Elles peuvent être exprimées par presque toutes les cellules ou bien restreintes à des types cellulaires définis.
Par exemple, CD34 est exprimé sur toutes les cellules endothéliales alors que Gly-CAM1 et MadCAM1 montrent une expression restreinte à certains endothéliums.
Cly-CAM1 est exprimée sur les cellules endothéliales des HEV (Veinules à endothélium haut). Les HEV sont uniquement dans les organes lymphoïdes périphériques activés par la présence de l’antigène.
La Mad-CAM1 (Mad = Mucosal Adressin) est exprimée sur la membrane des cellules endothéliales constituants les capillaires des muqueuses (intestinales et bronchiques).
Ce type de molécule est impliqué dans la localisation préférentielle des lymphocytes mémoire, au niveau de certains tissus : ce type sert « d’adresse » pour ces lymphocytes mis en jeu.
Les leucocytes expriment sur leur membrane de nombreuses sialoglycoprotéines qui partagent des radicaux glucidiques, ce qui confère une spécificité antigénique, définissant un système de groupe appelé, le système Lewis. (on parlera de spécificité Sialyl Lewisx).
4 Les sélectines.
Les sélectines sont les ligands des sialoglycoprotéines. Ce sont des glycoprotéines transmembranaires caractérisées par une région amino-terminale (environ 130 acides aminés) avec une structure très proche de la région amino-terminale des lectines végétales liant les sucres (les C-lectines).
On trouve trois types de sélectines selon le type cellulaire les exprimant :
- Les L-sélectines : sont exprimées constitutivement sur les leucocytes (en quasi-totalité).
- Les E-sélectines : sont exprimées sir les cellules endothéliales activés et leur expression est induite par la libération de cytokines inflammatoires par les macrophages (IL1, IL6, TNFα).
- Les P-sélectines : sont initialement trouvées dans les plaquettes. Elles y sont stockées à l’intérieur, dans des granules de sécrétion. Par activation plaquettaire, il va y avoir exocytose des granules et ces sélectines vont venir s’ancrer sur la membrane plaquettaire.
On trouvera également des granules dans les cellules endothéliales. Elles ont la même fonction que précédemment. Elles sont activées grâce à des substances solubles (leucotriènes, histamine, anaphylatoxine).
Les P-sélectines interagissent sur les sialoglycoprotéines.
B Les chimiokines.
Les chimiokines sont des protéines de faible poids moléculaire (environ 100 acides aminés). Toutes ces molécules sont caractérisées par la présence de 4 cystéines à des positions conservées (il y a formation de deux ponts di-sulfures). On a un pont entre les cystéines 1 et 3 et un autre entre les cystéines 2 et 4.
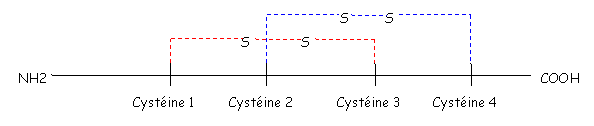
Selon la position relative des deux premières cystéines (soit contiguës, soit séparées), ces chimiokines seront classés en quatre groupes.
- Les CC Chimiokines : Cystéine 1 et 2 continues.
- Les CxC Chimiokines : Cystéine 1 et 2 séparées par un acide aminé.
- Les C Chimiokines : disparition de la cystéine 2.
- Les CxxxC Chimiokines (Cystéine 1 et 3 séparées par trois acides aminés).
Les chimiokines sont des protéines produites et sécrétées par les cellules endothéliales activées et par certains leucocytes, de manière constitutive pour le trafic leucocytaire et de manière induite pour la synthèse de cytokines inflammatoires servant au recrutement des leucocytes au site d’inflammation.
Exemples :
- MCP1,2,3 (CC) : attirent les monocytes.
- MIP (CC) : Macrophages inflammatory proteins.
- IL8 (CXC).
Les chimiokines réalisent leur effet par des récepteurs à 7 segments transmembranaires liés aux protéines G. L’interaction ligand récepteur n’est pas spécifique.
La fonction des chimiokines inductives est de signaler un conflit immunitaire spécialisé. Il y va avoir recrutement par deux mécanismes.
- Le chimiotactisme positif (pour les leucocytes possédant les récepteurs adéquats). L’IL8 attire et recrute les polynucléaires neutrophiles (seuls leucocytes à exprimer fortement le récepteur correspondant).
- Ces chimiokines modulent (n quantité et qualité) l’expression membranaire entre les leucocytes et l’endothélium.
C la migration transendothéliale (des neutrophiles).
Cette migration est généralement coupée en quatre parties.
1 L’étape de « roulement » des polynucléaires sur l’endothélium.
Les molécules d’adhérence cellulaire vont interagir entre elles (par de faibles interactions) et il va y avoir un ralentissement des leucocytes qui vont rouler sur l’endothélium.
2 L’activation.
Cette étape permet aux chimiokines, libérées par les cellules endommagées (ou par les fibroblastes) de faire une interaction avec certains domaines qui vont modeler positivement l’expression membranaire des intégrines leucocytaires.
Cela va induire un changement conformationnel de ces intégrines qui adoptent une nouvelle conformation ayant une forte affinité pour les molécules de la superfamille des Ig.
3 Etape d’arrêt.
Il y a à ce moment là, une forte adhérence des leucocytes à la paroi endothéliale.
4 Migration transendothéliale.
Un même processus permet aux lymphocytes B et T vierges (naïfs), de gagner les organes lymphoïdes secondaires, au niveau des HEV.
D La domiciliation des lymphocytes B et T mémoire (homing = écotaxis).
Depuis longtemps, on a vu que les lymphocytes B et T prélevés au niveau d’un organe lymphoïde donné et que l’on réinjecte dans la circulation sanguine d’un autre individu histocompatible (syngénique), vont se localiser dans les mêmes organes lymphoïdes que celui duquel ils sont issus.
Ils présentent une attirance pour un organe donné : c’est un processus reposant sur l’expression tissu/organe spécifique de certaines molécules d’adhérence enter lymphocytes B et T mémoire et les cellules endothéliales des HEV.
Exemples :
Cas des lymphocytes mémoire des plaques de Peyer de la muqueuse intestinale.
On trouve de nombreux lymphocytes B et T au niveau du derme de la peau chez les sujets à hypersensibilité retardée (cas de dermatite, d’eczéma allergique).
Les cellules endothéliales expriment une CAM particulière (Mad-CAM1) qui interagit avec une intégrine spécifiquement exprimée sur la membrane des lymphocytes B des plaques de Peyer è LPAM-1 (Lymphocyte Peyer Patch Adhesin Molecule) qui permet aux lymphocytes B et T d’être retenus.
Les lymphocytes B et T cutanés, dans le derme ont des sialoglycoprotéines (CLA) qui interagissent avec une sélectine (E-sélectine) des capillaires cutanés.
 Les lymphocytes mémoire acquièrent une mémoire topographique partiellement codée par les molécules d’adhérence.
Les lymphocytes mémoire acquièrent une mémoire topographique partiellement codée par les molécules d’adhérence.
Il va donc y avoir une localisation de ces lymphocytes dans une région qui est plus probable de rencontre l’antigène.
La cytotoxicité cellulaire directe.
Introduction.
On distingue généralement deux réponses immunitaires : cellulaire et humorale.
La réponse immunitaire à médiation cellulaire est caractérisée par l’intervention de cellules développant une cytotoxicité directe (c'est-à-dire qu’elles vont détruire des cellules cibles qui expriment un antigène (du non soi) et avec qui elles ont établi un contact membranaire.
Généralement, les cellules cibles sont du même organisme que les cellules cytotoxiques (c’est le cas des cellules qui hébergent un organisme à développement intracellulaire)
*L’alloréactivité (situation artificielle).
Cette réaction est due au CMH où les cellules interviennent pour la réponse adaptative et pour la réponse innée.
Pour la réponse adaptative, on retrouvera deux grands types de cellules : des lymphocytes cytotoxiques qui donneront presque tous des lymphocytes T CD8. Il y a reconnaissance spécifique d’épitopes sur la cellule cible via le TCR (CMH de classe 1).
L’autre type cellulaire est représenté par les cellules K. Ce sont des cellules non T mais qui développent une activité cytolytique anticorps dépendante (ADCC). Cela implique des anticorps fixés sur une cellule cible et donc, la présence de récepteurs au fragment Fc des Ig (le récepteur RFc). L’action de ces cellules a lieu après la réaction humorale.
Dans le cas de la réponse immunitaire innée, celle-ci est réalisée par les cellules NK (natural killer).
Remarque : les macrophages activés peuvent faire preuve de cytotoxicité.
I La cytotoxicité cellulaire T : Les lymphocytes T CD8+.
L’activité principale de ces cellules est la lutte antivirale. Leur action est consécutive à la reconnaissance spécifique d’une molécule virale dans le CMH de classe 1.
Reconnaissance : sélection des lymphocytes T, puis expansion clonale qui donnera un pool de cellules filles dont une partie va accomplir une différenciation fonctionnelle en lymphocytes cytolytiques (CTL) qui sont les cellules effectrices dans la destruction des cellules cibles. L’autre partie du pool donnera des lymphocytes T cytotoxiques mémoire.
A L’activation (passage de Tc à TCL).
Cette activation requière deux types de signaux.
Le premier signal est généré par une reconnaissance spécifique de l’épitope (interaction CMH1+peptide ó TCR + CD8). IL y a alors un signal intracellulaire activant l’expression membranaire du récepteur (membranaire) à haute affinité pour l’IL2. Au repos, le récepteur à IL2 est de faible affinité.
Après reconnaissance, il y a synthèse de la sous-unité α, qui permet la forte affinité pour IL2.
Le deuxième signal va être la libération d’IL2, qui est nécessaire à l’expansion clonale de ce lymphocyte recruté par l’antigène.
Cas d’un lymphocyte naïf.
La production d’IL2 va dépendre de l’activation des T auxiliaires (d’une sous population de T auxiliaires de type 1). Ils produisent majoritairement de l’IL2 et de l’INFγ.
Dans le cas de réaction humorale, les T auxiliaires se différencient en type 2 et libèreront IL4, IL5, IL6 et IL10. IL4 réprime la différenciation en T auxiliaire de type1.
La différenciation de ces T auxiliaires est contrôlée par le type de leucocytes prédominants (réaction immédiate).
Cas des lymphocytes mémoire.
L’activation et la différenciation en lymphocytes T cytolytiques sont indépendantes de l’activation des lymphocytes T auxiliaires.
Les cellules dendritiques, activées par la présence d’un antigène, vont générer le deuxième signal co-activateur des lymphocytes cytotoxiques mémoire (correspond à la libération d’IL2).
Les cellules de Langerhans (CPAg professionnelles) ayant captées l’antigène, vont migrer via le système lymphatique jusqu’aux ganglions. A ce niveau, ces cellules caractérisées par une forte expression membranaire de CMH1, vont développer une puissante activité co-stimulatrice des Lymphocytes T cytotoxiques.
Cette activité co-stimulatrice est conditionnée par l’expression d’une molécule de la superfamille des Ig (CD80 ou B71-2) qui interagit avec une molécule membranaire exprimée par les lymphocytes T mémoire (CD28). Cette interaction délivre un signal d’activation du lymphocyte cytotoxique et qui aboutit à l’expression et la libération d’IL2. Cette IL2 va avoir un effet autocrine stimulateur sur les lymphocytes T cytotoxiques avec récepteur à IL.
 IL2 a un effet mitogène et permet ainsi l’expansion clonale.
IL2 a un effet mitogène et permet ainsi l’expansion clonale.
Dans une deuxième étape, les cellules filles issues de cette expansion clonale vont pour une partie se différencier et maturer en lymphocytes cytotoxiques. L’adhérence de ces lymphocytes activés à la cellule cible déclenche une cascade d’évènements qui aboutissent rapidement à la lyse de la cellule cible.
B Phase effectrice de la cytolyse.
Deux mécanismes rendent compte de cette cytolyse.
1 La libération de molécules cytolytiques.
La libération de ces molécules est responsable de la nécrose de la cellule cible.
Cette libération est consécutive à une exocytose Ca2+ dépendante de nombreux granules cytoplasmiques. Dans les secondes qui suivent l’adhésion du CTL à la cellule cible, on aura une brutale augmentation du taux de calcium dans le CTL qui est responsable d’une relocalisation des structures golgiennes et des granules cytoplasmiques. Ces granules vont migrer et s’accumuler au pôle qui est au contact de la cellule cible.
Cette relocalisation du golgi et des granules intervient dans la préservation des cellules environnantes.
Les granules vont libérer des molécules cytolytiques dont la perforine. Cette protéine de 600000Da présente de fortes homologies structurales avec le C9 du complément. Au contact de la cellule cible, ces molécules s’insèrent dans la bicouche lipidique et se polymérisent grâce au calcium. On obtient des trous homologues au polyC9.
 Il y a alors nécrose de la cellule.
Il y a alors nécrose de la cellule.
2 L’induction de l’apoptose.
L’induction de l’apoptose se fait selon deux voies.
a Libération de sérine-protéase (ou granzyme).
Ici, il s’agit de protéases contenues dans les granules du CTL, sous forme de complexes inactifs associant des protéoglycanes.
Le granzyme va pénétrer dans les cellules cibles via les canaux de perforine. Ces protéases vont être reponsables d’une fragmentation de l’ADN en oligomères d’environ 200 paires de bases.
Ces sérines protéases activent dans les cellules cibles, la voie endogène de l’apoptose (voie des caspases), à l’issue de laquelle des nucléases seront activées et dégraderont l’ADN cellulaire et l’ADN virale.
 Ainsi, il n’y a pas de particules virales libérées.
Ainsi, il n’y a pas de particules virales libérées.
b Interaction de molécules membranaires : Fas/Fas-Ligand.
Le Fas est un récepteur de la cellule cible, apparenté au récepteur du TNF qui interagit avec une molécule membranaire du CTL : le Fas-ligand. Cette molécule de 30KDa est proche du TNF.
Cette voie joue un rôle mineur dans l’activité cytolytique des CTL.
c La libération de cytokines.
Le CTL libère du TNFα qui induit l’apoptose.
L’INFα a une activité antivirale et antitumorale.
II Cytotoxicité cellulaire naturelle : cellules NK.
A Caractères cytologiques de ces cellules NK.
Les NK ont été initialement identifiées par leur capacité à détruire in vitro, certaines lignées de cellules tumorales, en dehors d’une sensibilisation tumorale. Les cellules NK sont présentes chez les individus sains (sans tumeurs).
Leur cytotoxicité est non spécifique.
Les NK sont de grands lymphocytes, granuleux, représentant jusqu’à 10% des lymphocytes circulant dans le sang.
Ces cellules naissent et se différencient dans la moelle osseuse. Ils n’ont pas de TCR ni de complexe CD3. Ils sont dits : TCR-, CD3-.
Chez les souris « nude » et chez les souris « dix », les cellules NK sont là et sont bien fonctionnelles. Elles n’ont pas besoin de réarrangement génétique.
· CD56 : c’est une glycoprotéine membranaire appartenant à une famille d’adhérence proche des N-CAM. Leur fonction est inconnue.
· CD16 : c’est récepteur de faible affinité au fragment Fc des IgG (CD16 = FcγRIII)
· Récepteurs aux molécules du CMH1. Ils sont en fait des inhibiteurs de l’activation des cellules NK. (KIR).
· Récepteurs activateurs des NK (les KAR).
Outre ces molécules, la cellule NK exprime de nombreuses molécules d’adhérence cellulaire (β2 intégrine LFA1, CD2 qui interagit avec la LFA3).
B Caractéristiques fonctionnelles.
Les cellules NK sont le support de la réponse immunitaire innée à l’égard d’antigènes à localisation intracellulaire : participent donc aux réponses antivirales, antitumorales immédiates.
L’action des NK n’a pas besoin de sensibilisation.
Le nombre de cellules NK rapidement disponibles est très élevé.
 Ces cellules forment la première ligne de défense interne qui permet d’endiguer une infection virale, dans l’attente de l’intervention des mécanismes adaptatifs (lymphocytes T cytotoxiques).
Ces cellules forment la première ligne de défense interne qui permet d’endiguer une infection virale, dans l’attente de l’intervention des mécanismes adaptatifs (lymphocytes T cytotoxiques).
L’activité NK est stimulée par la libération de cytokines inflammatoires (INFα et β; IL2). Ces cytokines sont produites dès le début d’une infection virale. On pourra observer un pic de NK qui suit le pic de libération des interleukines considérées (inflammatoires).
C Mécanismes de la cytolyse.
Les NK activées tuent les cellules cibles selon les mêmes mécanismes que les CTL. D’s l’adhérence à la cellule cible, il y a libération de granules (perforine et granzyme) qui rendent compte de l’apoptose de la cellule et de la nécrose cellulaire.
L’apoptose se produit très rapidement, avant la nécrose, afin de limiter la quantité de molécules infectieuses.
La cellule NK, comme le CTL, produit des cytokines dont le TNFα (augmentation de l’apoptose) et l’INFγ qui participent à la défense antivirale selon plusieurs mécanismes :
- effet positif très fort autocrine sur les NK,
- effet positif très fort paracrine, sur les cellules phagocytaires comme les macrophages ;
- il y a augmentation sur les cellules cibles à INFγ, de la transcription des gènes du CMH1 et du CMH2. Cela accroît l’expression membranaire de ces molécules. Il y a augmentation de l’activité des CTL (et des T auxiliaires) ;
- augmentation de l’expression membranaire des récepteurs au fragment Fc des IgG sur les macrophages (stimule la cytotoxicité cellulaire dépendante des anticorps).
D Mécanismes d’activation des cellules NK.
Plusieurs observations font état d’une activation des NK à la suite d’un effet d’expression membranaire du CMH1 par les cellules cibles.
Dans le cas des cellules cibles hébergeant des virus comme l’adénovirus, ou le cytomégalovirus, il va y avoir piégeage des molécules de CMH dans le cytoplasme de la cellule infectée, ce qui empêche la présentation des peptides viraux. à C’est une stratégie d’échappement au système de défense.
De nombreuses lignées de cellules tumorales ont ce problème de CMH. Si l’on transfecte ces lignées tumorales, sensibles à NK, avec le CMH1, on va leur conférer une résistance aux cellules NK.
L’ensemble de ces observations, confortées par des expériences de transgenèse, suggère que les récepteurs membranaires des molécules de CMH exprimés par les NK, empêchent leur activation.
Quand les NK reconnaissent du soi, elles sont inhibées.
On trouvera deux types structuraux de récepteurs au CMH1.
1 Récepteurs de la famille des lectines (végétales à C-lectines).
Chez la souris, on observe la famille des Ly49. Ce sont des molécules codées par un système multigénique (environ 10 gènes apparentés) localisés sur une paire chromosomique : le complexe NKC.
Chez l’Homme, ce sont les molécules de la famille CD94/NKG2 qui nous intéressent.
Ce sont des molécules hétérodimériques associant une chaîne polypeptidique invariante (le CD49) à une chaîne variante (NKG2). Les gènes codant pour ces chaînes sont également localisés sur une paire chromosomique (le NKC humain).
2 Récepteurs de la superfamille des Ig (chez l’Homme).
Ce sont ces récepteurs qui ont initialement été qualifiés de KIR.
On a tout un ensemble de molécules à variabilité se structure, à la fois dans la partie extracellulaire (domaines Ig) et dans la partie intracytoplasmique. Cette dernière partie sera plus ou moins longue et les récepteurs sont classés sous l’appellation :
- KIR2DL (L pour long),
- KIR3DL (3D pour trois domaines extracellulaires),
- KIR2DS.
Les KIR sont sous contrôle d’environ 12 gènes et aussi d’un système polyallélique : il en résulte un large répertoire de reconnaissance des molécules de CMH1. Chaque récepteur reconnaît plusieurs allèles d’un même locus.
L’interaction de ces récepteurs avec les molécules de CMH1 verrouille l’activité des NK. Ceci est lié à une séquence ITIM portée par des régions cytoplasmiques à motifs tyrosine qui vont inhiber les NK par recrutement d’une phosphatase qui désactive plusieurs transducteurs (qui activent normalement les NK).
Le verrou est levé quand il n’y a pas de CMH1 sur la surface cellulaire. Les NK deviennent alors activables. C’est à ce moment là qu’interviennent les KAR. Ces KAR appartiennent à la superfamille de Ig mais diffèrent des KIR par leur région intracytoplasmique qui possède un motif ITAM. Ce motif va activer les transducteurs de la voie d’activation.
Au niveau des cellules cibles, la nature du ligand des KAR est inconnue.
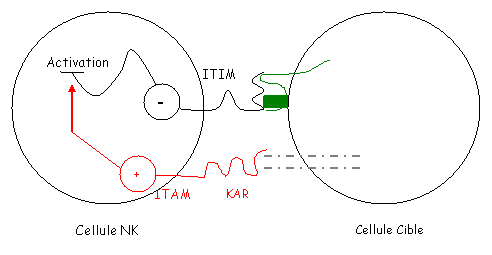
IIICytotoxicité cellulaire dépendante des anticorps (ADCC) : les cellules K.
Quand une cellule est la cible des anticorps, après développement de la réaction humorale, cette cellule peut être lysée, suite à l’activation, soit du complément, soit par intervention d’effecteurs cellulaires : les cellules K. Ces cellules K forment un ensemble de cellules caractérisées par une cellule avec récepteur membranaire au Fc des Ig.
La molécule d’Ig joue le rôle d’adaptateur enter la cellule cible et la cellule K.
Les récepteurs Fc forment une famille complexe de molécules appartenant majoritairement à la superfamille des Ig : deux à trois domaines extracellulaires de type Ig ainsi qu’une région membranaire et une région cytoplasmique.
On distingue deux grands types de récepteurs :
- Les récepteurs à forte affinité (R1Fc) : ils lient les Ig avec des constantes d’association élevées (109 à 1010M-1). Ces récepteurs ont une expression restreinte.
- Les récepteurs de moyenne ou faible affinité : R2,3Fc. Ils ont une constante d’association inférieure à 107M-1. Ils sont exprimés dans de nombreux types cellulaires. Ils vont interagir avec les Ig sous forme complexée avec un antigène ou entre Ig.
- Les récepteurs au Fc des IgG : FcγR. Ce sont des récepteurs à haute affinité. On trouve FcγR1 (CD64), exprimé sur les monocytes et macrophages; FcγR2 (CD32) exprimés sur monocytes, macrophages, mais aussi sur les polynucléaires, éosinophiles, plaquettes et lymphocytes B; FcγR3 (CD16) sont exprimés sur les memes cellules mais également sur les cellules NK.
- Les récepteurs au Fc des IgE : FcεR. FcεR1 est fortement exprimé sur les mastocytes et les basophiles, ont une haute affinité (10-10). Leur structure est multicaténaire. FcεR2 (CD23) est un récepteur à moyenne activité. On le retrouve sur les macrophages activés, les plaquettes, les polynucléaires éosinophiles. L’expression de CD23 augmente avec l’IL4.
A Les fonctions des récepteurs aux IgG (Fc).
Ces récepteurs sont des médiateurs de l’activité opsonisante de cette classe d’Ig. Il y a renforcement de l’adhérence des cellules phagocytaires à l’antigène.
L’interaction avec les IgG transduit un signal intracellulaire de l’activation des cellules phagocytaires : production de composés oxygénés et de molécules bactéricides (lysosomes).
Les CD16 ont un rôle pour les NK : renforcent leur activité.
B Les fonctions des récepteurs aux IgE.
FcεR1 va activer ses cellules spécifiques (mastocytes, basophiles) pour déclencher la réponse inflammatoire. Quand il y a une trop forte activation, liée à la synthèse anormale d’IgE, on observe l’hypersensibilité immédiate (= allergie).
FcεR2 (CD23) voit son expression sur les éosinophiles qui rend compte d’une activité cytolytique à l’égard de plusieurs parasites dont les vers intestinaux. à Les éosinophiles vont adhérer au parasite et permettre de le recouvrir d’IgG et d’IgE. Cette interaction provoque leur dégranulation avec libération de granules cytolytiques avec perforine, basic major protein (BMP, très active) et CP (cationine protein).
Les systèmes des groupes érythrocytaires.
I Le système A,B,O et les systèmes associés (H-h, Se-se, et Lewis LE).
A Découverte du système ABO.
La découverte de ce premier système érythrocytaire remonte à 1900 et a été réalisée par Karl Landsteiner.
Le système rhésus fur découvert en 1939.
Environ, une vingtaine de groupes érythrocytaires ont été identifiés.
Un système de groupe est un ensemble d’antigènes allotypiques, génétiquement dépendant les uns des autres.
Landsteiner a observé la formation d’agglutinats quand il mélangeait les globules rouges de certains individus avec le sérum d’autres individus è Il y a existence, dans le sérum, d’anticorps (agglutinines) qui reconnaissent certaines constituants exprimés sur les hématies de certaines autres individus.
 Finalement, on a des variations de structures entre les individus qui sont reconnues par des anticorps.
Finalement, on a des variations de structures entre les individus qui sont reconnues par des anticorps.
 Quatre groupes majeurs sont liés à l’existence de deux types d’antigènes érythrocytaires (A et B).
Quatre groupes majeurs sont liés à l’existence de deux types d’antigènes érythrocytaires (A et B).
|
Phénotype
|
Génotype
|
Ag Globulaire
|
Ac Sérique
|
Fréquence
|
|
A
|
AA ou A/O
|
A
|
Anti B
|
45%
|
|
B
|
BB ou B/O
|
B
|
Anti A
|
9%
|
|
AB
|
AB
|
AB
|
__________
|
3%
|
|
O
|
OO
|
(H)
|
Anti A et anti B
|
43%
|
Chaque individu, dans son sérum, possède des anticorps (naturellement) héma-agglutinant spécifiques du ou des antigènes qu’il ne possède pas.
B Le système associé Hh – Se se.
Les individus du groupe O (absence de A et de B sur les globules rouge) expriment un antigène spécifique qualifié d’antigène H. Cet antigène est le précurseur des antigènes A et B (c’est le substrat de produits des gènes des allèles A et B). H sera transformé en A o en B.
H est reconnu spécifiquement par des anticorps naturellement présents dans le sérum de certaines sujets des groupes A ou AB (les sous-groupes A1 ou A1B), ou encore, dans le sérum de rares individus ayant un phénotype de groupe « Bombay ».
Les individus de ce groupe « Bombay » sont des individus n’ayant ni l’antigène A, ni l’antigène B, mais qui peuvent transmettre les antigènes A ou B à leur descendants et qui n’expriment pas sur leurs hématies l’antigène H : ils ont l’anticorps anti-H.
L’expression de ces antigènes (A, B et O) ne se limite pas aux globules rouges : de nombreux autres types cellulaires les expriment (les lymphocytes B et T, les cellules endothéliales, les fibroblastes, les cellules épithéliales [muqueuses respiratoires, digestives, de la peau]).
Ces antigènes A, B et H se présentent sous deux formes : membranaire (ancrée dans la membrane) ou soluble (dans les sécrétions de muqueuses dont digestives).
L’expression tissulaire de ces deux formes d’antigène (membranaire et soluble) est sous le contrôle d’un couple de gènes étroitement liés : le couple Hh – Se se.
h et se sont des allèles silencieux et donneront la forme inactive de l’enzyme.
H et Se codent pour une même protéine (enzyme : 2α-L-Fucosyl-Transférase). Ces deux gènes ont une expression tissulaire différente :
- H est principalement exprimé dans les tissus d’origine mésodermique et ectodermique (peau, cellules endothéliales, cellules sanguines…)
- Se est fortement exprimé dans les dérivés endodermiques (glandes salivaires, cellules épithéliales des muqueuses respiratoires et digestives).
 Le système Hh est monomorphe car plus de 99% des individus expriment l’allèle H. L’allèle h donne le phénotype bombay.
Le système Hh est monomorphe car plus de 99% des individus expriment l’allèle H. L’allèle h donne le phénotype bombay.
 Le couple Se se est dimorphique : 80% des individus sont Se (individus sécréteurs, dans la salive …) les 20% restant sont se et ne sécrètent pas.
Le couple Se se est dimorphique : 80% des individus sont Se (individus sécréteurs, dans la salive …) les 20% restant sont se et ne sécrètent pas.
C Nature biochimique et biosynthèse des antigènes ABH.
Les antigènes A, B et H sont constitués par des chaînes oligo-saccharidiques liées soit à une chaîne popypeptidique, soit à un glyco-sphingolipide, ce qui permet, dans ce dernier cas, un attachement à la membrane des cellules.
Les chaînes oligo-saccharidiques présentent en commun, et en bout de chaîne, un disaccharide terminal (de base) pouvant définir deux types de chaînes. On aura un N-Acétyl-Glucosamine relié à un galactose.
La chaîne de type 1 présente une liaison en 1à3 et prédomine dans tous les tissus d’origine endodermique.
La chaîne de type 2 présente une liaison en 1à4 et se trouve seulement dans les tissus ectodermiques et mésodermiques.
La spécificité antigénique (A, B ou H) est déterminée par la nature du type de radical glucide greffé sur le galactose du disaccharide terminal.
Pour la spécificité H : il y a addition de L-Fucose sur le carbone 2 du βD-galactose.
Pour la spécificité A : il y a addition de N-Acétyl-Galactosamine sur le carbone 3 du βD-galactose de la substance H.
Pour la spécificité B : il y a addition de αD-galactose sur le carbone 3 de la substance H (βD-galactose).
La biosynthèse de ces substances de groupe est sous le contrôle de deux gènes indépendants (glycosyl-transférase).
Le premier gène, pour la substance H donne l’enzyme 2αL-Fucusyl-Transférase.
Dans le cas du second gène, la substance H va être le substrat de l’activité Glycosyl-Transférase de ce second gène (dont il existe trois allèles) :
- pour A : l’enzyme N-Acétyl-GalactosAminyl-Transférase donnera la substance A (l’antigène).
- Pour B : l’enzyme αD-Galactosyl-Transférase donne l’antigène B.
- Pour O : l’allèle est silencieux et donne une protéine sans activité enzymatique.
D Les sous-groupes.
Plusieurs sous-groupes ont été caractérisés.
1 Le sous groupe A1 ou A1B.
Ce sous groupe est caractérisé par l’expression d’une antigénicité particulière reconnue par les anticorps antiA1 (de certains sujets B). Cette antigénicité est conditionnée par une répétition du disaccharide terminal.
Environ 80% des individus du groupe A et du groupe AB sont A1 ou A1B. On trouve alors 20% de A2 ou A2B.
Pour A1 et A1B, la substance H est presque toujours totalement transformée.
Pour A2 etA2B, la transformation de h est incomplète, ce qui provoque une agglutination par les anticorps anti A et anti H.
2 Les autres sous groupes.
Ces autres sous groupes ont une faible expression antigénique de A ou de B : on a un petit nombre de sites antigéniques à la surface des hématies :
- Pour A1, le nombre de sites antigéniques par cellule est environ de 106.
- Pour A2, le nombre de sites antigéniques par cellules est environ de 2.105.
- Pour les A faibles (Ax, Am, Ay, Ael…), le nombre de sites par cellule est de l’ordre de 1000 à 5000 sites.
Cette répartition du nombre de sites est également vraie pour les sous groupes de B.
 Les hématies de ces sous groupes ne sont pas agglutinées par les anticorps antiA ou antiB.
Les hématies de ces sous groupes ne sont pas agglutinées par les anticorps antiA ou antiB.
Pour savoir quel est le groupe sanguin d’un individu, il faut observer quels sont les anticorps sériques.
E Les anticorps dans le système érythrocytaire.
On trouve deux grands types d’anticorps dans ce système.
- Des anticorps naturels : ils sont naturellement présents et réguliers (sans immunisation).
- Des anticorps immuns : ils sont produits par une immunisation.
Les anticorps naturels sont surtout des IgM alors que les immuns sont plutôt des IgG obtenues par xéno-immunisations (très fréquentes) car les antigènes A et B sont très présents dans la nature.
Les individus O ont des IgM antiA et antiB. Leur concentration est toujours comprise entre certaines valeurs limites. Il s’y rajoute des IgG (immunes) avec des taux élevés possibles.
 Les IgG sont responsables de l’incompatibilité foeto-maternelle, mais aussi de la limite de « donneur universel » des groupes O (valable jusqu’à 0.5litre).
Les IgG sont responsables de l’incompatibilité foeto-maternelle, mais aussi de la limite de « donneur universel » des groupes O (valable jusqu’à 0.5litre).
F Le système Lewis.
Ce système est relié au système ABH et au système Se semais en est toutefois génétiquement indépendant.
Les antigènes Lewis sont des glycoprotéines synthétisées par les glandes salivaires, des cellules du tube digestif. Ces glycoprotéines passent ensuite dans le plasma ou elles seront secondairement absorbées et exprimées sur les hématies.
L’expression des antigènes Lewis est sous le contrôle d’un gène (LE) codant pour la 4α-Fucosyl-Transférase. 90% des individus sont Le, les 10% restant sont le.
L’enzyme formée permet la fixation d’un fucose sur le carbone 4 du N-Acétyl-Glucosamine du disaccharide terminal (uniquement sur les chaînes de type 1). è On a alors une antigénicité LeA (Lewis A).
Les individus sécréteurs (Se) ont Le qui fixe un autre fucose (un de plus) et forme alors un disaccharide di-fucosylé è antigénicité LeB. Celle-ci est le résultat de la superposition de LeA et de H de type 1.
Le produit du gène Lewis peut fixer du fucose sur les chaînes de type 2 au niveau du C3 de la N-Acétyl-Glucosamine. On aura alors une spécificité appelée Lewis X ou LeX. Cette spécificité est retrouvée sur les sialo-glycoprotéines membranaires des leucocytes et des cellules endothéliales. Ces protéines sont les ligands de sélectines.
II Le système rhésus.
Ce système fut découvert en 1939 par Levine en trouvant des allo-anticorps dans le sérum d’une femme qui venait d’accoucher d’un enfant atteint de maladie hémolytique (MHNN). Cet anticorps agglutine, in vitro, les hématies de l’enfant et du père.
Cet allo-anticorps agglutinait les hématies de 85% des individus. Il fut appelé, à l’époque, antigène D.
A la même époque, Wiener et Landsteiner cherchaient à produire des anticorps contre les hématies de Macquacus rhesus (un singe), par xéno-immunisation, avec des lapins.
En fait, les xéno-anticorps reconnaissaient d’autres antigènes : le nom donné fut système LW (qui sont plus exprimés sur les cellules avec le système D).
Les Rh+ ont l’antigène D ; les Rh- ne l’ont pas.
C’est un système complexe avec un gène D et un gène CcDd qui est plus faiblement immunogène. Ce sont des peptides transmembranaires (à 12 domaines) avec des acides gras qui viennent se fixer dessus.
III Incompatibilité foeto-maternelle.
Cette incompatibilité est surtout observée dans le système Rh (mais aussi ABH). La mère doit être Rh- et le père Rh+.
Il faut que la mère se soit immunisée (par un premier accouchement d’un enfant Rh+, à cause du mélange des sangs).
L’expression de D est précoce (2 à 3 mois).
Pendant la seconde grossesse, il va y avoir passage de globules rouges fœtaux et donc, une réponse secondaire est mise en action et passe la barrière placentaire.
 On observe alors une hyper destruction des globules rouges. Cette destruction libère de l’hémoglobine qui sera transformée en bilirubine, éliminable par glycuro-combinaison.
On observe alors une hyper destruction des globules rouges. Cette destruction libère de l’hémoglobine qui sera transformée en bilirubine, éliminable par glycuro-combinaison.
Les problèmes apparaissent après la naissance : les anticorps sont toujours fixés sur les hématies. La bilirubine va alors être mal éliminée et peut s’accumuler dans le cerveau ou elle provoque des dégradations pouvant aboutir à la mort.