Sommaire du cours
d’endocrinologie.
La thyroïde.
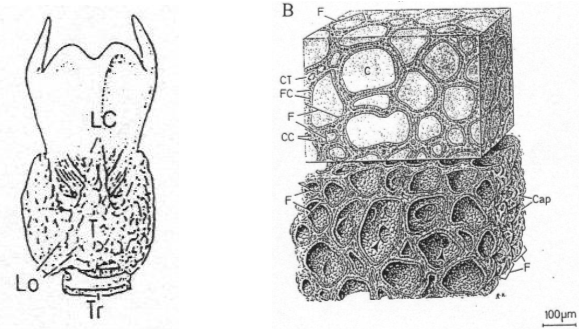
Au niveau de la thyroïde, on trouve un follicule qui se répète : le « follicule thyroïdien ». Entre les follicules, on a du tissu parafolliculaire au sein duquel, sur les coupes, on observe de nombreux capillaires sanguins : la thyroïde est une glande très irriguée.
Dans ce tissu, on trouve un type cellulaire particulier : les cellules à calcitonine.
Etude du follicule thyroïdien.
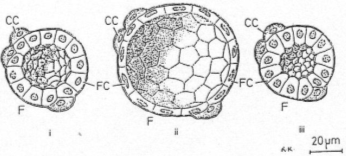
2 : C’est la partie centrale avec une grosse colloïde entourée par épithélium de cellules thyroïdiennes : c’est l’état d’involution (de repos) de la glande.
3 : L’épithélium est bien développé , les noyaux sont arrondis et le cytoplasme développé : c’est l’état d’activité maximale.
1 : on observe dans ce cas un stade intermédiaire.
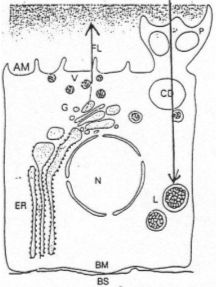
Au niveau basal, il y a des contacts avec les capillaires. La cellule reçoit par la circulation sanguine les composés pour la synthèse des hormones thyroïdiennes. Ces dernières partent dans la circulation sanguine dans le sens du déroulement de la synthèse des hormones.
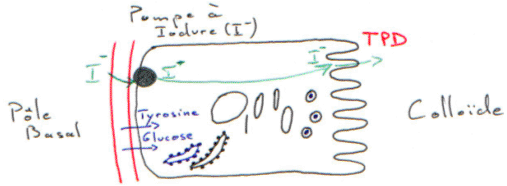
Il y a présence d’iode sur les hormones thyroïdiennes. La concentration en iode intracellulaire est bien supérieure à la concentration périphérique. Au niveau de la colloïde existe un système enzymatique qui permet le passage de l’iodure (I-) en iode organique (I0) : c’est le travail de la thyropéroxydase (TPD).
Dans le réticulum endoplasmique est synthétisé une protéine : la thyroglobuline. Cette protéine va migrer vers le Golgi où elle va être glycosidée. Elle sera ensuite entourée par une membrane puis exocytée.
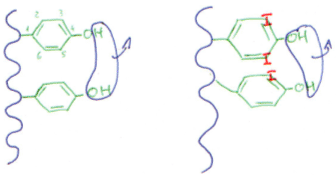
La TPD a la particularité, dans un premier temps, de fixer de l’iode sur le radical benzénique en position 3.
La fixation de l’iode sur ce cycle est due à la TPD ; elle favorise aussi la condensation de deux tyrosines : 2 DiIodoTyrosine vont donner la 3,5,3’,5’TétraIodoTyrosine (ou T4 ou tyroxine).
Le matériel de la colloïde va être capté, endocyté puis pris en charge par des lysosomes ; ce qui entraîne une dégradation des chaînes. On obtient alors la T3 et la T4, ainsi que MIT et DIT qui vont subir l’action d’une désiodase.  Il y a donc libération d’iode et de tyrosine. T3 et T4 migrent, franchissent la membrane et partent dans le courant circulatoire.
Il y a donc libération d’iode et de tyrosine. T3 et T4 migrent, franchissent la membrane et partent dans le courant circulatoire.
La TBG, l’albumine et le TBPA servent à transporter T3 et T4 jusqu’au cellules cibles.
Les catécholamines.
Les catécholamines sont synthétisées dans la médullosurrénale.
Autour de la veine centrale, on trouve un tissu constitué de cellules chromafines. Ces cellules reçoivent du sang du cortex et leurs rejets se font dans la veine centrale.
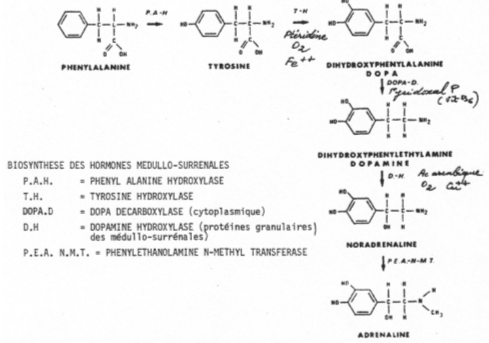
La phénylalanine et la tyrosine sont captées dans le courant circulatoire. Là, la phénylalanine peut être hydroxylée en tyrosine par la PAH (Phényl Alanine Hydroxylase). La tyrosine va être à son tour hydroxylée en dopa (dihydrophénylalanine) par la TH (Tyrosine Hydroxylase). La dopa sera ensuite décarboxylée en dopamine par la dopa décarboxylase.
 Toutes ces étapes ont lieu dans les cellules chromafines.
Toutes ces étapes ont lieu dans les cellules chromafines.
La dopamine  -Hydroxylase va agir sur la dopamine (qui migre dans les granules) en la transformant en noradrénaline qui, elle, se diffuse dans le cytoplasme. Cette dernière, sous l’action de la PEA NMT (PhénylEthanolAmine N-Méthyl Transférase), est transformée en adrénaline.
-Hydroxylase va agir sur la dopamine (qui migre dans les granules) en la transformant en noradrénaline qui, elle, se diffuse dans le cytoplasme. Cette dernière, sous l’action de la PEA NMT (PhénylEthanolAmine N-Méthyl Transférase), est transformée en adrénaline.
Chez les mammifères, la forme adrénaline domine. Celle-ci regagne les granules où elle est stockée.
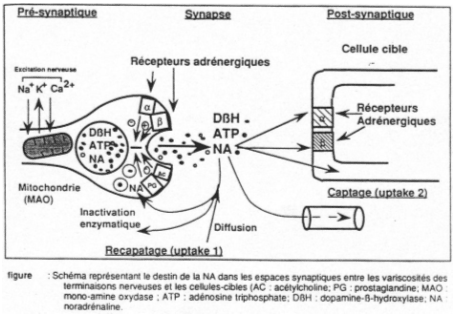
La libération d’acétylcholine qui se fixe sur les récepteurs des cellules chromafines entraîne l’ouverture de canaux sodium voltage dépendant. Il va y avoir entrée de calcium qui va permettre la migration des granules vers la membrane, puis l’ouverture des granules dans le courant circulatoires (les granules seront ensuite recyclés).
Cette hormone a une durée de vite réduite.
La glande pinéale.
La glande pinéale reçoit une innervation sympathique. Son fonctionnement est couplé à celui de l’œil.  C’est une glande sensible au photopériodisme.
C’est une glande sensible au photopériodisme.
Organisation.
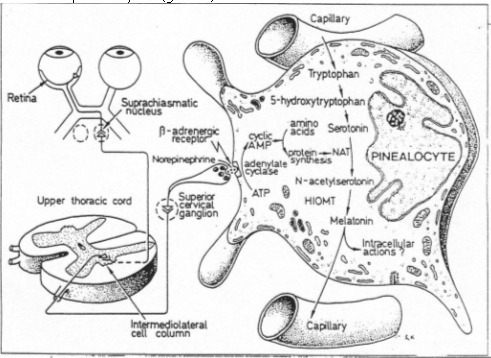
Le faisceau rétino-hypothalamique débouche sur le noyau supra-chiasmatique. Les fibres efférentes de ce noyau vont vers le noyau paraventriculaire : ces fibres font relais à la moelle épinière et mettent en jeu de la noradrénaline ; elles font relais au ganglion cervical supérieur et arrivent finalement au pinéalocytes (glande).
Il est possible de sacrifier un individu (rat) toutes les deux heures et de retirer la glande pinéale et de doser une neurohormone : la mélatonine.
Les points correspondants à la phase claire montrent une très basse concentration en mélanocyte. Pendant la phase sombre, il y a une forte augmentation (exponentielle) suivie d’une diminution avant la phase claire.
Au lieu de sacrifier des rats, on place un cathéter dans une carotide (de rat) pour en prélever un peu de sang. On trouve alors un peu de mélatonine pendant la journée puis une grande libération durant la nuit : ce sont des résultats comparables à ceux de l’expérience précédente.
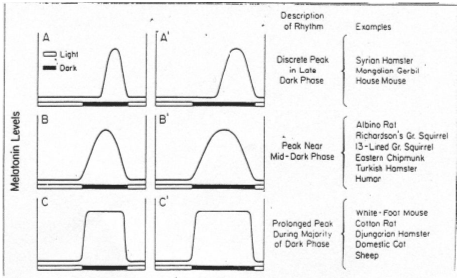
La durée de sécrétion de mélatonine est plus courte en A qu’en A’.
En fonction des mois de l’année, la durée d’imprégnation de la mélatonine varie. Elle permet un déclenchement d’attitude(s)s, comme par exemple les périodes de reproduction.
Lors du passage de la lumière à l’obscurité, on observe une forte activité noradrénergique.
Chez les rats, au niveau des pinéalocytes, la noradrénaline se fixe sur les récepteurs ?-adrénergiques et ?1-adrénergiques.
Cette commande adrénergique est déterminée par le noyau suprachiasmatique : le fonctionnement de la glande pinéale est alors perturbé et bloqué. Pendant la transition lumière/obscurité, il y a envoie de signaux qui permettent l’augmentation d’AMPc (second messager du pinéalocyte).
Le tryptophane arrive par des capillaires. Pendant la période claire de la journée, le tryptophane est capté par le pinéalocyte, subit l’action de la tryptophane hydroxydase et est transformé en 5-HydroxyTryptophane. Il est ensuite dégradé en sérotonine par l’AminoAcideDécarboxydase (production et stockage).
Pendant l’obscurité, il y a activation de la Noradrénaline au niveau des pinéalocytes. Il y a donc augmentation d’AMPc qui va permettre l’accroissement de la synthèse d’ARNm qui code pour une protéine, la N-acétylTransférase, facteur limitant de la journée.
Cette enzyme va assurer la synthèse de N-acétylsérotonine qui va être transformée en mélatonine par l’HydroxyIndolOMéthylTransférase (HIOMT). Cette mélatonine va être libérée dans les capillaires. Quand elle arrive sur les corps cellulaires des noyaux supra chiasmatiques, elle se lie à des récepteurs spécifiques. Elle informe ces noyaux sur la durée de la nuit ; c’est une horloge biologique fonctionnant sur 24 heures ; elle commande les rythmes hormonaux endogènes.
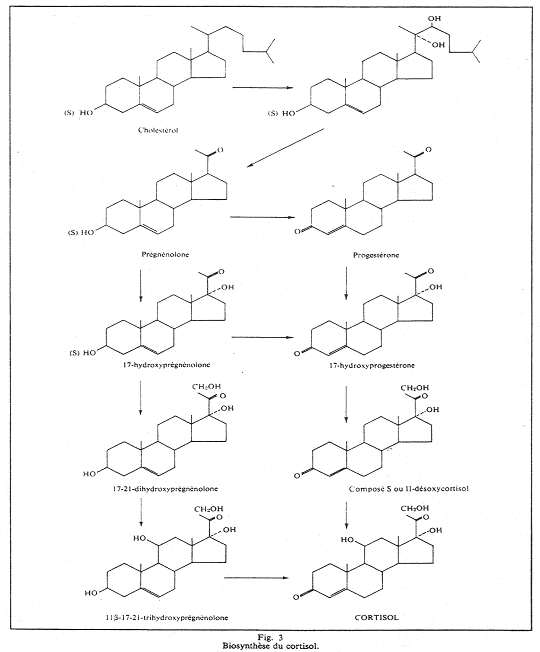
L’exemple du cortisol.
Le cortisol est synthétisé par une stimuline hypophysaire, l’ACTH.
Si on réalise des prélèvements de sang durant la journée, on observe au levé, un pic d’ACTH qui précède celui du cortisol, puis, une diminution pendant le reste de la journée.
Le rythme de sécrétion endogène est dirigé par le noyau supra chiasmatique qui n’est pas modifié par l’activité de la personne (travail de nuit).
Ces rythmes sont liés à l’horloge biologique interne (noyau supra chiasmatique).
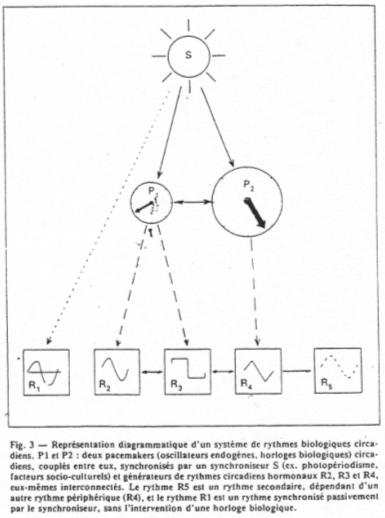
Dans le cas où le sujet est dans une situation de libre cours :
- si le rythme disparaît, on a alors mise en place d’un rythme saisonnier,
- si le rythme persiste, on parle de rythme circannuel endogène.
Généralités.
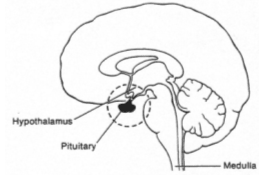
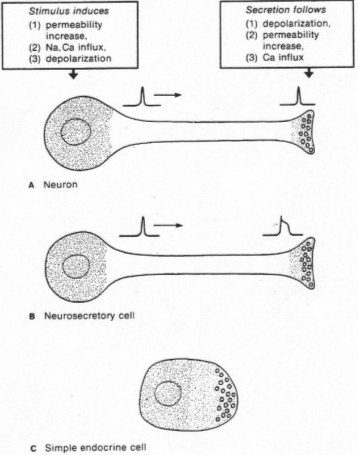
L’antéhypophyse a un rôle endocrine.
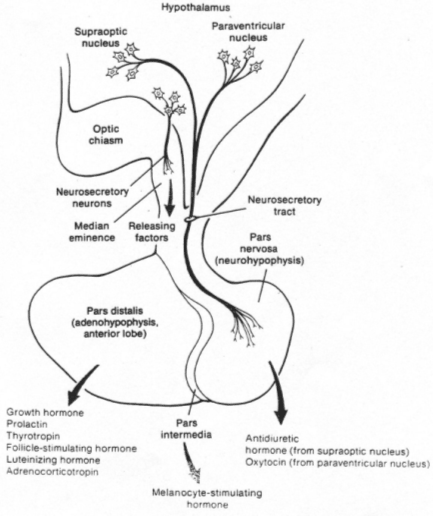
La neurohypophyse reçoit des neurones neurosécréteurs longs provenant du noyau supra optique et du noyau para ventriculaire. Cette structure reçoit du sang de l’artère hypophysaire inférieure. L’artère hypophysaire inférieure va, dans la partie supérieure, former le système porte hypothalamo-hypophysaire puis aller vers l’adénohypophyse ; elle va aussi à la neurohypophyse et en repart par la veine efférente.
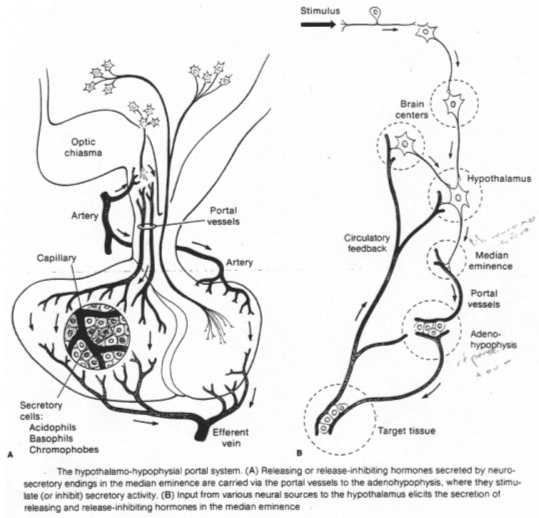
Les corps cellulaires des neurones neurosécréteurs sont situés dans les noyaux supra optique et para ventriculaire. Ils reçoivent des informations des centres supérieurs : il y a synthèse de neuropeptides selon le processus suivant :
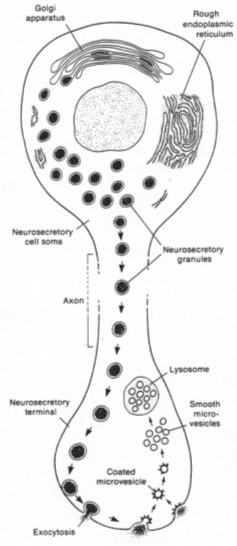
Les grains de sécrétion migrent le long de l’axone et s’accumulent dans la partie terminale.
Quand le corps cellulaire reçoit l’information, la membrane plasmique est dépolarisée et donne naissance à un potentiel d'action.
Le long de l’axone, le parcours est matérialisé par une augmentation de Ca2+ libre qui favorise la contraction des fibres pour la migration des capsules.
Il y a fusion des membranes puis libération du contenu des granules.
Deux familles de peptides sont synthétisées :
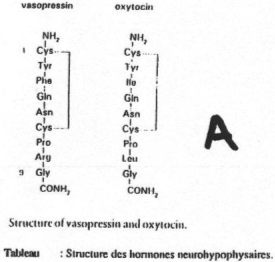
- ADH (hormone antidiurétique), formé par 9 acides aminés.
- OT (ocytocine), formé de 9 acides aminés.
Chez les mammifères, au lieu de parler d’ADH, on parle de glycine vasopressine, sauf chez le porc, on parle de lysine vasopressine. L’ADH est associée à la neurophysine 2.
L’OT a beaucoup d’analogie avec l’ADH. Cette OT est associée à la neurophysine 1.
La neurophysine est constituée par une centaine d’acides aminés.
I L’ADH.
L’ADH est connue pour exercer des effets majeurs dans une cible dans le rein : le néphron (unité fonctionnelle du rein).
La pression osmotique dans le cortex est égale à celle du sang (300 mOsmol). Cette pression augmente en allant de la médulla extérieure vers la médulla intérieure (de 300mOsmol à 1200mOsmol).
L’existence de ce gradient osmotique est liée à l’environnement hormonal de ce tissu. On peut apprécier les pressions dans les différentes parties du néphron.
Le sang, dans l’artère efférente, va irriguer le bas du néphron : la « vasa recta ».
Toutes les molécules dont le poids moléculaire est inférieur à 50 000Da sont filtrées et passent à travers la barrière du néphron.
Les parois des vasa recta s’équilibrent (au niveau osmotique) avec le milieu extérieur (interstitiel).
Dans la branche ascendante de la anse de Henlé, il y a imperméabilité à l’eau.
 L’existence de ces proportions et la capacité de créer à tous les niveaux une pression de 200mOsmol permet l’obtention d’un liquide (urine) hypotonique par rapport au liquide interstitiel.
L’existence de ces proportions et la capacité de créer à tous les niveaux une pression de 200mOsmol permet l’obtention d’un liquide (urine) hypotonique par rapport au liquide interstitiel.

• Au stade I, le tube est vide puis se remplie d’une solution isotonique au plasma (300mOsmol).
• Au stade II, on observe une pression de 200mOsmol.
• Au stade III, on réinjecte de la solution à 200mOsmol.
• Au stade IV, l’équilibre est atteint.
• Au stade V, on ajoute du liquide à 300mOsmol.
• Au stade VI, l’équilibre est atteint et ainsi de suite.
L’expérience se termine quand on atteint 1200mOsmol.
Si l’on n’a plus d’ADH, le gradient chute.
Dans ce cas, l’ADH n’affecte pas les mouvements d’eau dans la anse ascendante de Henlé. Dans le tube collecteur de Bellini, l’ADH augmente la réabsorption d’eau.
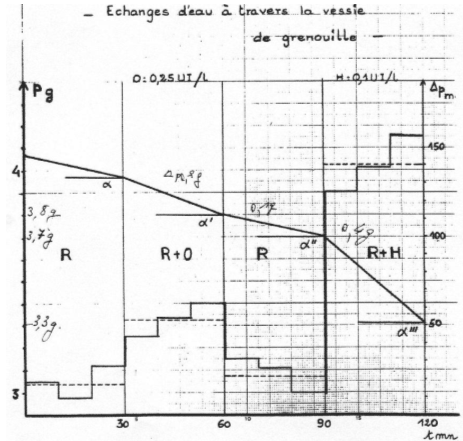
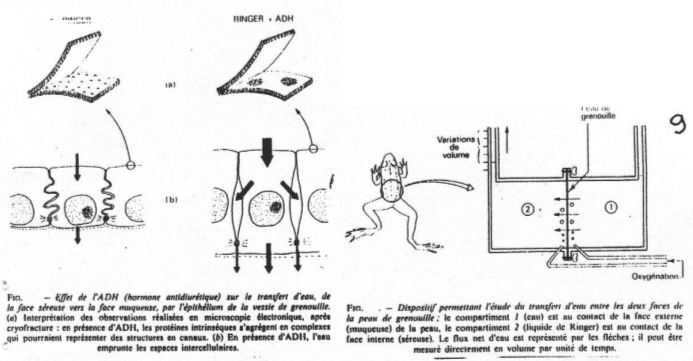
Dans le cas des cellules épithéliales de grenouille, la membrane du coté de la lumière de la vessie est une muqueuse ; la membrane du coté opposé est une séreuse. Les transferts se font de la muqueuse vers la séreuse.
On plante un cathéter dans la vessie disséquée d’une grenouille, on la remplie de ringer puis on la place en suspension dans le même liquide. Quand on ajoute un analogue à l’ADH, on observe une diminution du poids de la vessie.
En cryogénie, la membrane épithéliale présente des canaux à eau (sous l’action d’ADH) : les aquaporynes. L’ADH est reconnue par un récepteur membranaire (V2). Quand elle se lie, on peut observer l’augmentation de l’activité de l’adénylate cyclase, grâce à une protéine-G.
Cet accroissement d’activité donne la forme d’AMPc à cause de la phosphorylation de protéines qui permettent de transloquer les aquaporynes vers la membrane et de les y insérer.
L’ADH participe : -à l’établissement cortico-papillaire ; -à la mise en jeu des transferts d’eau (au niveau du tube contourné proximal, de l’anse descendante de Henlé et du tube collecteur de Bellini).
Au niveau du tube contourné distal, les cellules de la macula densa sont sensibles à la teneur en sodium dans la lumière du tube contourné distal.
Au niveau de l’artériole afférente, on trouve les cellules sécrétrices de rénine qui sont au contact de l’endothélium de ce canal.
A Régulation de sécrétion de l’ADH.
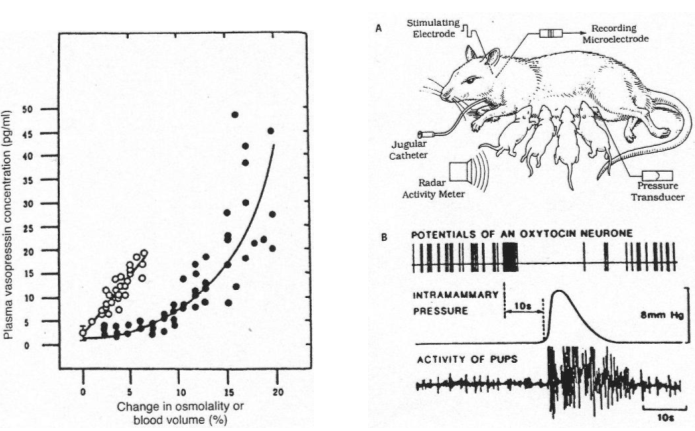
Si on réalise le branchement d’un cathéter sur la carotide d’un mammifère et qu’on lui injecte une solution hypertonique, il y aura une variation de moins de 2% grâce à la libération d’ADH qui permettra de compenser le manque d’eau.
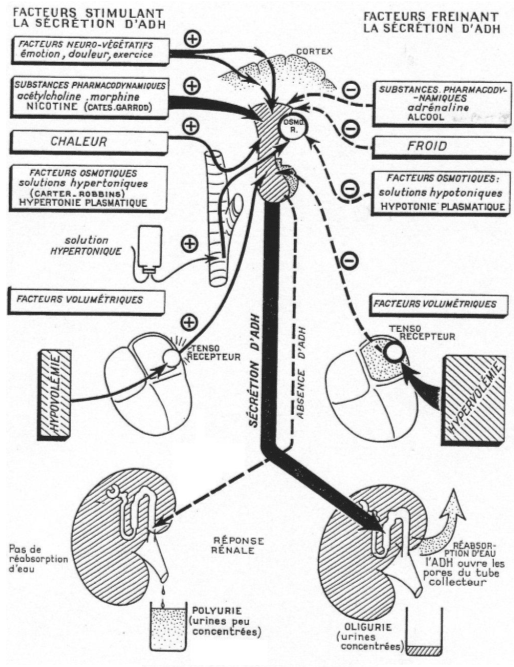
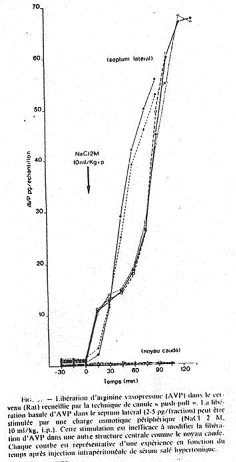
De –30’ à 0’, c’est l’enregistrement des références. De 0’ à 30’, le noyau caudé entraîne une libération d’ADH constante alors que le septum latéral réalise une importante libération d’ADH.
Au voisinage les neurones para ventriculaires, supra optiques et d’autres structures neuronales (osmorécepteurs), captent l’osmolarité ? ce sont des neurones à ADH.
1 Les facteurs volumétriques (volume sanguin).
Voir schéma plus haut.
S’il y a hypervolémie, celle ci est perçue par la paroi de l’oreillette gauche ; ces informations remontent par des fibres sensitives et vont être intégrées puis répercutées vers les deux noyaux concernés pour une libération d’ADH.
Une hypovolémie entraîne un arrête de la sécrétion d’ADH.
2 La température.
Une augmentation de la température externe entraînera une augmentation de la production d’ADH alors qu’une diminution de la température provoquera un blocage de la synthèse d’ADH.
3 Morphine et nicotine.
Une augmentation de la concentration en morphine et nicotine provoque un accroissement de la synthèse d’ADH.
4 L’alcool.
L’alcool va inhiber la production d’ADH.
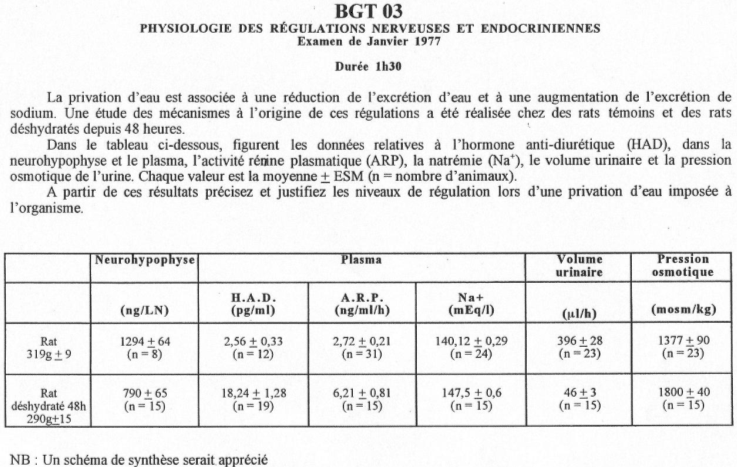
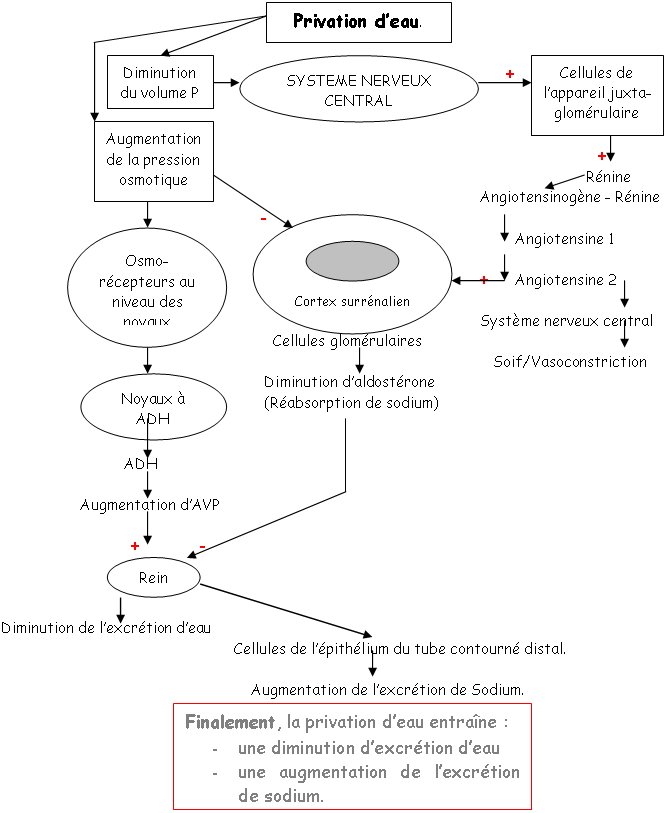
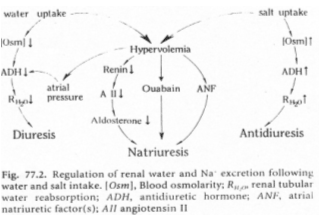
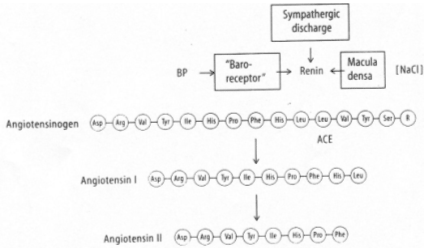
Une hypervolémie peut être induite par : une forte quantité de sel ou par une absorption d’eau élevée.
L’hyperosmolarité due au sel va être perçue :
• Au niveau central par des osmorécepteurs situés près des neurones à neurohormones. Il y a alors, au niveau de la neurohypophyse, libération d’ADH. Cette hormone, au niveau rénal, favorise la réabsorption d’eau (tube contourné distal, tube collecteur de Bellini) ? on parle d’antidiurèse.
• Au niveau des oreillettes, par des cellules sécrétant l’ANF (Facteur Natriurétique Atrial) qui est polypeptides de 28 acides aminés. Cet ANF a un rôle important pour l’homéostasie liquidienne, en favorisant la natriurèse (effet sur le tube contourné distal) : diminution de la réabsorption de sodium (remarque : l’aldostérone favorise l’absorption de sodium).
L’hypervolémie due à une forte absorption d’eau peut être perçue :
Par des volorécepteurs situés au niveau de l’oreillette gauche qui informent le système nerveux central via des fibres empruntant la voie vagale. En retour, il y a un effet au niveau des cellules à rénine qui en réduisent la sécrétion. On observe donc : une diminution de rénine circulante, puis, une diminution d’angiotensine 1 qui entraîne la diminution d’angiotensine 2.
Cette dernière diminution, au niveau de la zone glomérulée provoque un manque d’aldostérone arrivant au tube contourné distal. Il y a donc, chute de la réabsorption de sodium et de la natriurèse facilitée.
La diminution de l’osmolarité du milieu interne lors de l’absorption d’eau provoque une chute de l’AVP libérée donc, une diminution de l’eau réabsorbée  Diurèse.
Diurèse.
Chez certains modèles animaux, des pathologies se manifestent par des pertes d’eau importantes : on parle de « diabète insipide ». Cette maladie résulte d’une altération de la neurohypophyse.
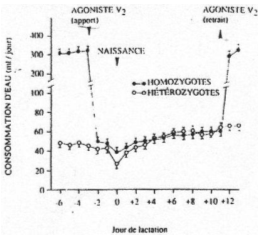
Le travail est réalisé sur des femelles homozygotes (atteintes) et sur hétérozygotes (« normales »). La consommation d’eau est plus élevée chez les homozygotes avant la lactation.
Deux jours avant la naissance, on ajoute dans les deux lots la molécule « agoniste V2 » et ce, jusqu’au 10ème jour.
L’agoniste, chez les homozygotes, entraîne la diminution de la prise d’eau jusqu’à des valeurs caractéristiques des hétérozygotes.
Après dix jours, sans agoniste, la prise d’eau des homozygotes revient à ses valeurs du début.
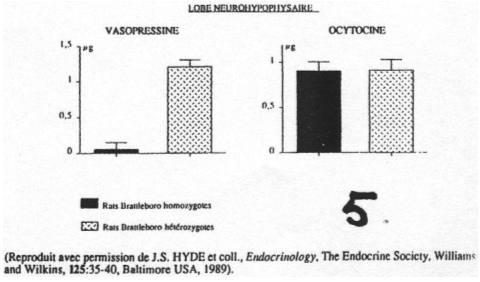
On observe une absence de synthèse d’ADH au niveau des noyaux para ventriculaire et supra optique.
L’AVP a une action sur les fibres musculaires lisses autour des artérioles : effet contracturant qui participe à l’hypertension. Elle provoque aussi, au niveau du foie, la sortie de glucose ( hormone hypercalcémiante).
hormone hypercalcémiante).
Dans le foie, le glucose est stocké sous forme de glycogène. L’AVP va se fixer sur des récepteurs membranaires de l’hépatocyte : les récepteurs V1 (à ADH) et forment un complexe hormone-récepteur qui va activer une enzyme membranaire (la phospholipase C ou PLC) par l’intermédiaire d’une protéine « G ».
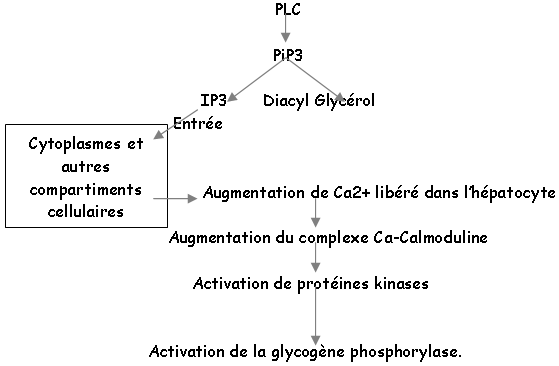
Le glycogène va être fragmenté en glucose1P, transformé en glucose6P par une isomérase qui aboutit au glucose grâce à la glucose-6-phosphatase.
Il y a une autre action extra-rénale.
Au niveau central, il existe des neurones mettant l’AVP en jeu comme un neurotransmetteur (chez les axones courts se terminant vers l’éminence médiane). Dans les situations de stress, il y a accroissement de la densité en ADH.
L’ADH peut passer dans le système porte de l’adénohypophyse où elle joue le rôle de libérine en stimulant les cellules synthétisant le cortisol. Ce dernier est hyperglycémiant car il augmente la néoglucogenèse hépatique (à partir d’acides aminés glucoformateurs et de glycérol).
L’excédant de glucose venant de la néoglucogenèse peut être stocké en glycogène.
II L’ocytocine.
Le complexe neurophysine-ocytocine est libéré et va :
- Stimuler les muscles utérins pour faciliter le passage des spermatozoïdes.
- Exercer une activité contractile sur le muscle utérin au moment de la naissance.
- Exercer un effet sur les fibres lisses des canaux galactophores afin d’éjecter le lait dans la gueule du jeune.
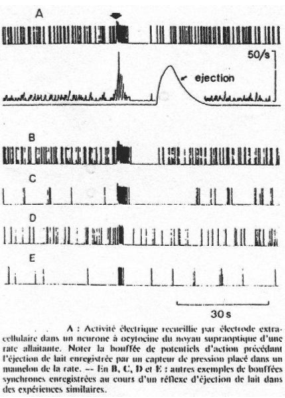
On a une rate équipée d’une micro électrode captant les signaux parvenant des zones para ventriculaire ou supra optique ainsi qu’une autre micro électrode pour la stimulation.
On lui place aussi un cathéter dans la jugulaire pour réaliser des injections.
Sur la partie du bas, on a représenté l’activité des petits.
La succion du mamelon (pression intramammaire) provoque une activité électrique sur un neurone à ocytocine.
Cette expérience est complétée par un enregistrement de corps cellulaires de neurones à ocytocine.
Il y a une très forte augmentation du nombre de spikes avant l’éjection du lait.
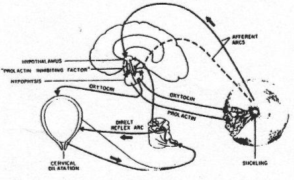
Au niveau du mamelon, on trouve des récepteurs à la pression. Ils informent le système nerveux central par des fibres nerveuses sensorielles. En retour, il y a une réponse par activation des neurones à ocytocine (noyaux supra optique et para ventriculaire). Il y a donc libération d’ocytocine dans la veine sortant de l’hypophyse. L’ocytocine arrive aux glandes mammaires et stimule les muscles (fibres musculaires lisses) pour provoquer l’éjection du lait : c’est exemple de réflexe neurohumoral.
Remarque : la prolactine favorise la synthèse de lait.
Dans la paroi musculaire utérine, au niveau du col vaginal et du cervix, existent des récepteurs sensibles à la pression. Ces derniers envoient des potentiels d’action qui empruntent la voie sensitive par l’intermédiaire de la moelle épinière (voie spino-thallamique) pour arriver dans le mésencéphale qui touche les neurones à ocytocine.
Cette hormone, par voie sanguine, arrive au niveau du myomètre où les fibres musculaires lisses se contractent. Chez les mammifères, ce réflexe neurohumoral est déterminant pour la mise-bas. Au terme de la gestation, le fœtus exerce une pression importante au niveau du cervix et entraîne le départ du message (potentiels d’action des récepteurs à la pression).
A chaque pression, on a en retour de l’ocytocine qui va faire se contracter le muscle utérin qui permet donc, une plus forte pression du fœtus : la fréquence de contractions s’accroît au fur et à mesure du temps.
Remarque : il a été montré dans les accidents où l’hypothalamus et l’hypophyse se dissocient qu’il est possible de sauver l’enfant mais qu’un accouchement normal est impossible car il n’y a plus d’ocytocine.
Les récepteurs utérins à l’ocytocine sont sous la dépendance de la progestérone (effet inhibiteur).
Dans la circulation sanguine, pendant la grossesse, il existe une enzyme (une tyrosinase) qui hydrolyse la liaison cystine-tyrosine de l’ocytocine et la rend ainsi inactive.
L’insuline (le pancréas endocrine).
I Généralités.
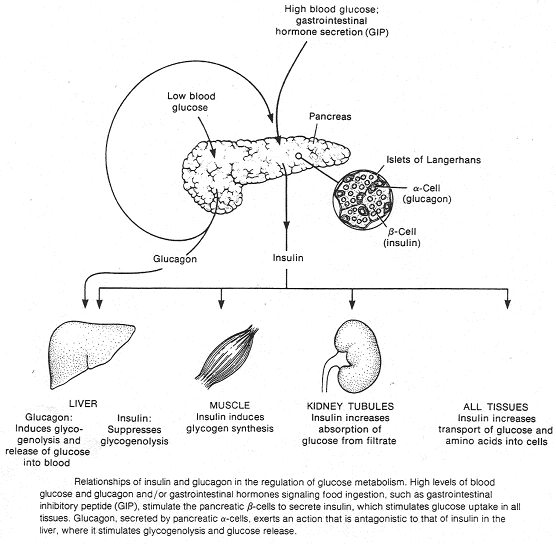
Le pancréas a une double fonction : endocrine et exocrine.
L’activité exocrine est liée à la présence de tissus constitués d’ascini pancréatiques qui déversent leurs produits de sécrétions dans les canaux pancréatiques puis dans la lumière intestinale. Le canal cholédoque permet de relier le foie à l’intestin. Au départ de ce canal, le liquide est verdâtre mais si l’on réalise une ligature près du foie, on obtient un liquide transparent : le liquide pancréatique.
II Historique.
Vers 1870, langerhans a constaté qu’il y avait un motif répétitif avec quelques structures disséminées : les îlots.
Vers 1900, on a constaté qu’après une pancréatectomie, le glucose urinaire et sanguin augmentait. Une greffe de pancréas sur une carotide de chien permettait de ne plus avoir d’hyperglycémie  il y a donc dans le pancréas, un produit qui est capable de réguler la glycémie.
il y a donc dans le pancréas, un produit qui est capable de réguler la glycémie.
On a observé qu’une ligature du pancréas entraînait la mort des ascini et montrait qu’il ne restait que les îlots.
On observe deux types de diabète :
- un manque d’insuline,
- une perte de la fonction de synthèse d’insuline due à l’âge qui peut être traitée par des médicaments (stimulation des îlots de langerhans).
Pendant la seconde guerre mondiale, on constatait que sur certains patients, les cellules produisant l’insuline étaient nécrosées. L’aloxane produite par écrasement musculaire provoquait la mort des cellules à insuline mais il restait un type cellulaire : les cellules  (ou A), à glucagon.
(ou A), à glucagon.
L’immunofluorescence a permis de mettre en évidence de nouveaux produits : la somatostatine (produite par les cellules D et qui exerce un rétrocontrôle négatif sur les cellules  et
et  ) et un polypeptide pancréatique (qui intervient dans les situations extrêmes en favorisant l’hyperglycémie).
) et un polypeptide pancréatique (qui intervient dans les situations extrêmes en favorisant l’hyperglycémie).
III Physiologie.
A Les cellules  des îlots de langerhans.
des îlots de langerhans.
Ces cellules  vont synthétiser trois chaînes polypeptidiques (A, B, C).
vont synthétiser trois chaînes polypeptidiques (A, B, C).
Les chaînes A (21 acides aminés) et B (30 acides aminés) sont reliées entre elles par deux ponts disulfures : cyst7A – cyst7B et cyst20A – cyst19B.
La chaîne est auto reliée entre cyst6A et cyst11A.
La synthèse protéique a lieu dans le réticulum endoplasmique et le produit est la pro-insuline. Elle passe dans l’appareil de Golgi où elle est enrobée d’une membrane : ce sont des granules qui contiennent donc la pro-insuline (les trois chaînes) mais aussi des enzymes protéolytiques qui vont dégrader la pro-insuline en insuline + peptide C. Ces granules migrent vers la membrane et sont libérés par exocytose dans le courant circulatoire.
Finalement, sont libérés : 94% d’insuline et de peptide C et 6% de pro-insuline.
Les cellules  (à glucagon) sont à l’extérieur, les cellules
(à glucagon) sont à l’extérieur, les cellules  sont à l’intérieur. Les cellules
sont à l’intérieur. Les cellules  synthétisent la somatostatine qui va avoir un effet inhibiteur sur le glucagon et l’insuline.
synthétisent la somatostatine qui va avoir un effet inhibiteur sur le glucagon et l’insuline.
Le sang est récupéré par une veine efférente, passe dans une veine porte et va au foie.
B La régulation au niveau nerveux.
- Au niveau de la glycémie : à l’occasion de chaque prise alimentaire, on observe une légère augmentation du taux de glucose dans le sang (5mM à 6,5mM).
- Un pic d’insulinémie est présent en même temps que l’accroissement du taux de glucose.
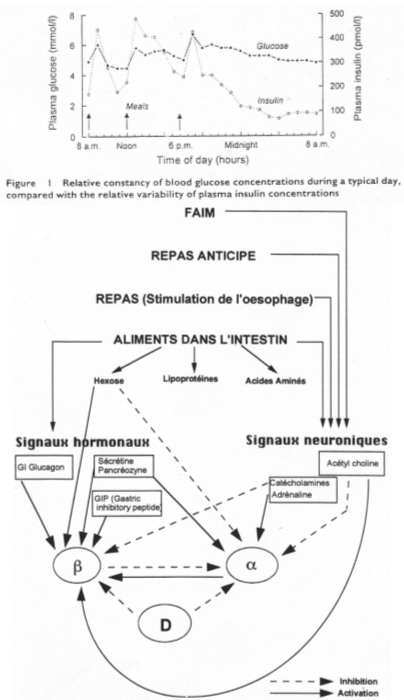
On imagine, après un jeune physiologique, une sensation de faim intégrée au niveau central.
Il y a une double innervation de l’îlot : le système parasympathique (par les fibres du nerf vague, venant du noyau de l’hypothalamus latéral). Le neurotransmetteur est l’acétylcholine (avec un relais au niveau d’un ganglion parasympathique). L’acétylcholine va réagir avec un récepteur membranaire (muscarinique) et entraîner la libération d’insuline.
Au niveau de l’étage hypothalamique, on a un noyau important : le VMH qui est impliqué dans le phénomène de satiété. L’information part du VMH, passe par le nerf splanchnique, libère de l’acétylcholine comme premier neurotransmetteur, passe un ganglion mésentérique supérieur et termine son cheminement par une fibre orthosympathique qui libère de la noradrénaline comme dernier neurotransmetteur (et se fixe sur les récepteurs  2). Il y a dans ce cas, inhibition de la synthèse et de la libération d’insuline.
2). Il y a dans ce cas, inhibition de la synthèse et de la libération d’insuline.
Pendant le repas, on trouve une activité du système parasympathique alors que c’est le système nerveux orthosympathique qui est prédominant durant un jeune.
La sensation de faim est intégrée au niveau central et accentue la libération d’insuline précoce pour favoriser l’absence du pic de glucose. Un « repas anticipé » va renforcer le pic d’insuline.
Dans la bouche, autour de la langue, on trouve des récepteurs au glucose qui, lorsqu’ils sont stimulés, vont renforcer la libération d’insuline.
Au niveau duodénal, on trouve aussi des cellules sensibles au glucose qui le même effet que les précédentes quand elles sont stimulées.
Quand l’absorption de glucose démarre, il y a activation de cellules endocrines de l’épithélium intestinal. Il y a synthèse de GIP qui freine la sécrétion de suc gastrique par voie sanguine, au niveau des îlots, grâce à un récepteur au GIP qui permet une forte stimulation de la synthèse et la libération d’insuline.
Avant l’absorption, les sécrétions intestinales vont stimuler les cellules  .
.
L’activité du système orthosympathique est faible :  finalement, il y a forte synthèse et libération d’insuline. Pendant l’absorption, l’augmentation de glucose entraîne une hyperglycémie qui va être perçue au niveau des îlots de Langerhans.
finalement, il y a forte synthèse et libération d’insuline. Pendant l’absorption, l’augmentation de glucose entraîne une hyperglycémie qui va être perçue au niveau des îlots de Langerhans.
C La régulation au niveau moléculaire.
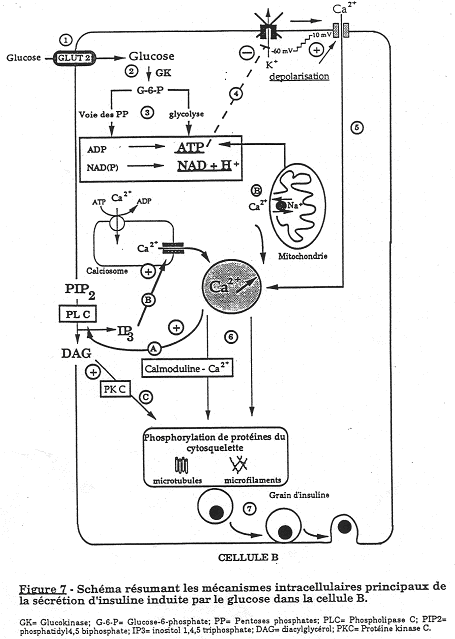
Le glucose, sur la membrane plasmique de la cellule  , pénètre facilement dans la cellule grâce à l’action d’une protéine favorisant l’entrée de ce sucre (transporteur de Glucose : Glut-2). Ce glucose va être phosphorylé par une glucokinase (GK). Le G6P produit est engagé dans deux voies de métabolisme importantes :
, pénètre facilement dans la cellule grâce à l’action d’une protéine favorisant l’entrée de ce sucre (transporteur de Glucose : Glut-2). Ce glucose va être phosphorylé par une glucokinase (GK). Le G6P produit est engagé dans deux voies de métabolisme importantes :
 La voie des pentoses phosphates,
La voie des pentoses phosphates,
 La voie de la glycolyse.
La voie de la glycolyse.
Les résultats des ces voies métaboliques se traduisent par une élévation d’ATP intracellulaire. Ce taux d’ATP inhibe alors les canaux K-ATP dépendants situés au niveau de la membrane de la cellule  .
.
La fermeture de ces canaux est accompagnée d’une dépolarisation des cellules  qui permet l’ouverture de canaux Ca2+. Le calcium intracellulaire va augmenter et se fixer sur la calmoduline pour former un complexe provoquant la phosphorylation de protéines du cytosquelette et des micro filaments.
qui permet l’ouverture de canaux Ca2+. Le calcium intracellulaire va augmenter et se fixer sur la calmoduline pour former un complexe provoquant la phosphorylation de protéines du cytosquelette et des micro filaments.
Ces modifications vont favoriser la migration des grains contenant l’insuline vers la membrane de la cellule  . Il y a ensuite fusion et exocytose vers le courant circulatoire.
. Il y a ensuite fusion et exocytose vers le courant circulatoire.
Les cellules  peuvent recevoir des informations mettant en jeu des enzymes membranaires (phospholipase C = PLC) qui stimulées par PIP2, donnent :
peuvent recevoir des informations mettant en jeu des enzymes membranaires (phospholipase C = PLC) qui stimulées par PIP2, donnent :
- L’IP3 (second messager) qui provoque la libération du calcium contenu dans les organites du cytoplasme (forme alors le complexe calmoduline-Ca2+ qui favorise l’exocytose).
- Du diacylglycérol qui a un effet positif sur des protéines kinases C en leur permettant de phosphoryler le cytosquelette et les micro tubules afin d’augmenter l’exocytose.
Au niveau de la membrane plasmique, on trouve deux types de récepteurs couplés à l’adénylate cyclase :
- Les récepteurs  2 adrénergiques : par une protéine « G » inhibitrice, il y a diminution de l’adénylate cyclase, donc, diminution d’AMPc et finalement, réduction de l’exocytose.
2 adrénergiques : par une protéine « G » inhibitrice, il y a diminution de l’adénylate cyclase, donc, diminution d’AMPc et finalement, réduction de l’exocytose.
- Les récepteurs  adrénergiques (stimulés par la noradrénaline), sont couplés à une protéine « G » excitatrice.
adrénergiques (stimulés par la noradrénaline), sont couplés à une protéine « G » excitatrice.
Le neuropeptide pancréatique, au niveau central, stimule l’hypothalamus latéral (prise alimentaire) en entraîne donc l’inhibition de la sécrétion d’insuline.
Pour favoriser son action, l’insuline inhibe dans l’îlot, par effet paracrine, les cellules à glucagon. Quand la glycémie est revenue à la normale, le glucagon ré augmente et l’insuline diminue. Cette remontée de glucagon va favoriser au niveau hépatique, la reprise de la glycogénolyse afin de maintenir la glycémie.
L’insuline est une hormone favorisant l’entrée de glucose dans les tissus.
IV Mécanisme favorisant l’entrée de glucose par l’insuline dans les tissus adipeux blancs.
Le glucose va être transformé en acide gras puis en triglycérides.
A La pénétration du glucose.
La membrane porte des récepteurs à insuline qui, lorsqu’ils sont sous la forme du complexe hormone-récepteur, envoient un signal vers les transporteurs glucose en réserve. Ces derniers sont transloqués vers la membrane plasmique où ils se mettent en place pour favoriser l’entrée de glucose.
B La dissociation du complexe hormone-récepteur.
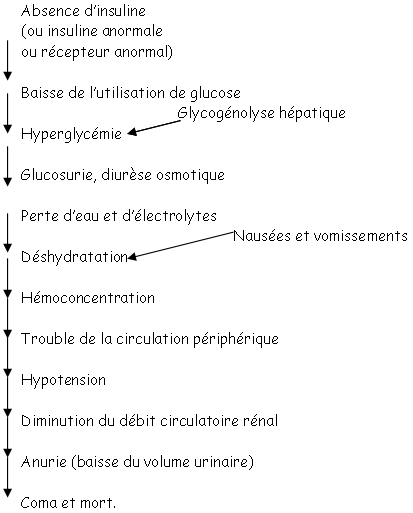
Cette dissociation provoque l’internalisation des transporteurs. On dit alors que ces transporteurs glucose sont insuline-dépendants. L’absence d’insuline provoque la stagnation du glucose dans le milieu périphérique. Dans ce cas, le transporteur est le Glut4.
Ce glut4 est aussi présent sur la membrane des fibres musculaires.
C Pathologie.
Certaines pathologies se manifestent par une hyperglycémie à cause du Glut4 des tissus adipeux et musculaires qui entraîne l’augmentation du glucose périphérique.  C’est le diabète de type 2.
C’est le diabète de type 2.
D Fonctionnement.
1 Première hypothèse.
La fixation de l’insuline sur les sous-unités  entraîne une auto-phosphorylation des sous-unités
entraîne une auto-phosphorylation des sous-unités  qui acquièrent alors la capacité de phosphoryler des substrats intracellulaires (tyrosine). L’interaction insuline/sous-unités
qui acquièrent alors la capacité de phosphoryler des substrats intracellulaires (tyrosine). L’interaction insuline/sous-unités  provoque le développement de l’activité tyrosine kinase.
provoque le développement de l’activité tyrosine kinase.
 Des protéines phosphorylées donneront la réponse cellulaire.
Des protéines phosphorylées donneront la réponse cellulaire.
2 Seconde hypothèse.
La fixation de l’insuline sur les sous-unités  entraîne une auto-phosphorylation des sous-unités
entraîne une auto-phosphorylation des sous-unités  qui permet l’apparition d’un second messager.
qui permet l’apparition d’un second messager.
C’est le métabolisme du glucose qui déclenche la libération d’insuline.
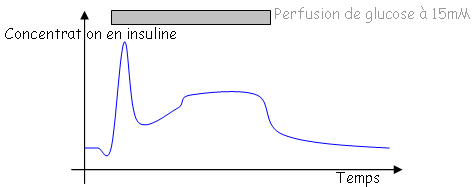
Cette réponse est typique d’un compartiment facilement mobilisable.
Le stimulus (glucose) excite les cellules  qui vont sécréter l’insuline. Parallèlement, il existe une émiction (diminution), puis un rétablissement du fonctionnement.
qui vont sécréter l’insuline. Parallèlement, il existe une émiction (diminution), puis un rétablissement du fonctionnement.
 L’entrée du glucose et la fermeture des canaux K+ permet l’entrée du calcium qui favorise l’exocytose en se concentrant de plus en plus dans le compartiment cellulaire. Cette croissance provoque la réouverture des canaux K+ et la fermeture des canaux Ca2+.
L’entrée du glucose et la fermeture des canaux K+ permet l’entrée du calcium qui favorise l’exocytose en se concentrant de plus en plus dans le compartiment cellulaire. Cette croissance provoque la réouverture des canaux K+ et la fermeture des canaux Ca2+.
 On parle alors de sécrétion bimodale de l’insuline.
On parle alors de sécrétion bimodale de l’insuline.
V Les effets globaux de l’insuline.
A Le métabolisme glucidique.
Si la concentration en glucose dépasse 1,8 g/L, le tube contourné proximal n’arrive pas à réabsorber tout le glucose : il reste dans la lumière puis passe dans l’urine.
B Le métabolisme lipidique.
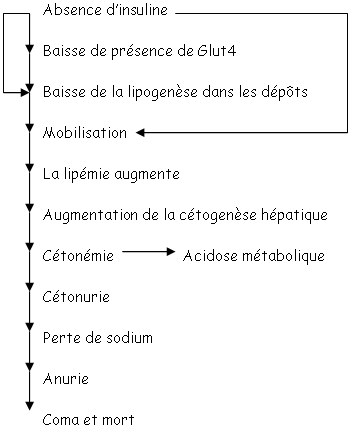
Les tissus adipeux ont deux fonctions :
- Ils réalisent la mise en réserve par la lipogenèse
- Pendant le jeune, ils fournissent de l’énergie mais pour cela, ils ont besoin d’une enzyme (lipase) hormonosensible.
L’insuline régule la lipogenèse et la lipolyse par une mobilisation lipidique. Il y a alors augmentation des acides gras transportés, liés à l’albumine. Des lipoprotéines (les chylomicrons) transportent les acides gras vers la lymphe puis dans la circulation générale pour finir dans les tissus utilisateurs.
Pour le transfert des acides gras, il y a besoin de LipoProtéinesLipase (LPL) qui digère les triglycérides en acides gras qui peuvent alors pénétrer dans les tissus adipeux blancs pour participer à la lipogenèse. La LPL est stimulée par l’insuline. En absence d’insuline, il y a diminution de l’activité de la LPL et donc, une stagnation des chylomicrons : le plasma devient alors « laiteux ».
Dans ce cas, la grande arrivée de lipides dans le foie (dans les hépatocytes) développe une nouvelle voie métabolique : la cétogenèse.
Les corps cétoniques obtenus passent dans la circulation, provoquent une cétonémie et une diminution de pH.
On parle alors d’acidose métabolique (accumulations de sels cétoniques). De plus, il y aura perte de sodium et donc d’eau.
C Le métabolisme protéique.
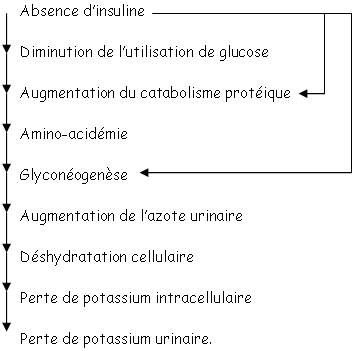
Le catabolisme des acides aminés, dans le foie, entraîne la synthèse d’urée qui provoque l’augmentation d’urée urinaire. Il y a alors déshydratation cellulaire, perte de potassium intracellulaire puis mort cellulaire.
VI Les différents diabètes.
On trouve deux cas distincts de diabète.
A Le diabète de type I.
Ce diabète ne peut être corrigé que par apport exogène d’insuline. Le sujet ne possède pas d’îlots de langerhans fonctionnels : on parle de diabète juvénile ou de type I.
B Le diabète d’âge adulte.
Il y a apparition d’hyperphagie qui provoque une augmentation du poids. Les tissus adipeux deviennent de plus en plus résistants à l’insuline. Les îlots de langerhans vont accroître leur production d’insuline mais celle-ci sera toujours insuffisante pour permettre l’entrée de glucose.
Pour soigner cette hyperglycémie, il y a différentes cibles et méthodes. On peut faciliter la synthèse d’insuline endogène grâce aux sulfamides hypoglycémiants ou favoriser l’activité de Glut4 par les biguanides.
L’hormone de croissance (growth hormon).
I Généralités.
La synthèse et la sécrétion d’hormone de croissance (=GH) démarrent au niveau adénohypophysaire. Les cellules responsables de ce travail sont les cellules somatotropes que l’on retrouve sur toutes les parties latérales. Elles représentent 40% de l’adénohypophyse.
Généralement, les cellules de cette glande fabriquent des stimulines et non des hormones, ce qui est une différence fonctionnelle. La GH intervient dans tout l’organisme et a donc un rôle important.
Cette glande hypophysaire pèse 400mg dont 8mg de cellules somatotropes.
II Synthèse.
Chez l’Homme, on trouve le gène de la GH sur le chromosome 17. Ce gène est composé de 5 exons et de 4 introns. Il présente une très forte homologie avec d’autres gènes (90% avec le gène de PL et 42% avec le gène de PrL). Le gène de la GH mesure moins de 2kb.
Les gènes codant pour GH et PL se trouvent tous les deux sur le chromosome 17 alors que celui codant pour PrL se trouve sur le chromosome 6. On trouve de multiples copies des gènes de GH et de PL.
III Structure.
La GH est une hormone de 191 acides aminés comportant deux ponts disulfures et composé d’une unique chaîne. Il existe toutefois des variations : deux formes de GH. La forme longue et majoritaire (entre 80 et 90%), de 191 acides aminés pèse 22Kda. La seconde forme (courte) vient du même gène mais a subit une transcription différente. Les deux ARNm sont distincts. La forme courte montre l’absence des acides aminés 32 à 44 de la forme longue.
La forme courte a les mêmes effets que la forme longue sauf sur le métabolisme glucidique où elle n’en a aucun.
IV Le transport sanguin.
La GH a la particularité de ne pas être présente seule mais dimérisée ou polymérisée. Parfois les deux formes de GH s’hétérodimérisent. Généralement, in vitro, la dimérisation provoque une chute de son effet biologique.
Dans le sang, la GH est associée à des protéines de transport.
A La GHBPI.
Ce transporteur a une faible affinité, de l’ordre du micromolaire. Son poids est de 170Kda et il est capable de porter beaucoup de GH (0,75mMolaire de GH liée/L).
B La GHBPII.
Cette protéine est beaucoup plus affine (10nM) ; elle est plus petite (52Kda) et lie peu de GH (0,9nMolaire de GH liée/L).
Cette meilleure affinité s’explique car ce transporteur à la même structure que la partie NH2 terminale du récepteur membranaire (forme courte du récepteur) à la GH. Dans ce cas, on parle de « récepteurs circulants solubles ».
C Sécrétion et dégradation de la GH.
L’hormone de croissance a une demi-vie de 20 à 30 minutes. Comme la plupart des hormones peptidiques, son catabolisme est hépatique. Quand cette GH est libérée, sa vitesse de répartition (clairance) est assez rapide : 125mL/m²/min.
V Les effets de la GH.
La GH a un effet qui favorise la croissance (au niveau des os) et un effet sur les métabolismes lipidique et glucidique (graisses et sucres).
A L’action de la GH.
Il y a un effet direct de la GH sur la croissance et un effet indirect sur le métabolisme, par l’intermédiaire des somatomédines (IGF = Insuline Like Growth Factor) : la GH va stimuler la libération d’IGF par le foie (effet de type stimuline).
La GH n’a pas d’effet sur la prolifération des cellules, alors que si l’on rajoute de l’IGF, la multiplication cellulaire s’accélère.
Les IGF sont de puissants facteurs mitogéniques et plus de la moitié des effets est due à ces IGF.
Les deux IGF (1 et 2) ont une structure similaire à l’insuline et posent donc un problème de discrimination entre l’insuline et ces IGF.
1 IGF1.
Cet IGF est sécrété sous l’effet de la GH a un pouvoir puissant sur la prolifération. Il est synthétisé par :
- Certains fibroblastes.
- L’hypophyse.
- Les adipocytes.
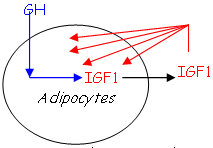
La concentration plasmatique d’IGF1 est à peu près stable malgré la fluctuation de GH
2 IGF2.
La sécrétion d’IGF2 est relativement constante jusqu’à quarante ans, comme pour IGF1.
B Contrôle de la sécrétion de GH.
La sécrétion de GH est contrôlée au niveau hypothalamique en mettant en jeu deux types de libérines :
- La somatocrinine (ou GH-RH) qui a un effet excitateur.
- La somatostatine (ou SR-IF) qui a un effet inhibiteur.
La GH-RH, venant des cellules du noyau arqué, permet l’augmentation de la sécrétion de GH par les cellules somatotropes.
La SR-IF, aussi synthétisée dans le pancréas, va agir au niveau de l’épithélium de la muqueuse intestinale où elle a un rôle dans l’absorption des nutriments.
La GH a une sécrétion rythmique circadienne (rythme naturel) qui est observée après l’endormissement, une heure après le sommeil profond. Elle se déroule donc essentiellement la nuit. La sécrétion se fait par pic et le premier est le plus important.
Cette sécrétion est plus importante pendant la puberté et chez les femmes, pendant le premier trimestre de la grossesse.
La GH-RH agit à tous les niveaux cellulaires : transcription, traduction, libération.
La SR-IF n’agit qu’en empêchant l’exocytose.
On a deux types de feed-back :
- Le feed-back de GH est court. Il inhibe la synthèse de GH-RH et stimule la synthèse de SR-IF.
- Le feed-back d’IGF1 est long et agit comme celui de GH.
Les hormones thyroïdiennes et les glucocorticoïdes sont des stimulants de la synthèse de GH.
Parmi les facteurs inhibiteurs, on trouve le facteur alimentaire où l’hyperglycémie ralentie la libération de GH, tout comme le stress.
C Les effets directs de GH.
- Sur les adipocytes, GH stimule la lipolyse.
- Sur le métabolisme glycogénolytique, il y a augmentation de l’utilisation de glucose.
- GH permet la libération d’IGF.
 Les effets de GH sont visibles en premier, surtout la lipolyse et la glycogénolyse.
Les effets de GH sont visibles en premier, surtout la lipolyse et la glycogénolyse.
Les IGF ont des effets :
- lipogéniques et antilipolytiques.
- Glycogéniques.
 Ces effets sont visibles en seconde partie.
Ces effets sont visibles en seconde partie.
VI Les physiopathologies.
A Physiopathologies par déficience de GH.
La principale pathologie est le nanisme. Celui-ci peut être du à :
- Un problème hypothalamique (somatostatine, somatocrinine).
- Un problème hypophysaire :
• Les cellules somatotropes synthétisent de la GH inactive.
• Les cellules somatotropes ne produisent pas de GH.
• Aplasie de l’hypophyse : peu de cellules somatotropes.
- La GH est incapable d’activer son récepteur ( résistance à l’hormone) : le récepteur est incapable de recevoir la GH ou de donner le message intracellulaire.
résistance à l’hormone) : le récepteur est incapable de recevoir la GH ou de donner le message intracellulaire.
Remarque : Chez les pigmés, le problème vient d’IGF1.
On utilise de la GH recombinante pour le traitement d’une absence de GH.
B Pathologie par excès de GH.
La pathologie typique est l’acromégalie (gigantisme).
Cette acromégalie peut être due à une tumeur hypophysaire à GH mais aussi à des tumeurs ectopiques (à l’extérieur de la glande). Une autre origine peut être une tumeur pancréatique qui entraînerait une trop forte synthèse de GH-RH.
La conséquence de ces différents cas est un développement important de la masse osseuse et la formation de beaucoup de tissus conjonctifs. Il y a aussi hypertrophie cardiaque, hépatique et rénale. On trouve souvent des cas de diabète.
La mortalité est deux fois supérieure que chez les non malades. La principale thérapie est la chirurgie.
La glande corticosurrénale.
IIntroduction, Généralités.
A Morphologie et rôle.
La glande corticosurrénale est située au-dessus du rein. Chez l’Homme, c’est une capsule collée sur le rein ; chez d’autres espèces, elle est beaucoup plus éloignée. Cette glande est capable de sécréter de nombreux produits complètement différents. Chez l’Homme, son poids est compris entre 4 et 6 grammes et elle est séparée en deux parties distinctes :
- La corticosurrénale, à l’extérieur, assure la synthèse de stéroïdes dérivant du cholestérol.
- La médullosurrénale, à l’intérieur, assure la synthèse des catécholamines ou amines (adrénaline, noradrénaline,…).
B Origine et formations.
Embryologiquement, les deux types cellulaires (corticosurrénale et médullosurrénale) sont différents. Le mésoderme a donné la corticosurrénale. Le neurectoderme a donné la médullosurrénale.
La glande corticosurrénale est composée de trois zones importantes :
- La partie glomérulée, fine, à l’extérieur.
- La zone fasciculée, la plus large, au milieu.
- La zone réticulée, à l’intérieur.
- En dessous, c’est la glande médullosurrénale.
Ces zones sécrètent des hormones différentes (mais toujours des stéroïdes). Les zones glomérulée et fasciculée synthétisent aussi des corticoïdes.
C Synthèses, vascularisation et innervation.
La zone glomérulée va donner des minéralocorticoïdes (aldostérone).
La zone fasciculée va surtout synthétiser des glucocorticoïdes : le cortisol (présent seulement chez l’Homme et le bœuf). Chez d’autres espèces, ce cortisol est remplacé par la corticostérone.
La zone réticulée donne des androgènes dits « faibles ». Ceux-ci sont complètement différents de la testostérone. C’est la seule source d’androgène de la femelle. Certains dérèglements pathologiques (tumeurs) vont induire la sécrétion de nombreux androgènes (faibles).
Le cortex est fortement vascularisé par des vaisseaux courts. Les vaisseaux qui irriguent la médullosurrénale sont différents et dits « perforants ».
L’innervation est surtout présente au niveau de la médullosurrénale (90% de l’innervation totale de l’ensemble) par le système orthosympathique (fibres cholinergiques).
II Synthèses, modalités de sécrétion.
L’ACTH de l’adénohypophyse contrôle le développement des zones réticulée et fasciculée. La zone glomérulée en est indépendante.
Les molécules de la corticosurrénale sont lipidiques mais peuvent entrer directement dans la cellule.
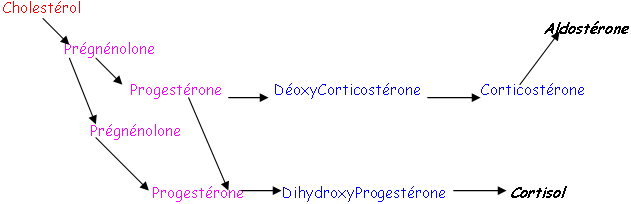
Les sécrétions (d’aldostérone et surtout de cortisol) sont rythmiques, à cause de l’ACTH qui est libéré par flash de 10 minutes toutes les demi-heures. On trouve en plus, un rythme circadien. Le cortisol est une hormone qui favorise l’utilisation des substrats énergétiques.
A La zone fasciculée : le cortisol.
Lors d’un stress prolongé, la production d’ACTH est augmentée et favorise ainsi l’augmentation des glucocorticoïdes qui vont favoriser le catabolisme hépatique. Les glucocorticoïdes ne peuvent pas être excrétés par le rein. Pour les rendre éliminables, ils doivent passer par le foie qui les rend un peu plus hydrophiles en leur ajoutant des sulfoconjugués ou des glucoronoconjugués.
B Les transporteurs hormonaux.
Les hormones lipidiques ne peuvent pas se déplacer seules dans le sang : elles nécessitent la participation de transporteurs. Parmi ceux-ci, on trouve l’albumine (non spécifique) et la CBG (Corticostéroïd Binding Globuline) qui est la première à se lier au cortisol. Ce dernier transporteur est aussi appelé « Transcortine ».
Pour qu’il y ait des liaisons visibles avec l’albumine, il faut que les concentrations présentes soient très fortement supérieures à la concentration normale en cortisol.
La synthèse et la sécrétion des protéines de transport est fonction que la concentration en hormone.
C Régulation de la sécrétion hormonale.
On a deux voies pour réguler la synthèse de ces hormones.
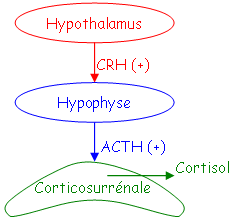
Le stress agit sur le CRH qui agit à son tour sur un peptide à large spectre : le POMC (ProOpioMélanoCortine).
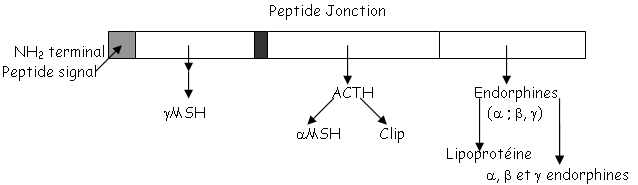
L’ACTH est un petit peptide de 39 acides aminés qui est actif grâce aux 24 premiers. Il y a une différence de spécificité des acides aminés : les acides aminés 13 à 24 exercent un contrôle sur la mobilisation de cortisol et un peu sur celle de l’aldostérone.
La stimulation des récepteurs membranaires spécifiques à l’ACTH permet l’activation de l’adénylate cyclase (enzyme) qui transforme l’ATP en AMPc. Ce dernier produit va moduler le métabolisme du cholestérol et l’oriente vers la synthèse de cortisol.
Il y a aussi prolifération des cellules de la zone fasciculée.
Le cortisol a des effets de feed-back négatif sur le CRH et l’ACTH.
On observe au cours du temps, un phénomène de désensibilisation des récepteurs au CRH situés au niveau de l’hypophyse.
III Rôle physiologique.
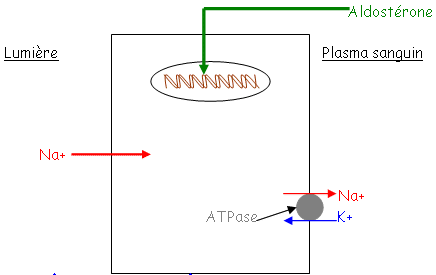
A L’aldostérone.
L’aldostérone va agir sur les reins, la muqueuse intestinale et les glandes salivaires et sudoripares. L’aldostérone permet un contrôle des échanges en Na et K : c’est la rétention sodique réalisée par une ATPase Na/K. En réalité, l’aldostérone stimule le gène codant pour cette enzyme.
B Les glucocorticoïdes.
Les glucocorticoïdes ont une action sur le métabolisme glucidique. Ils permettent la synthèse (gluconéogenèse) de sucre à partir d’acides aminés.
A long terme, ce sont des hormones à effet diabétogène.
Ces hormones ont aussi un effet sur le métabolisme protéique. Elles permettent de dégrader les protéines en acides aminés, puis en sucres. Elles servent toujours à fournir de l’énergie.
C Les autres effets.
- Les glucocorticoïdes ont un effet anti-inflammatoire en diminuant la synthèse de collagène.
- Ils inhibent la présence et la synthèse de médiateurs à l’inflammation (histamine et prostaglandine).
- Ils ont un effet immunodépresseur en diminuant la réponse immunitaire.
Ce sont des hormones fortement libérées pendant une période de stress. Ils sont aussi lipolytiques par leur mobilisation des acides gras.
 Finalement, les glucocorticoïdes sont des hormones qui permettent la mobilisation des diverses sources énergétiques.
Finalement, les glucocorticoïdes sont des hormones qui permettent la mobilisation des diverses sources énergétiques.
D Le stress.
Le stress (de courte durée) va immédiatement stimuler la production d’adrénaline (par la médullosurrénale) pour qu’elle se diffuse rapidement dans l’organisme. Cette libération va permettre :
- L’augmentation de la fréquence cardiaque.
- L’augmentation de la pression artérielle.
- L’augmentation de la glycogénolyse (dans le foie).
- D’amener le glucose sanguin vers les muscles.
- L’augmentation de la bronchodilatation.
- De diminuer l’activité du système digestif (et des fonctions végétatives).
- La diminution de la diurèse.
- De favoriser la circulation sanguine allant vers les muscles.
- D’augmenter la vigilance.
Le jeune est un stress important mais à long terme. Ce type de stress va impliquer la glande corticosurrénale :
- Il y a libération de minéralocorticoïdes qui favorisent la rétention d’eau et de sel. Ces hormones permettent donc d’augmenter la pression et le volume artériel.
- Il y a aussi libération de glucocorticoïdes qui vont faire augmenter la glycémie par protéolyse, déamination hépatique et gluconéogenèse. Une autre de leur action est la diminution des réactions inflammatoires.
IV Les physiopathologies.
A Aplasie de la glande corticosurrénale : Maladie d’Addison.
La tuberculose va détruire les cellules corticosurrénales. Les symptômes sont alors une forte fatigabilité et un amaigrissement. On peut aussi observer une mélanodermie (foncement irrégulier ou hétérogène de la couleur de la peau).
B Syndrome de Cushing (excès d’hormones venant de la corticosurrénales).
Ce syndrome de Cushing entraîne :
- L’apparition de diabète.
- L’augmentation de la masse graisseuse.
- De l’hypertension artérielle par augmentation de la volémie.
- Le catabolisme musculaire (destruction des muscles).
- L’augmentation de la fragilité du corps : vergetures, « bleus » faciles, ostéoporose.
Les raisons de l’apparition de ce syndrome de Cushing peuvent être :
- Une tumeur de la glande corticosurrénale.
- Une tumeur de l’hypophyse.
- Une tumeur ectopique par des cellules qui deviennent incontrôlables.
Physiologie endocrine du mâle.
I Rappels anatomiques.
L’appareil mâle est constitué :
- des organes qui produisent les gamètes et les hormones : ce sont les testicules.
- Les vois sécrétrices.
- Les glandes annexes : prostate, vésicule séminale…
Les testicules ont un poids et une taille variable.
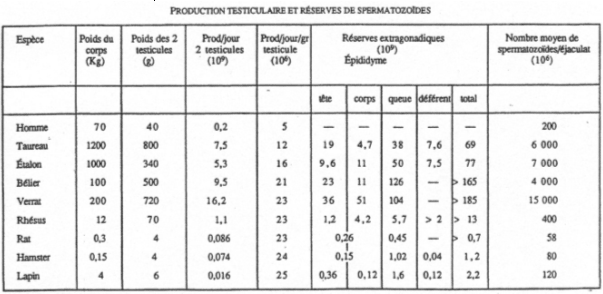
On trouve un rapport de 1/1500 chez l’homme et seulement 1/100 chez le rat.
La tunique de l’albuginée est composée de collagène et de fibres musculaires et sert à propulser les spermatozoïdes vers les voies excrétrices.
Les testicules sont séparés par des cloisons en lobules (à peu près 300 au total). Chaque lobule contient un à quatre tubes séminifères (très contournés).
Dans les tubes séminifères, on trouve les cellules séminales. Entre ces tubes, on trouve de nombreux vaisseaux sanguins ainsi que des terminaisons nerveuses et de cellules de Leydig.
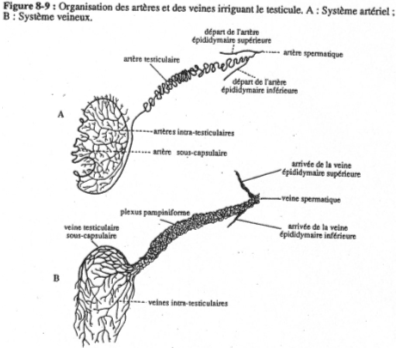
La vascularisation des mammifères est particulière car les testicules sont externes (dans le scrotum). La spermatogenèse ne peut avoir lieu que si la température des tubes séminifères est inférieure de 5 à 6°C à la température corporelle. Si la température augmente trop, il n’y a pas de spermatogenèse normale.
La cryptorchidie est la non-sortie des testicules. On trouve des cas de « stérilité professionnelle » chez les boulangers, les ouvriers des hauts fourneaux.
La vascularisation est spiralée en contact étroit avec le système veineux afin de favoriser les échanges thermiques : c’est le plexus pampiniforme.
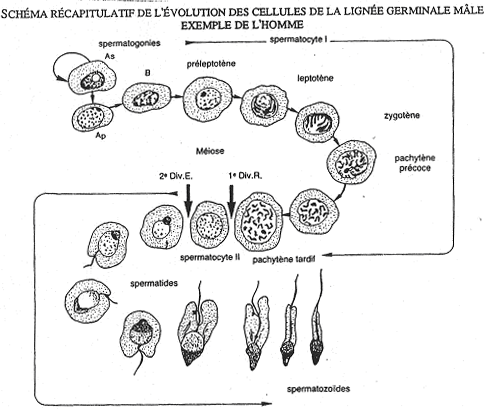
La spermatogenèse à lieu dans les tubes séminifères. Les spermatozoïdes gagnent l’épididyme avec une durée de transit de 2 à 15 jours selon les espèces (15 jours chez l’homme). La maturation des spermatozoïdes est importante. Elle permet : l’acquisition de la mobilité fléchante et la capacité à se fixer sur la zone autour de l’ovocyte.
Une fois maturés, les spermatozoïdes gagnent les canaux déférents puis l’urètre.
Les glandes annexes (glandes séminales, prostate, …) donnent le volume qui représente l’essentiel du sperme. Elles permettent l’enrichissement en minéraux, enzymes, facteurs de croissance, fructose.
Les trois glandes annexes mineures sont la glande de Cowper, la glande de Tyson et la glande de Littré. Elles donnent le mucus pour la lubrification et des phéromones.
II Les cellules de Sertoli.
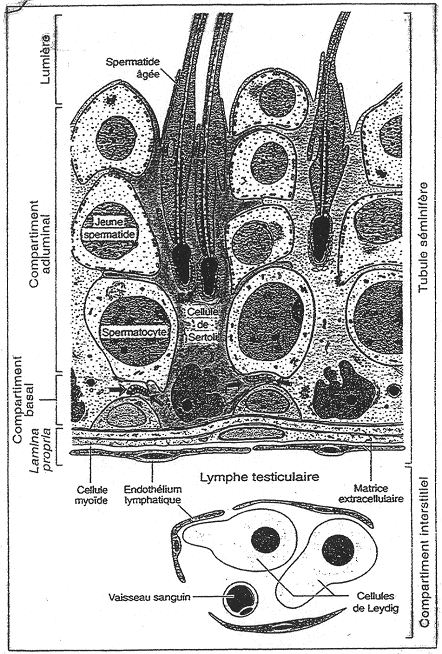
A la base, on trouve des cellules myoïdes qui sont un intermédiaire entre les fibroblastes et les cellules musculaires. Ces cellules permettent la formation de d’une matrice extracellulaire abondante. Dans le tube, on trouve deux compartiments : le compartiment basal et le compartiment adluminal.
Une cellule de Sertoli est une cellule de soutien des cellules germinales. Les cellules de Sertoli sont reliées entre elles par des jonctions étanches serrées. On trouve des cellules spermatiques au-dessus de la première jonction. Ces dernières sont donc isolées : on parle de « barrière hémato-testiculaire ».
Dans ce compartiment isolé, ce sont les cellules de Sertoli qui vont assurer les échanges.
Cette barrière hémato-testiculaire a un rôle protecteur et un rôle de « défense immunitaire ». Toutefois, cette dernière fonction est actuellement contestée.
Les cellules de Sertoli ont donc :
- Un rôle de soutien.
- Une polarité dans le développement (rôle organisateur).
- Un rôle nutritionnel : elles sécrètent un fluide contenant des vitamines, du lactate, de la transferrine.
- Un rôle endocrine.
Elles assurent cette dernière fonction par la sécrétion d’inhibine (glycoprotéine formée de deux chaînes [ et
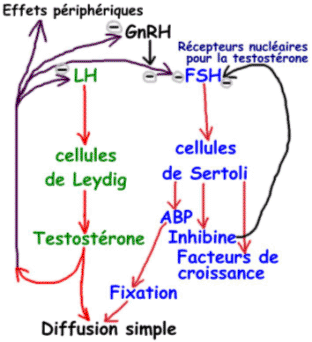
et  ]). Cette hormone a pour cible l’adénohypophyse où elle va inhiber la sécrétion de FSH. La FSH, elle, va stimuler la production d’inhibine : c’est une boucle de rétrocontrôle.
]). Cette hormone a pour cible l’adénohypophyse où elle va inhiber la sécrétion de FSH. La FSH, elle, va stimuler la production d’inhibine : c’est une boucle de rétrocontrôle.
Leur rôle endocrine est complété par la synthèse de nombreux facteurs de croissance (une quarantaine de facteurs différents) comme : TGF , Interleukines qui exercent un contrôle sur la multiplication et la différenciation des cellules germinales.
, Interleukines qui exercent un contrôle sur la multiplication et la différenciation des cellules germinales.
Les cellules de Sertoli vont aussi assurer la synthèse de l’AMH (Hormone Anti-Müllérienne). Cette hormone va agir contre les canaux de Müller. Elle continue à être sécrétée chez l’enfant, diminue durant la puberté puis reste mesurable chez l’adulte.
Un autre produit de synthèse des cellules de Sertoli est l’ABP (Androgène Binding Protéine). Cette ABP a une forte affinité pour la testostérone mais, toutefois, ce n’est pas une protéine de transport : elle sert à fixer la testostérone dans les testicules. Elle est indispensable à la spermatogenèse.
III Les cellules de Leydig.
Voir schéma précédent.
Ces cellules de Leydig sont en contact à proximité des capillaires sanguins et lymphatiques. Elles fabriquent la testostérone qui peut diffuser vers les tubes séminifères (action paracrine). Quand la testostérone passe dans le sang, elle se lie à une protéine de transport et va pouvoir exercer ces effets.
Ici, le cholestérol va donner la prégnénolone, qui pourra être transformée en progestérone ou en androgènes (testostérone). Ces derniers pourront être transformés en œstrogènes (œstradiol 17 ).
).
On a donc une seule chaine de synthèse et seule l’expression des enzymes est régulée.
L’hormone androgène naturelle est la testostérone (l’androgène le plus puissant), mais on trouve aussi la DHEA et l’androstènedione. 95% de la testostérone circulante vient des testicules. Dans la prostate, l’enzyme 5 réductase transforme la testostérone en 5DHT.
réductase transforme la testostérone en 5DHT.
Dans le système nerveux central mâle, ce n’est pas la testostérone qui agit mais l’œstradiol. La testostérone est donc, au préalable, convertie en œstradiol.
Le rôle de la testostérone est de permet l’acquisition et le maintien des caractères sexuels primaires et secondaires.
Les caractères primaires sont le développement des organes génitaux et le démarrage de la spermatogenèse.
Les caractères secondaires sont la pilosité, l’épaississement des cordes vocales, des effets métaboliques (anabolismes musculaires, métabolisme des lipides et répartition des graisses).
On peut opposer la testostérone et l’œstradiol sur le métabolisme lipidique :
- La testostérone va augmenter le taux de cholestérol LDL (le « mauvais ») et diminuer le taux de cholestérol HDL (le « bon ») vers le foie pour l’élimination.
- L’œstradiol va diminuer le taux de cholestérol LDL et augmenter le taux de cholestérol HDL.
Au niveau de la répartition des graisses :
- Chez l’homme, il y a accumulation des graisses dans les parties hautes (abdomen)  c’est la forme androïde.
c’est la forme androïde.
- Chez la femme, il y a accumulation des graisses dans la partie basse (forme de pomme ou poire)  c’est la forme gynoïde.
c’est la forme gynoïde.
L’accumulation de type androïde entrainent des risques de maladies cardiovasculaires.
Les effets centraux de la testostérone :
Les androgènes sont responsables des comportements :
- de dominance,
- territoriaux,
- de « monte » (chez les femelles, on parle de phénomène de « lordose »)
Pendant le développement, il y a un flash de testostérone qui permet d’imprimer le système nerveux central : on parle de sexualisation de l’hypothalamus. En effet, celui-ci, chez le mâle, ne fonctionnera pas de manière cyclique, comme chez la femelle.
IV Régulation de l’activité du testicule.
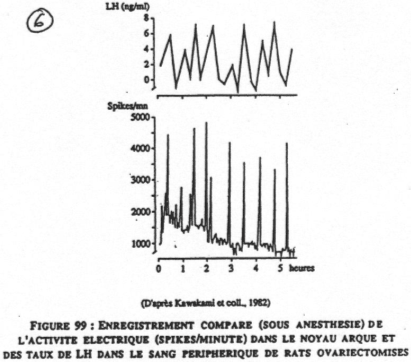
La sécrétion de LH n’est pas constante, mais, pulsatile (il y a des pics successifs toutes les 60 à 90 minutes).
L’activité électrique dans le noyau arqué montre qu’il y a une relation entre cette activité et LH. Si l’on détruit ce noyau, il y aura abolition de LH et de FSH. Les neurones à GnRH sont situés dans le noyau arqué. On peut toutefois trouver de la GnRH dans d’autres endroits.
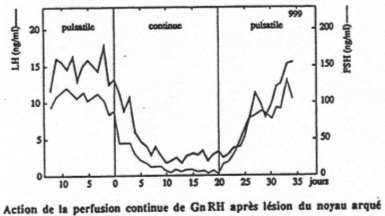
Selon le type d’injection de GnRH réalisée (pulsatile ou continue), on observe différentes réponses :
- Injection continue : il y a arrêt de stimulation de FSH et de LH : les récepteurs, au bout d’un moment se désensibilisent.
- Injection pulsatile : normale.
La LH a pour cible les cellules de Leydig. La FSH est moins sensible à GnRH que LH mais elle est très sensible aux rétrocontrôles des hormones périphériques. C’est l’inverse pour LH.
Physiologie endocrine chez la femelle.
I Anatomie – histologie.
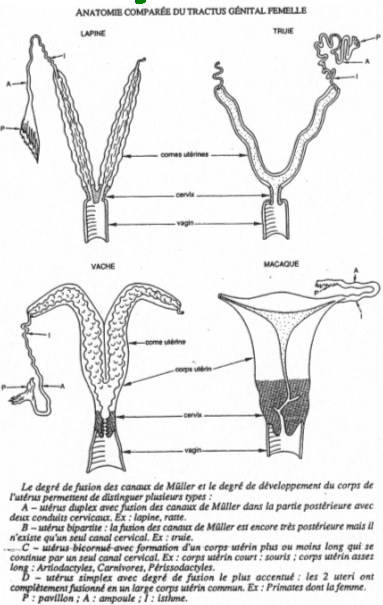
Les ovaires produisent les gamètes et jouent un rôle endocrine. Les voies de transit sont composées du pavillon, de l’oviducte et des trompes de Fallope. L’organe de gestation est l’utérus. L’organe de l’accouplement est le vagin (ou valve).
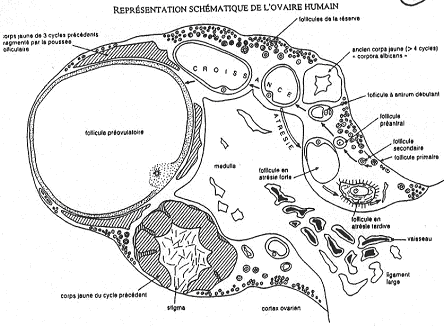
Dans les ovaires, on trouve des cellules germinales entourées de cellules somatiques appelées cellules folliculaires. Ces dernières pourront se différencier et devenir des tissus spécialisés producteurs d’hormones (la granulosa et la thèque). Tous ces follicules baignent dans un stroma conjonctif très vascularisé.
A la base de l’utérus, on trouve une couche musculaire, le myomètre, qui permettra l’expulsion du fœtus. Au-dessus de ce myomètre se situe une muqueuse, l’endomètre, formée d’une couche basale et d’une couche fonctionnelle qui évolue à chaque cycle.
Les cellules prolifèrent, la muqueuse s’épaissie, forme des replis et des invaginations ( glandes utérines) et la vascularisation s’accroît fortement.
glandes utérines) et la vascularisation s’accroît fortement.
Le stade le plus développé est appelé dentelle utérine. Elle n’apparaît que chez la femme et les primates de « l’ancien monde ». Les autres animaux ne la développent que s’il y a des chances de gestation.
II Ovogenèse.
Les ovogonies ne se divisent que chez l’embryon. Pendant la vie fœtale, les ovogonies se différencient en ovocytes I qui démaRrent la méiose mais se bloquent en prophase I de méiose. Au final, il y a un stock de 400 000 à 1 000 000 d’ovocytes I.
A partir de la puberté, si le follicule est sélectionné, l’ovocyte reste toujours bloqué : ce n’est qu’au moment de l’ovulation qu’il pourra finir sa première division méiotique.
Les cellules folliculaires sécrètent un facteur (OMI) qui bloque l’ovocyte dans sa méiose. L’OMI représente un ensemble de facteurs :
- Facteur de croissance : TGF .
.
- AMH.
- Activine.
- Follistatine.
Au moment de l’ovulation, l’ovocyte est expulsé ; il y a une expansion du cumulus ( rupture des jonctions). Les cellules folliculaires ne peuvent plus transmettre les facteurs à l’ovocyte. Ceci débloque l’ovocyte qui reprend sa méiose.
rupture des jonctions). Les cellules folliculaires ne peuvent plus transmettre les facteurs à l’ovocyte. Ceci débloque l’ovocyte qui reprend sa méiose.
Cette division est asymétrique : on obtient une grosse cellule (l’ovocyte II) et une petite, le premier globule polaire qui va dégénérer.
Aussitôt, l’ovocyte II entame sa seconde division méiotique mais est bloqué en métaphase. Il pourra achever sa méiose, uniquement s’il y a fécondation.
Au-delà de la méiose, il y a des processus de maturation cytoplasmique. Le cytoplasme va jouer un rôle important. Il y a des substances importantes qui régissent des commandes du processus de différenciation.
Le volume de ce cytoplasme est augmenté d’un facteur 300. L’ovocyte accumule des réserves et met en place des systèmes de régulation qui vont lui permettre de se développer  c’est l’acquisition de la compétence au développement.
c’est l’acquisition de la compétence au développement.
III Le cycle folliculaire.
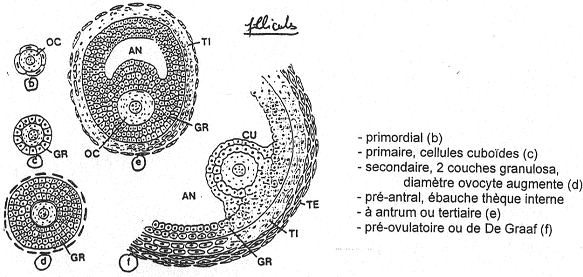
Autour de l’ovocyte, on a la zone pellucide (glycoprotéines fabriquées par l’ovocyte). On trouve aussi une couronne de cellules folliculaires qui vont rentrer en relation avec l’intérieur : c’est la coronna radiata.
Les cellules autour de la coronna radiata vont former le cumulus oophorus.
Tout cet ensemble baigne dans un liquide. Une cavité se forme : c’est l’antrum. Autour de la granulosa, on trouve des cellules sécrétrices d’hormones. A l’extérieur de ces cellules, on a une membrane basale puis la thèque interne (couche de cellules productrices d’hormones). L’enveloppe la plus externe est la thèque externe (périphérique).
IV La sécrétion des hormones folliculaires.
A La coopération granulosa-thèque.
La production des hormones est sous la dépendance de FSH et de LH. Les cellules de la thèque expriment des récepteurs à LH alors que les cellules de la granulosa expriment des récepteurs à FSH. Sous l’influence de FSH, ces dernières cellules vont exprimer des récepteurs à LH.
Dans les cellules de la thèque, on trouve des enzymes permettant de capter le cholestérol et de le transformer en progestérone et testostérone.
Les cellules de la granulosa produisent un peu de progestérone mais ne la transforme pas en testostérone. Elles doivent donc capter la testostérone de la thèque et la transformer en œstradiol.
Peu à peu, il va y avoir apparition de récepteurs à LH. Les cellules de la thèque et de la granulosa seront devenues des cellules lutéales avec des récepteurs à LH et sous l’influence de cette dernière hormone, elles vont fabriquer essentiellement de la progestérone.
B Le contrôle des sécrétions hormonales.
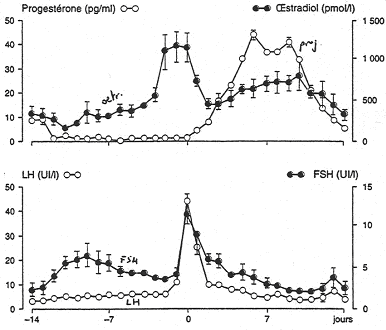
Le premier jour du cycle est le premier jour des règles.
Au début du cycle, les taux de progestérone et d’œstradiol sont faibles. Il y a donc un faible rétrocontrôle sur l’hypophyse et l’hypothalamus.
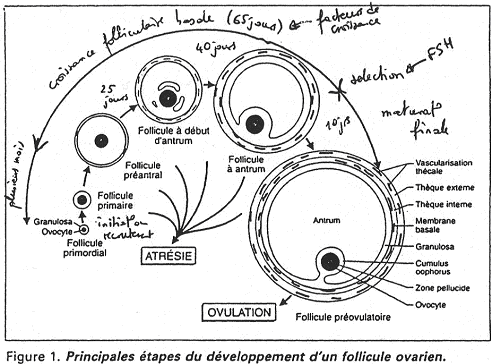
Il va y avoir une augmentation de la production de FSH qui permet la maturation finale du follicule. Cette augmentation du taux de FSH va provoquer l’augmentation de la concentration en œstradiol et donc, exercer un rétrocontrôle négatif sur FSH.
Malgré la chute de FSH due à l’œstradiol, les récepteurs à FSH sont de plus en plus nombreux sur la « membrane » du follicule. Les faibles taux de FSH vont donc être suffisant pour la croissance du follicule. Ce dernier va passer de 7 millimètres de diamètre à 19 millimètres. Les cellules de la granulosa passent d’une population de 4 millions à 75 millions.
L’aromatase (qui permet la transformation de testostérone en œstradiol) va provoquer « l’hypertrophie d’une glande endocrine ».
Quand l’œstradiol arrive à une valeur seuil de 200?g/L et est maintenu pendant au moins 35 heures, le phénomène de rétroaction s’inverse.
 ? Il y a un rétrocontrôle positif, selon l’espèce, sur GnRH ou sur l’hypophyse. Cette inversion provoque aussi les pics de FSH et de LH, la rupture de la barrière folliculaire, l’ovulation et la transformation des cellules de la granulosa et de la thèque en cellules lutéales.
? Il y a un rétrocontrôle positif, selon l’espèce, sur GnRH ou sur l’hypophyse. Cette inversion provoque aussi les pics de FSH et de LH, la rupture de la barrière folliculaire, l’ovulation et la transformation des cellules de la granulosa et de la thèque en cellules lutéales.
Les cellules lutéales présentent de nombreux récepteurs à LH et synthétisent beaucoup de progestérone.
Chez la femme, la production d’œstradiol a lieu durant la phase lutéale.
Les taux de progestérone et d’œstradiol vont chuter à cause du phénomène de lutéolyse. Le corps jaune pourra survivre une dizaine de jours, ce qui est le temps nécessaire à la nidation si la fécondation a eu lieu.
Chez les primates, ce sont les ovaires qui produisent les signaux lutéolytiques. Chez les autres espèces, c’est l’utérus qui se charge de cette fonction.
La lutéolyse demande l’intervention d’une prostaglandine : PGF2 .
.
Au niveau des ovaires (femme et primates) ou de l’utérus (chez les autres), il y a production d’ocytocine qui va fortement stimuler la production de PGF2 .
.
Cette prostaglandine va empêcher l’action de la LH. La production de PGF2? va augmenter, donc, faire chuter celle de LH et finalement, provoquer la régression du corps jaune. On revient à faible taux d’hormones.
 La muqueuse utérine ne va pas être maintenue : il y a dégradation et diminution de l’irrigation de celle-ci.
La muqueuse utérine ne va pas être maintenue : il y a dégradation et diminution de l’irrigation de celle-ci.
Comme l’œstradiol et la progestérone sont en faible concentration, c’est la fin du rétrocontrôle négatif sur FSH et donc, le redémarrage d’un nouveau cycle.
V Différence entre le cycle œstrien et le cycle menstruel.
Quelle que soit l’espèce et le fonctionnement du cycle, l’ovaire a toujours une activité cyclique.
Chez la femme et les primates de l’ancien monde (gorille, chimpanzé, orang-outan), à menstruations régulières, on parle de cycle menstruel.
Chez les autres espèces, le cycle est caractérisé par les chaleurs (ou œstrus). Chez la chienne, les pertes sanguines sont dues à un trop fort afflux de sang et pas à une dégradation de la muqueuse !
Pour les espèces à cycle œstrien.
Le cycle débute à l’œstrus, quelques dizaines d’heures après l’ovulation : ce sont les chaleurs.
La phase folliculaire est courte alors que la phase lutéale est longue : le pro-œstrus est le début de la phase folliculaire : l’œstrus est la période autour de l’ovulation : le post-œstrus correspond à la période de fonctionnement du corps jaune ; le di-œstrus est la phase lutéolyse.
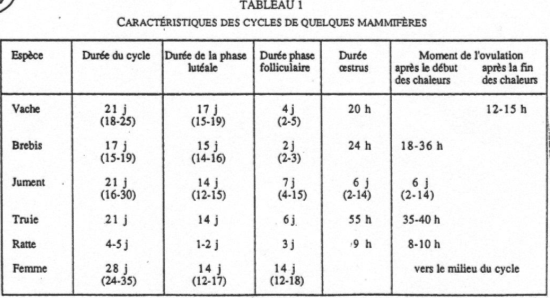
VI Le déclenchement de l’ovulation.
On trouve trois types de comportements.
• Comportement dépensier.
On trouve ce comportement chez la femme et chez quelques primates. De la puberté à la ménopause, même en l’absence de rapports sexuels, il y a ovulation et préparation d’une dentelle utérine complète.
• Comportement économe.
C’est le cas de la lapine, la chatte, la chamelle. Il n’y a pas forcément ovulation. L’ovulation ne sera provoquée que s’il y a rapport sexuel. Dans ce cas, les stimuli tactiles (dus à l’accouplement) vont, par voie réflexe, agir sur GnRH et provoquer l’ovulation. La phase lutéale est courte.
En cas de fécondation, il y a maintien du corps jaune et développement de la dentelle utérine.
• Comportement intermédiaire.
Dans ce cas, il y a toujours ovulation mais sans développement de la dentelle. S’il y a accouplement et fécondation, le corps jaune sera maintenu et la dentelle mise en place.
La fréquence des cycles varie en fonction des espèces. Chez les mammifères sauvages et domestiques, la période de reproduction est limitée : deux cycles par an pour la chienne et un cycle, en général, pour les espèces sauvages.
De la nidation à la parturition.
I La nidation ou ovoimplantation.
La fécondation a lieu au niveau des trompes. Une fois formé, l’œuf descend le long des trompes, se segmente, mais sans variation du volume total.
Pour que l’implantation se réalise, il y a besoin d’une synchronisation entre le développement de l’œuf et le développement de l’endomètre.
Quand l’endomètre est prêt, il y a développement maximal de la dentelle utérine et donc, réaction de décidualisation.
Chez les espèces à phase lutéale courte, c’est l’accolement du blastocyste qui déclenche la décidualisation.
Chez la truie, la jument et les ruminants, il n’y a pas de décidualisation : on a un placenta non invasif. C’est une placentation de type épithéliochoriale.
Au moment de l’implantation, si l’œuf n’est pas au stade blastocyste, il sera éliminé. Si cet œuf est au stade blastocyste mais s’implante avant son arrivée dans l’utérus, il y aura une grossesse extra-utérine puis éliminé.La gestation démarre au moment de l’implantation.
L’œuf s’accole et permet l’invasion du trophoblaste et donc la lyse des cellules de la muqueuse pour y pénétrer. Cet envahissement permet la nutrition de l’œuf. Il y aura aussi développement de villosités choriales et lyse de vaisseaux sanguins.La progestérone est indispensable pour le développement de l’œuf et la gestation.
Un signal contre la lutéolyse est émis par l’œuf qui signale ainsi sa présence.Chez la femme et les primates.
L’hormone du blastocyste est l’HCG. Cette hormone appartient à la famille de la FSH, la LH, la TSH : ce sont de grosses glycoprotéines formées de deux sous-unités ou ? est identique dans toute la famille et ? varie selon l’hormone (? spécifique).
HCG est uniquement synthétisée pendant le développement et durant les premières semaines de gestation (l’ARNm de HCG apparaît dès le stade 10 cellules). Cette hormone est une « super LH » qui se fixe sur les récepteurs à LH et stimule le corps jaune.
Les séquences codantes de LH et HCG ne diffèrent que d’un nucléotide : sur celle d’HCG, un codon stop n’est pas lu et il y a ajout d’un fragment portant de nombreux sites de glycosylation. Dans un test de grossesse, c’est HCG qui est dosé.
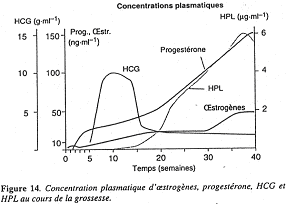
La concentration en HCG augmente vite en début de grossesse (pendant les sept premières semaines). Après, c’est le placenta qui prend le relais.
Chez les ruminants, il y a synthèse de la trophoblastine (équivalente l'interféron) qui va inhiber PGF2 .
.
Chez la ratte, c’est la prolactine qui va stimuler la synthèse de la progestérone. Au moment de l’accouplement, il y a sécrétion réflexe de prolactine pour stimuler celle de progestérone.
Le placenta va alors pouvoir se former et être capable de synthétiser une hormone proche de la prolactine qui va agir sur le corps et le rendre gestatif.
Chez certaines espèces, il y a arrêt de la reproduction après l’accouplement ou la fécondation. Chez la chauve-souris, l’accouplement à lieu en automne et l’ovulation ne se fait qu’au printemps ! Les spermatozoïdes vont survivre dans le tractus génital.
La stratégie de l’ovoimplantation différée.

Après l’accouplement, la fécondation et le début du développement de l’œuf, il y a arrêt au stade blastocyste pendant quelques jours à plusieurs mois : c’est la diapause embryonnaire.
Le blastocyste reste libre et son métabolisme est ralenti pendant que le corps jaune est momentanément inhibé ( diminution de la progestérone).
diminution de la progestérone).
Plus tard, il y a remontée du taux de progestérone qui permet l’implantation et la gestation.
Ce phénomène est gouverné par la photopériode. Le facteur progestérone n’est pas suffisant pour relancer le cycle.
II La placenta.
Chez des espèces comme la chèvre, la lapine, la ratte, le corps jaune est maintenu durant la gestation. Chez les autres, c’est le placenta qui prend le relais de synthèse des hormones stéroïdes.
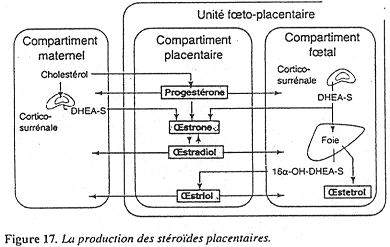
La progestérone est synthétisée à partir du cholestérol maternel dans le compartiment maternel. Le placenta va donner différents œstrogènes produits à partir des androgènes de la corticosurrénale de la mère mais aussi du fœtus. dans le compartiment maternel. Le placenta va donner différents œstrogènes produits à partir des androgènes de la corticosurrénale de la mère mais aussi du fœtus.
Le placenta synthétise aussi l’HPL (Hormone Placentaire Lactogène) qui participe en fait à la mammogenèse. L’HPL a aussi des effets métaboliques car elle stimule l’utilisation des acides gras libres par la mère : le glucose est ainsi conservé pour être utilisé par le fœtus.
De nombreux facteurs sont synthétisés par le placenta : ce sont des analogues aux facteurs hypothalamiques et hypophysaires. On trouve des facteurs de croissance, de nombres molécules de la famille des cytokines et la relaxine qui va permettre la distension du muscle utérin.
III La parturition.
La phase la lus longue de la parturition est « le travail » :
- Il y a apparition et amplification des contractions du myomètre.
- Il y a maturation du col : des enzymes vont être sécrétées pour hydrolyser le collagène et modifier les glycoprotéines du col. ? Il va y avoir dilatation et effacement du col.
L’expulsion suit la phase de travail.
Vient ensuite la délivrance (expulsion du placenta et des annexes). Un caillot va se former au point d’insertion du placenta. L’utérus va ensuite se rétracter et la caduque sera éliminée en 2 ou 3 semaines.
IV Les hormones.
A Les hormones stéroïdes.
Pendant la gestation, il y a dominance de la progestérone qui a des effets très supérieurs à ceux des œstrogènes. La progestérone est la seule hormone qui peut maintenir le « calme utérin ». Cette hormone s’oppose aux contractions et surpasse toutes les hormones qui favorisent ces contractions.
L’œstradiol favorise la mise en place des systèmes contractiles.
A l’approche du terme, il y a une diminution très nette de la progestérone et une forte augmentation du taux d’œstradiol.
Les hormones contractantes :
On trouve l’OT (ou ocytocine) qui permet le déclenchement des contractions ou leur maintien. L’ocytocine ne peut agir qu’en fin de gestation car, pour agir, il faut que les cellules présentent des récepteurs spécifiques qui n’apparaissent qu’en fin de gestation grâce à l’œstradiol et à PGF2 .
.
L’ocytocine est produite pendant le travail (réflexe neuroendocrinien ou réflexe de Fergusson) par la stimulation de mécanorécepteurs qui prennent leur départ au niveau du col. La pression exercée par l’enfant sur le col utérin augmente et entraîne l’accroissement de la stimulation des mécanorécepteurs qui vont stimuler l’hypothalamus (noyaux para-ventriculaire et supra-optique) et favoriser la sécrétion d’ocytocine..
La fixation de l’ocytocine sur les muscles (récepteurs à sept domaines transmembranaires) va provoquer l’activation de la PLC (Phospho Lipase C) donc l’augmentation du Ca2+ intracellulaire et la diminution de l’efflux calcique.
 Il y a donc contraction.
Il y a donc contraction.
B Les prostaglandines.
Les prostaglandines sont produites par le myomètre, l’endomètre et le placenta. Parmi ces hormones, on trouve :
- PGE : permet la maturation du col utérin.
- PGF2 : c’est un agent contractant du muscle utérin. Il y a toujours des récepteurs à PGF2
: c’est un agent contractant du muscle utérin. Il y a toujours des récepteurs à PGF2 sur le myomètre (
sur le myomètre ( contractions douloureuses). Cette hormone a le même couplage que l’ocytocine. L’œstradiol et l’ocytocine stimulent la libération de PGF2
contractions douloureuses). Cette hormone a le même couplage que l’ocytocine. L’œstradiol et l’ocytocine stimulent la libération de PGF2 .
.
C Les corticostéroïdes.
Les corticostéroïdes sont impliqués dans le déclenchement de la parturition. En fait, c’est le cortisol fœtal qui déclenche le processus. L’hypothalamus stimulé va libéré de la CRH qui active l’hypophyse. Cette dernière sécrète alors l’ACTH qui va exciter les corticosurrénales qui répondent par une libération de cortisol.
Dans ce cas (chez l’enfant), le cortisol a un rétrocontrôle positif sur l’axe hypothalamo-hypophysaire, mais, uniquement à ce moment là.
Le placenta va synthétiser l’ACTH (donc augmenter la libération de cortisol). Ce dernier en arrivant sur le placenta va provoquer un changement d’expression de certaines enzymes : la progestérone va être transformée en œstradiol. L’accroissement du taux d’œstradiol favorise les contractions et la synthèse de PGF2 qui favorise aussi les contractions.
qui favorise aussi les contractions.
L’œstradiol et PGF2 vont augmenter les récepteurs à l’ocytocine.
vont augmenter les récepteurs à l’ocytocine.
 C’est le déclenchement de la parturition.
C’est le déclenchement de la parturition.
L’augmentation de la pression sur le col de l’enfant accroît la libération d’ocytocine qui permet l’expulsion de l’enfant.
On sait que l’augmentation du taux de cortisol est nécessaire au bébé pour la maturation du système pulmonaire (surfactant). L’augmentation du taux de CRH peut provenir de l’état de maturation de l’hypothalamus, ou bien, le fœtus ressent la fin de la gestation comme un stress et augmente sa sécrétion de CRH.
Les différents modes d’action des hormones.
Neurotransmetteurs et hormones n’agissent pas de la même façon : le mode d’action sur les cellules cibles sera différent.
On trouve en fait deux familles de molécules informatives à mode d’action différent :
- Les molécules hydrophiles :
Quand il y a contact avec la membrane plasmique de la cellule cible, ces molécules ne rentrent pas ; elles ont besoin d’un système de reconnaissance capable de générer des effets dans la cellule pour provoquer l’effet biologique souhaité.
- Les molécules lipophiles :
Ces molécules rentrent plus facilement dans la cellule cible et vont agir rapidement sur la cible intracellulaire (récepteurs).
I Les molécules hydrophiles.
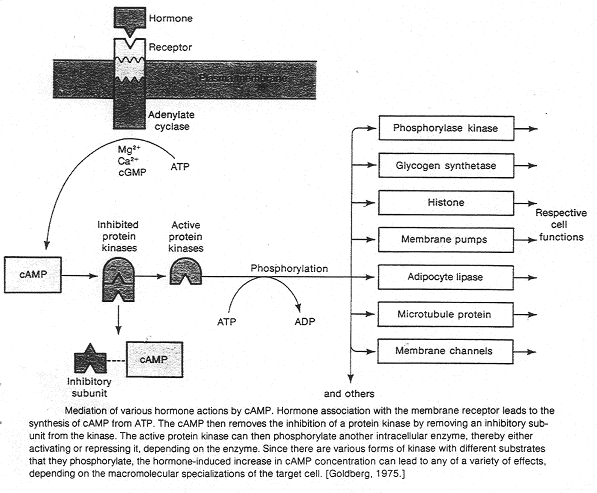
Dans ce cas, une glande va sécréter un premier messager qui va agir sur la cellule cible par l’intermédiaire d’un récepteur. Ce dernier n’est pas capable de générer un effet biologique dans la cellule. Le récepteur va récupérer le signal extérieur, sa liaison avec le messager primaire va activer une enzyme permettant la synthèse d’un second messager.
Un récepteur est spécifique à une molécule. La formation du couple messager/récepteur entraîne l’activation d’un système de transduction qui peut stimuler une enzyme, un canal ionique afin de provoquer une réponse intracellulaire.
Ici, c’est l’adénylyl-cyclase qui transforme l’ATP en AMPc.
A La spécificité.
La quantité d’hormones entrant en contact avec le récepteur est très faible. Le système doit être très spécifique, à haute affinité pour que l’interaction hormone/récepteur soit réalisable. Cette interaction a un effet biologique sur la cellule cible.
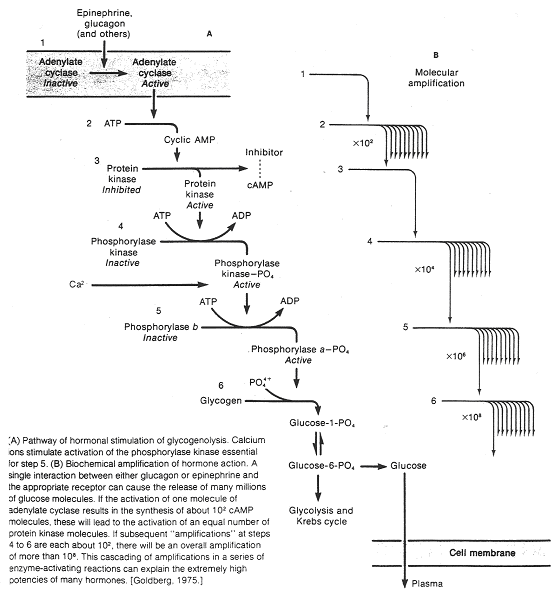
Le second messager peut être responsable d’un système d’amplification que l’on peut évaluer : une molécule d’adrénaline ou de glucagon va provoquer la synthèse de 100 molécules d’AMPc. Ces dernières (deux par enzyme) vont activer une enzyme (protéine-kinase A) qui elle, active la phosphorylase-kinase. Cette dernière provoque, sur la suite de la chaîne, une très forte amplification intracellulaire.
B Les RCPG (Récepteurs Couplés aux Protéines G).

Le récepteur est une protéine qui traverse sept fois la membrane. Cette protéine est structurée en hélice  transmembranaires.
transmembranaires.
Chaque segment (ou hélice) a un rôle propre.
Les protéines G sont sous la membrane, accrochées à celle-ci par un lipide, ajouté durant la modification post-traductionnelle. Les protéines G sont mobiles sous la membrane. Ces protéines sont composées de trois sous-unités,  ,
,  ,
,  , qui peuvent être dissociées.
, qui peuvent être dissociées.
La liaison au GDP a lieu au niveau d’ .
.
Lorsque l’hormone arrive sur le récepteur :
- Elle est reconnue grâce à des spécificités dues aux parties externes.
- Il y a interaction car les sept domaines sont en cercle. Cet agencement crée au milieu, une micro-région très hydrophile (c’est la poche de liaison) où vient le ligand. Les petits messagers moléculaires vont se fixer dans la membrane. Les gros (peptides) provoqueront une interaction au niveau de l’interface externe.
Ces récepteurs hydrophiles sont des protéines qui reconnaissent de nombreuses molécules :
- Les gros peptides : FSH, LH.
- Les petits peptides : petites hormones…
- Les catécholamines : adrénaline…
Ces récepteurs sont aussi capables de transmettre les informations portées par les lipides, les phospholipides. Ils jouent aussi un rôle dans la réceptions des odeurs et permettent la perception de la lumière (la lumière active un récepteur couplé à une protéine G).
La régulation de la concentration en Ca2+ par la parathormone (libération de Ca2+) et la calcitonine (stockage de Ca2+) est aussi sous l’action de récepteurs couplés à des protéines G.
C Fonctionnement de l’ensemble « hormone-récepteur-protéineG-effecteur ».
La fixation de l’hormone sur son récepteur provoque un changement conformationnel qui permet à la troisième boucle cytoplasmique et à la région interne (du récepteur) d’interagir avec la protéine G. La nouvelle forme obtenue à une grande affinité pour cette protéine G.
La liaison récepteur/protéine G entraîne le remplacement du GDP par du GTP car il y a un changement d’affinité.
Ce remplacement provoque la séparation du trimère en sous-unité  libre et un ensemble des deux sous-unités restantes (
libre et un ensemble des deux sous-unités restantes ( et
et  ).
).  va présenter une conformation affine pour l’effecteur (
va présenter une conformation affine pour l’effecteur ( est toujours associée au récepteur).
est toujours associée au récepteur).
Cet effecteur va être activé par  car celle-ci est une GTPase (qui hydrolyse le GTP en GDP). L’adénylyl-cyclase (l’effecteur) va alors transformer l’ATP en AMPc.
car celle-ci est une GTPase (qui hydrolyse le GTP en GDP). L’adénylyl-cyclase (l’effecteur) va alors transformer l’ATP en AMPc.
Comme l’affinité de  -GDP pour l’effecteur est quasi nulle, l’ensemble
-GDP pour l’effecteur est quasi nulle, l’ensemble  -
- va revenir.
va revenir.
 C’est le retour à l’état initial.
C’est le retour à l’état initial.
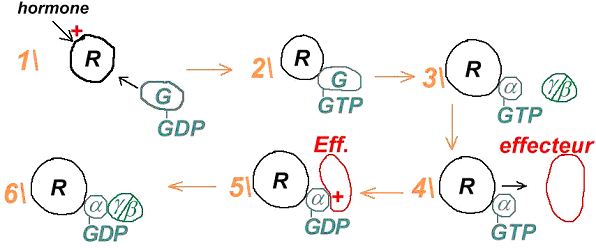
Les unités  et
et  sont responsables de toutes les interactions : des régulations de la réaction avec l’adénylyl-cyclase. Elles vont activer ou inhiber cette cyclase en fonction de la sous-unité de cette enzyme qui va être touchée.
sont responsables de toutes les interactions : des régulations de la réaction avec l’adénylyl-cyclase. Elles vont activer ou inhiber cette cyclase en fonction de la sous-unité de cette enzyme qui va être touchée.
Les récepteurs sont différents au niveau de leur composition et au niveau de la transduction. C’est la protéine G qui va faire varier l’effecteur utilisé.
Il existe un classement des protéines G en fonction des toxines les inhibant :
- Toxine cholérique  reconnaît la famille des protéines G1 qui active l’adénylyl-cyclase.
reconnaît la famille des protéines G1 qui active l’adénylyl-cyclase.
- Toxine pertussique (coqueluche)  reconnaît la famille des protéines Gi qui inhibe l’adénylyl-cyclase. La toxine pertussique inhibe Gi, donc permet l’activation de la cyclase.
reconnaît la famille des protéines Gi qui inhibe l’adénylyl-cyclase. La toxine pertussique inhibe Gi, donc permet l’activation de la cyclase.
- La famille des protéines Gq est sensible aux deux toxines et elle permet l’activation de la PLC (PhosphoLipase Kinase)..
D La PhosphoLipase C.
Cette va agir spécifiquement sur les phospholipides :
- Les PLC PLA1 vont cliver en 1.
- Les PLC PLA2 clivent en 2 (souvent l’acide arachidonique).
- Les PLC PLc clivent en 3 (avant le phosphate).
- Les PLC PLd clivent en 4, après le phosphate.
Les PLC agit sur les phospholipides membranaires et plus particulièrement sur le PiP2 (Phosphatidyl Inositol biPhosphate). Cette enzyme va cliver le PiP2 en diacyl-glycérol (DAG) et Inositol TriPhosphate (IP3). Ce dernier va migrer ensuite vers le cytoplasme.
Cet IP3 va agir sur les mitochondries et sur le réticulum endoplasmique qui servent de stockage au calcium.
Sur le réticulum, l’IP3 se fixe sur un récepteur spécifique (récepteur canal) et l’ouvre. Le calcium va se déplacer en fonction de son gradient : donc, sort.
 L’IP3 a pour rôle d’entraîner un flash de libération de calcium dans la cellule.
L’IP3 a pour rôle d’entraîner un flash de libération de calcium dans la cellule.
Le DAG sert aussi de second messager car, quand il est seul, il peut activer une protéine kinase C qui va phosphoryler le plus souvent des protéines pour les rendre actives.
Le PiP2 est facilement épuisable car il est en faible quantité dans la cellule.
 Ces deux phénomènes (action de l’IP3 et du DAG) sont le plus souvent complémentaires.
Ces deux phénomènes (action de l’IP3 et du DAG) sont le plus souvent complémentaires.
Remarque : il existe d’autres lipides qui ont des rôles importants. Celui-ci est un cas d’école !
E L’insuline et la GH (hormones hydrophiles spéciales).
L’insuline et la GH interagissent avec des protéines réceptrices plus simples, composées d’une hélice ? pour la GH et d’une double hélice ? pour l’insuline.
1 Cas de la GH.
La GH arrive et se fixer, mais, pour fonctionner, il faut que le récepteur soit sous forme de dimère. Cette obligation est réglée, au niveau de la région cytoplasmique, on observe une grande affinité pour la kinase JAK qui se positionne entre les deux parties du dimère et s’a ctive. Elle va ensuite tout phosphoryler.
Ce fonctionnement est retrouvé chez les interleukines.
2 Cas de l’insuline.
Ce récepteur à l’insuline a la particularité d’être, dans sa région intracellulaire, une enzyme qui peut phosphoryler la tyrosine (c’est une tyrosine kinase).
L’arrivée de l’insuline provoque l’activation de la tyrosine kinase qui phosphoryler les tyrosines contenues dans les protéines.Le fonctionnement de ce récepteur est un cas unique.
II Les hormones lipophiles (stéroïdes sexuels et surrénaliens).
Toutes ces hormones lipophiles sont des dérivés du cholestérol.
Les glucocorticoïdes (GC).
Les glucocorticoïdes ont pour cible le noyau où ils effectuent une régulation génique. Comme le cytoplasme est hydrophile, ces GC ont besoin d’une protéine réceptrice pour le transport dans le cytoplasme et de protéines chaperons (HSP) au repos.
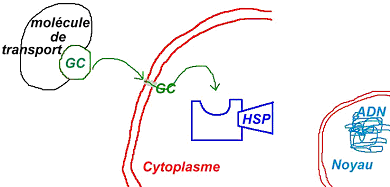
Le GC va se libérer des protéines chaperons et venir se fixer sur le récepteur. Là, il passe dans le noyau et va interagir avec l’ADN.
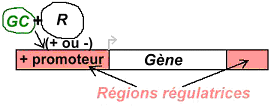
L’ensemble qui se fixe sur la région régulatrice contenant le promoteur est le SRE (Steroid Responsiv Element). La fixation a pour conséquence un contrôle de l’expression du gène, que ce soit une activation ou une inhibition.
Les glucocorticoïdes vont agir comme des facteurs de transcription.
L’axe hypothalamo-hypophysaire.
I Généralités.
Le fonctionnement de cet axe hypothalamo-hypophysaire se déroule en trois temps :
• L’acquisition d’informations.
C’est le versant afférant ou sensoriel informé par des récepteurs extérieurs et intérieurs. La température, la pression osmotique, la concentration en glucose, la position de corps dans l’espace sont des informations transmises à ce versant afférant.
• L’analyse des informations.
Le thalamus est un grand centre intégrateur mais, pour de trop importantes informations, il les transmet au cortex qui réalisera une analyse fine.
• La réponse.
C’est le versant efférent du système. On peut distinguer trois types de réponses :
- Motrice : gestes, locomotion, comportement, expression.
- Système nerveux végétatif : le système orthosympathique et le système parasympathique vont transmettre des informations vers les organes.
- Sécrétion hormonale : voie endocrine.
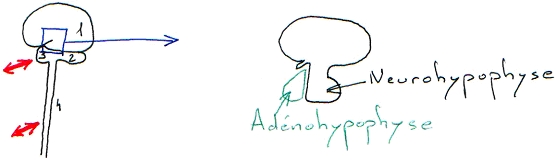
II Les liaisons du système hypothalamo-hypophysaire.
Les connexions du système hypothalamo-hypophysaire en voies afférentes se font par le thalamus, la formation réticulée, le système limbique et le système humoral (par voie sanguine : taux de glucose, de lactate, de CO2, d’O2 et la pression osmotique). Il renvoie aussi des informations vers le thalamus et le système limbique.
Le thalamus reçoit de nombreuses informations et contrôle de nombreuses fonctions de renvoi d’informations.
Le thalamus reçoit des afférences sensorielles et réagit lors de modifications brutales par :
- une levée d’inhibition du système nerveux moteur, en permettant alors des réactions plus rapides ;
- facilitation des relations neurovégétatives.
Le système limbique (amygdale, hippocampe, lobe olfactif, septum, formix…) est le support des comportements : alimentaire (quête de nourriture), sexuel reproducteur, social agressif (place dans son groupe).
On trouve entre 100 milliards et 1000 milliards de neurones dans l’axe hypothalamo-hypophysaire ainsi que des vaisseaux sanguins dans les nerfs.
En 1956, Scherrer a mis en évidence de l’ADH des axones. L’ADH est transportée sur des fibres d’actine par des clatrines-like et de l’ATP.
Les hormone hypothalamiques sont transportées puis stockées dans la post-hypophyse où elles seront transformées en ADH et ocytocine.
III L’antéhypophyse.
L’antéhypophyse comprend trois types cellulaires qui donneront sept hormones principales :
- GH (=STH) : c’est l’hormone de croissance. Elle stimule la formation d’IGF1 et 2 et agit sur la croissance du squelette.
- L’ACTH (Adrenal Cortex Trophic Hormon) va favoriser la synthèse de cortisol.
- La TSH (Thyroid stimulating Hormon).
- La FSH stimule le follicule et la spermatogenèse.
- La LH (Luteinisante Hormon) va favoriser la ponte ovulaire.
- La prolactine. Chez le mâle, cette hormone à un rôle additionnel à la GH.
- La MSH stimule les mélanocytes. Chez les vertébrés inférieurs, elle permet un changement de couleur. Chez les vertébrés supérieurs, les mélanocytes, quand ils sont stimulés par les UV et la MSH vont synthétiser la mélanine.
 Ces sept hormones ne sont pas des hormones hypothalamiques mais hypophysaires !
Ces sept hormones ne sont pas des hormones hypothalamiques mais hypophysaires !
La communication entre le tuber (de l’hypothalamus) et l’antéhypophyse est réalisée par le système sanguin. L’excitation de l’antéhypophyse est réalisée par la stimulation d’un récepteur spécifique sauf pour la prolactine qui est régulée par le PIF (facteur d’inhibition) et le PRF (difficilement identifiable).
Par la suite, on a trouvé des IF qui agissent sur toutes ces hormones.
L’équilibre hydrominéral.
Le passage de la vie aquatique à la vie terrestre a demandé une adaptation plus important mais aussi, un problème vis-à-vis de l’eau : éviter les pertes.
I Le passage de la vie aquatique à la vie terrestre.
A Problème métabolique.
Les besoins en protéines alimentaires des animaux aquatiques sont bien supérieurs à ceux d’animaux comme le rat, le porc, le poulet…
Pour l’homme, une croissance optimale demande un apport de 15 à 18% de protéines alimentaires.
Chez les animaux aquatiques (ammoniotéliques : production d’ammoniac comme déchet de dégradation des acides aminés), le besoin en protéines alimentaires est de 55 à 60% pour obtenir une croissance optimale.
Les acides aminés vont fournir de l’énergie (ATP), des glucides, des réserves et du NH3 qui est toxique lorsqu’il s’accumule.
Grâce à l’eau, l’élimination de ce déchet métabolique est aisée.
Les animaux uréotéliques (production d’urée à la place de l’ammoniac) ont besoin de quatre enzymes supplémentaires spécifiques. ? C’est le cycle de Krebs-Henselheit (différent du cycle de Krebs) :
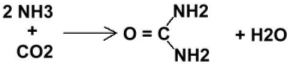
Toutefois, on trouve les gènes codant pour ces quatre enzymes (permettant la transformation de l’ammoniac en urée) chez certains téléostéens.
B Problème de l’eau : maintien de la pression osmotique.
La pression osmotique interne moyenne est de l’ordre de 330 milliOsmol. Pour un bon fonctionnement, il faut que cette pression osmotique soit à peu près équivalente de part et d’autre de la membrane plasmique.
Les transporteurs et canaux servent à réguler les flux. Si la pression osmotique varie, il y a modification des ces transporteurs et canaux qui provoque un dérèglement.
Pour maintenir l’hydratation, il existe trois mécanismes de base :
1 Le néphron.
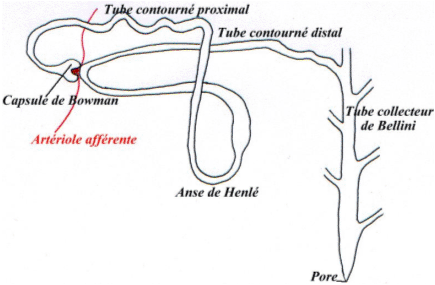
Le tube contourné proximal présente une réabsorption importante, surtout de glucose.
La diminution de sécrétion d’ADH va entraîner la sortie (dans l’urine) de beaucoup d’eau alors que la sortie de sodium va être fortement diminuée.
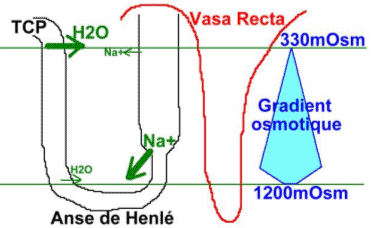
Le rein est sensible à l’anoxie et aux toxiques.
a Régulation au niveau du tube collecteur de Bellini.
Selon le cas, ce tube va être perméable ou non.
L’ADH rend le tube collecteur de Bellini poreux : l’eau sort du tube, l’urine est plus concentrée.
b Vasa Recta.
Les « Vasa Recta » ont deux rôles :
- Elles récupèrent l’eau sortie du tube collecteur de Bellini.
- Elles modulent la valeur du gradient. En mélangeant les liquides de part et d’autre de la anse de Henlé (haut et bas), elles vont faire diminuer le gradient, donc, diminuer la consommation d’ATP.
Chez l’Homme, en conditions normales, le gradient est compris entre 300 et 600mOsm.
Dans la réalité, il y a une zone de contact entre l’artériole afférente et le tube contourné distal.
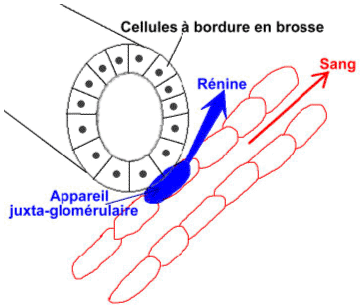
Les cellules de l’appareil juxta-glomérulaire viennent de myocytes (artériole afférente) et des cellules en brosse (tube contourné distal).
Une diminution de la pression osmotique et/ou de la pression artérielle et/ou de la volémie vont activer l’appareil juxta-glomérulaire qui augmenter sa production de rénine.
B L’hypothalamus.
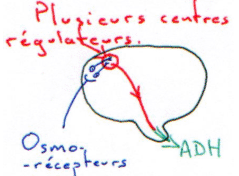
Les centres régulateurs reliés aux osmorécepteurs sont : le centre de la prise alimentaire, le centre dipsique et le centre de la thermorégulation. Ces trois centres sont connectés au système limbique, au lobe olfactif et au noyau amygdalien.
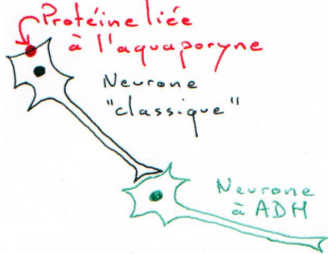
La protéine liée à l’aquaporyne permet la détection du sens du passage de l’eau. Si l’eau sort, il y a allumage de neurones qui vont stimuler les neurones à ADH.
L’atrium qui est composé des oreillettes comporte des volo et barorécepteurs. Une distension des oreillettes (due à une augmentation de la pression artérielle et/ou une augmentation de la volémie) va inhiber la synthèse d’ADH.
L’eau bue, quand elle atteint l’estomac, exerce un réflexe négatif sur l’hypothalamus qui va inhiber la synthèse d’ADH.
C Le cortex surrénalien.
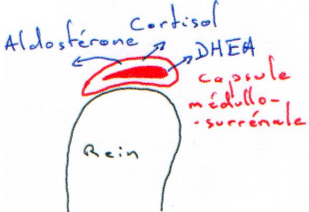
L’aldostérone agit sur le tube contourné distal pour favoriser la réabsorption de sodium et à plus faible dose, celle de magnésium. Au contraire, elle favorise l’excrétion de potassium.
Cette hormone est produite par la zone glomérulée de ce cortex. Sa synthèse est augmentée par l’angiotensine. Cette dernière provient de la conversion d’un peptide hépatique inactif, l’angiotensinogène.
La conversion de l’angiotensinogène en angiotensine est réalisée par la rénine (venant de l’appareil juxta-glomérulaire). Une diminution de la pression osmotique et/ou de la pression artérielle va augmenter la synthèse de rénine, donc, accroître la quantité d’angiotensine. Cette plus forte concentration en angiotensine va favoriser la production d’aldostérone.
Au niveau des oreillettes, on trouve des tensorécepteurs qui déclenchent la sécrétion d’un principe hormonal : l’ANF (Atrial Natriurétic Factor). Cet ANF va passer dans le sang et inhiber la production de rénine et d’aldostérone : il fait chuter la concentration en sodium.
 Si la pression osmotique diminue, il y a une augmentation de rénine qui provoque une augmentation d’aldostérone qui va accroître la concentration sodique.
Si la pression osmotique diminue, il y a une augmentation de rénine qui provoque une augmentation d’aldostérone qui va accroître la concentration sodique.
 Si le volume sanguin augmente, l’ANF produit augmente et va inhiber la synthèse de la rénine et celle de l’aldostérone. Ce qui provoque la diminution de la concentration en sodium.
Si le volume sanguin augmente, l’ANF produit augmente et va inhiber la synthèse de la rénine et celle de l’aldostérone. Ce qui provoque la diminution de la concentration en sodium.
Remarque : Le NO a une action sur les muscles lisses : il provoque leur relâchement.