Sommaire du cours de
Neurophysiologie.
Le neurone.
I Généralités.
C’est un système de communication qui permet de mettre l’organisme en relation avec le monde extérieur.
Les entrées d’informations se font au niveau de récepteurs sensoriels. Ils ont la capacité de transformer les informations des diverses sources d’énergie en signaux électriques, par un phénomène de transduction.
Ces signaux vont gagner les centres nerveux (encéphale, moelle épinière) par les voies afférentes (centripètes) où ils seront traités et codés.
Le résultat des traitements est envoyé vers la périphérie sous forme d’ordres moteurs (au sens large) par les voies efférentes. Les organes effecteurs sont : les muscles et glandes endocrines. Le comportement est modifié et/ ou agit en retour sur son environnement.
Le système nerveux peut être considéré comme un système de traitement de l’information. Il est capable, grâce à ses constituants (en grande partie les neurones), de créer un signal électrique porteur d’informations et de la transmettre.
II Le neurone.
Les neurones ne sont pas les seules cellules nerveuses. Les cellules gliales, qui s’intercalent entre les neurones, ont un rôle actif dans la régulation des mouvements ioniques.
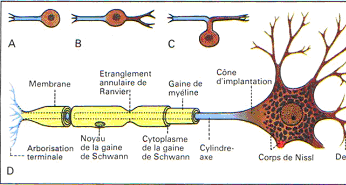
Le neurone est une cellule particulière qui se caractérise par ses prolongements. Certains prolongements sont de forme et de taille variable et constituent les dendrites. Ces dendrites constituent le pôle récepteur de la cellule (en principe).
Un prolongement plus important dont le diamètre est relativement constant émerge du soma et constitue l’axone. C’est le pôle émetteur.
L’axone se ramifie pour former l’arborisation terminale. Chaque terminaison se finie par un bouton synaptique.
L’axone peut présenter des collatérales : ce sont des branches qui se détachent perpendiculairement de l’axone. Ce phénomène permet d’avoir une arborisation très dense.
L’axone peut être très long (plus d’un mètre). Il est entouré d’une gaine de myéline (surtout quand l’axone est long).
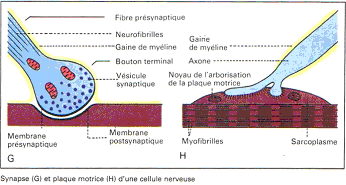
Les neurones sont connectés entre eux (communication) par l’intermédiaire de synapses. Cette synapse est constituée par la terminaison d’un axone sur le soma d’un autre neurone ou sur une dendrite. Il existe aussi des synapses axo-axoniques.
On a différentes classes de neurones :
- Les motoneurones : leur axone est long avec une arborisation dense autour du soma.
- Les neurones pseudo-unipolaires : leur corps cellulaire est rejeté sur le côté avec un prolongement unique.
- Les neurones d’invertébrés : ils ont un soma sans ramification et leur axone présente de nombreuses zones de ramifications. Les zones d’acquisitions et d’émissions sont difficiles à trouver.
- Les cellules rétiniennes.
- Les cellules pyramidales (cortex)…
Le fonctionnement est conditionné par la forme du neurone. Au niveau de la partie dendritique, on enregistre des potentiels locaux dont l’amplitude est modérée.
Tous les potentiels locaux se somment (sont intégrés) au niveau du soma : le résultat est l’émission ou non d’un potentiel d'action (ou spike) qui n’apparaît qu’au niveau du cône axonique qui est le point d’émergence de l’axone (zone de déclenchement).
Le potentiel d'action va être conduit le long de l’axone sans perte d’amplitude jusqu’à l’arborisation terminale qui est le lieu de la transmission de l’information vers une autre cellule.
Le neurone présente une régionalisation de ses fonctions qui est due aux propriétés de la membrane plasmique en ses différentes régions (en fonction de la présence de canaux membranaire [protéines] qui ont des propriétés particulières).
III Les propriétés du neurone.
Il y a trois principales propriétés : - la capacité d’émettre un potentiel électrique – la conduction : conduire le spike sans diminuer son amplitude – transmission de l’information vers une autre cellule.
Le neurone est capable d’émettre un potentiel électrique qui va correspondre à une variation du potentiel membranaire. Il peut être partiel (variation limitée d’un potentiel local), ou au contraire, maximal et donner un potentiel d'action : l’influx nerveux est le support de l’information.
Ces variations de potentiel sont dues à des mouvements ioniques au travers de la membrane plasmique.
A La membrane plasmique.
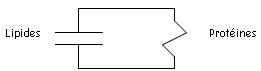
Elle constitue une barrière entre les milieux intra et extracellulaire par sa nature : double couche (bicouche) lipidique dans laquelle sont incluses des protéines : c’est une mosaïque fluide.
Les lipides membranaires sont constitués par des phospholipides, du cholestérol et des glycoprotéines qui présentent une partie hydrophobe et une hydrophile.
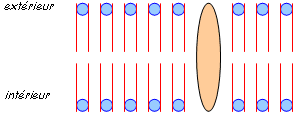
Les protéines membranaires sont réparties entre ces lipides. Les lipides forment une barrière contre la diffusion des ions et des différents constituants alors que les protéines assurent les fonctions dynamiques en formant des canaux ioniques autorisant la perméabilité membranaire et l’activité enzymatique.
Ce sont ces protéines qui sont à l’origine des propriétés électriques des cellules. Les protéines sont des « résistances » électriques. Les lipides ont une capacité de charge électrique : ils ont un rôle de condensateur.
La capacité de la membrane est évaluée à 1µF/cm².
1 Les protéines membranaires.
• Le transport passif des ions : selon le gradient électrochimique, on trouve des protéines qui traversent toute la bicouche (canaux axonique et récepteurs aux protéines G). D’autres sont périphériques : du coté cytoplasmique o, a les protéines G, ou, du côté de la fente synaptique (fente cellulaire), des protéines comme l’acétylcholine estérase.
• Les pompes : transport actif d’ions. Elles sont dans la membrane mais utilisent de l’énergie pour que les ions circulent contre le gradient électrochimique.
2 Le potentiel de repos du neurone.
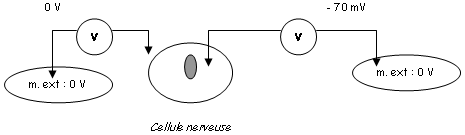
Toutes les cellules présentent une différence de potentiel qui est expliquée par une inégalité de répartition des ions par rapport à la membrane. Les ions K+ sont prédominants dans le milieu intérieur alors que du côté extérieur, on trouve en quantité Na+, Ca2+, Cl-.

La répartition de ces ions obéie à deux contraintes majeures :
- L’électroneutralité des 2 compartiments (de chaque côté, les milieux doivent être électriquement neutres). A l’extérieur, les charges + sont équilibrées par les ions Cl-. A l’intérieur, les charges + sont équilibrées par des anions qui sont de grosses protéines non diffusibles.
- L’équilibre osmotique : le nombre de particules à l’intérieur et à l’extérieur de la cellule doit être le même quelle que soit leur charge.
Chaque espèce ionique et soumise à un gradient de concentration. Un ion donné tend à passer du milieu le plus concentré vers le milieu le moins concentré. Ce passage d’un milieu vers un milieu pauvre s’accompagne d’un déséquilibre électrique qui est à l’origine de l’apparition d’un gradient électrique.
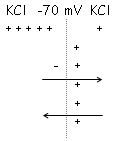
Le potentiel électrique de l’ion est défini par concentrations initiales de l’on dans les deux compartiments.
Le potentiel s’équilibre.
Les concentrations ioniques peuvent varier d’un neurone à l’autre. L’électroneutralité n’est pas respectée mais à un niveau microscopique.
La membrane se comporte comme un condensateur limité à la zone où ont lieu les échanges.
Le nombre d’ions transférés est très faible. On peut calculer que le transfert de deux ions K+ sur 100 000 est suffisant pour créer la différence de potentiel de –70mV à –80mV.
Les transferts sont donc très réduits. Les concentrations sont faiblement perturbées.
Le potentiel peut être calculé à partir de la loi de Nernst :
Eion = [(RT)/(ZF)] x Ln ([K+]ext/[K+]int).
Z est la valence et F, la charge en faraday.
Ei = 58 x log([K+]ext/[K+]int)
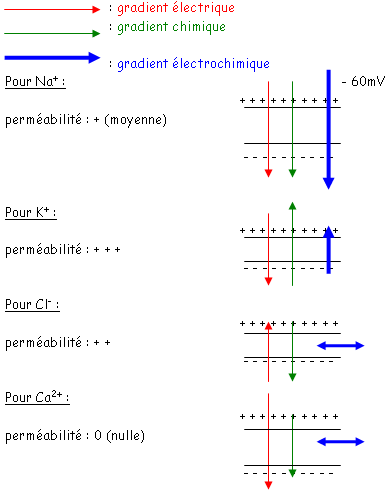
Pour chaque ion, le potentiel d’équilibre est : K+ : -84mV ; Na+ : +58mV ; Cl- :-58mV ; Ca2+ : +116mV.
La membrane présente une perméabilité sélective pour chaque ion et le potentiel de repos de la membrane va être défini par l’équation de Goldman.
Vm = (RT/F) x Ln[(Pk x [K]e + Pna x [Na]e + Pcl x [Cl]i)/(Pk x [K]i + Pna x [Na]i + Pcl x [Cl]e)]
Vm = -60mV (c’est une valeur relative)
Au repos, aucun des ions n’est à son potentiel d’équilibre : chaque ion est donc soumis à une force qui correspond à la différence entre le potentiel de repos et le potentiel d’équilibre de l’ion (Vm – Eion).
Chaque ion se comporte pour amener la membrane à son potentiel d’équilibre en la traversant.
Il en résulte par chacun, un courant ionique proportionnel à cette force qu’est le gradient électrochimique. Le facteur de proportionnalité est « g » : la conductance membranaire pour un ion donné. « g » est la facilité de la membrane à laisser passer l’ion.
I = g x (Vm – Eion)
« g » est différent de la perméabilité membranaire. Quand tous les canaux sont ouverts pour un ion, « g » est indéfini. G = 1/R. « g » se mesure en siemens et il est de l’ordre de 10 à 200 ?s (la conductance est toujours positive).
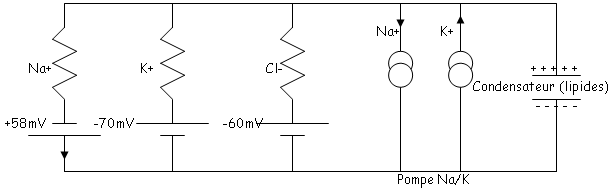
Au repos, cette membrane présente des canaux sélectifs pour chacun des ions.
Au repos, Na rentre et K sort. Ces mouvements sont dus au gradient électrochimique.
Les passages se font à travers des canaux ioniques spécifiques (passifs) qui sont toujours ouverts. Le flux d’ions Na au repos est légèrement supérieur au flux de K sortant.
Cependant, les concentrations ioniques de la cellule sont constantes et le potentiel de repos est très stable, ce qui implique que ces mouvements soient en permanence contrebalancés par un phénomène actif qui rejette les ions Na à l’extérieur et fait rentrer les ions K+ à l’intérieur. Ce phénomène actif lutte contre des forces physiques en consommant de l’énergie.
C’est la pompe Na/K. Elle assure ces mouvements ioniques à contre courant en utilisant une grande quantité d’ATP fabriqué par la cellule.
Cette pompe est, elle-même, électrogénique car 2 ions K+ sont récupérés contre 3 Na+ sortis. On a donc un courant positif sortant. C’est l’ensemble de ces phénomènes qui assurent l’équilibre du potentiel de repos (phénomènes actifs + passifs).
La somme des résistances transversales conditionne l’amplitude des variations membranaires. La capacité membranaire définit le décours (la forme) temporel des variations de potentiel.
3 Les propriétés électriques passives de la membrane.
Ces diverses propriétés conditionnent la forme et l’amplitude des potentiels locaux.
 La résistance membranaire au repos.
La résistance membranaire au repos.
Cette résistance est définie par la présence de protéines transmembranaires qui définissent la perméabilité de la membrane au repos de certains ions (donc des canaux passifs).
Pour réaliser l’expérience, on injecte dans un neurone, un courant hyper polarisant.
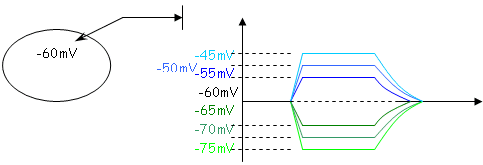
Si on injecte un courant dépolarisant, on obtient des courbes symétriques par rapport à la droite de –60mV.
Pour observer ces résultats, il faut rester sous un certain seuil pour ne pas dépasser le potentiel de seuil.
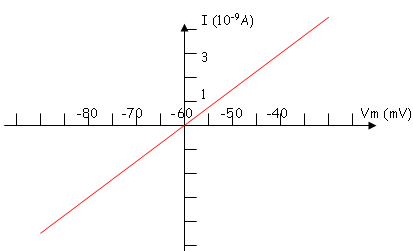
La variation est linéaire. I=f(V)=(1/R) x V
Le facteur de proportionnalité est la résistance membranaire lorsque le neurone est au repos. La résistance de la membrane est de 10M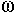 .
.
Plus la résistance augmente, plus la variation de potentiel induite par un courant sera importante.
Quand le diamètre du neurone diminue, la résistance augmente. Les cellules de petites tailles sont donc plus excitables.
 La capacité membranaire.
La capacité membranaire.
La capacité membranaire est due à la présence des lipides (sont isolants) dans la membrane. Ils vont conduire à l’accumulation de charges opposées de part et d’autre de la membrane.
Un courant membranaire va charger le condensateur, mais il a besoin de temps selon le condensateur : on a donc un temps de charge qui influe sur la taille et la forme du potentiel.
Le temps de charge augmente avec la surface et l’épaisseur du condensateur : quand le diamètre de la cellule augmente, le temps de charge augmente.
On obtient une constante de temps pour chaque cellule (T) : T=R x C. Cette valeur représente le temps au bout duquel la variation de potentiel membranaire a atteint 63% de sa valeur.
La constante de temps détermine les capacités d’intégration temporelle d’une cellule.
 L’influence des résistances transversales et longitudinales.
L’influence des résistances transversales et longitudinales.
Cette influence se montre sur la perte d’amplitude du potentiel et sur la vitesse de conduction.
La résistance transverse est définie par le nombre de canaux passifs présents dans la membrane.
La résistance longitudinale représente la résistance opposée par le milieu cytoplasmique au passage du courant.
 La résistance transmembranaire est constante sur une portion de membrane donnée alors que la résistance longitudinale, comme tout conducteur, augmente avec la longueur.
La résistance transmembranaire est constante sur une portion de membrane donnée alors que la résistance longitudinale, comme tout conducteur, augmente avec la longueur.
Rlong=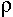 x (l/s) (s représente la section).
x (l/s) (s représente la section).
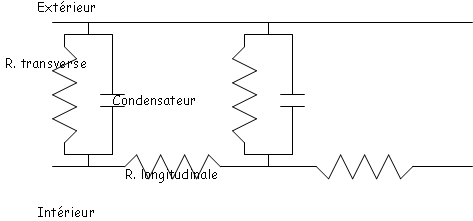
Remarque : Les résistances longitudinales sont en série.
On injecte un courant dépolarisant qui traverse la membrane en plusieurs endroits en empruntant les voies de plus faibles résistances. On observe alors une diminution de l’amplitude du courant quand on s’éloigne du point d’injection du courant.
 Il s’ensuit alors une baisse progressive du potentiel avec la distance.
Il s’ensuit alors une baisse progressive du potentiel avec la distance.
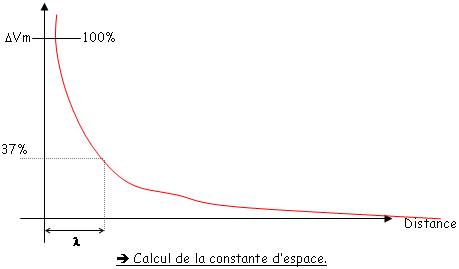
La constante d’espace est la distance à partir du point d’injection du courant pour laquelle le potentiel membranaire a perdu 63% de sa valeur (0,1<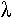 <1mm).
<1mm).
Ceci signifie, qu’un potentiel infra-liminaire, qui apparaît sur une dendrite, perd de l’amplitude le long de la fibre  La conduction est décrémentielle.
La conduction est décrémentielle.
 Vitesse de conduction.
Vitesse de conduction.
Comme la résistance longitudinale est inversement proportionnelle à la section de la fibre, plus la fibre est, plus la résistance est faible et donc, la vitesse de conduction s’en trouvera augmentée (c’est vrai pour les dendrites et les axones).
L’axone présente un facteur supplémentaire : la myélinisation de la fibre. Celle-ci entraîne une diminution de la capacité membranaire et donc, diminue le temps de charge et augmente la vitesse de conduction.
IV Le potentiel d’action.
A Origine/Le voltage clamp.
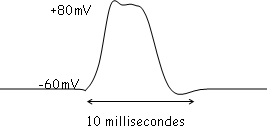
Dans certaines conditions, la membrane est le siège de variations d’amplitude maximales et constantes : c’est le potentiel d'action.
Les potentiels d’action s’observent quand la stimulation du neurone dépasse un certain seuil  stimulations supraliminaires.
stimulations supraliminaires.
Dans ces conditions, on a :
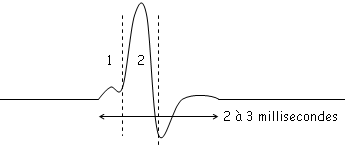
En 1, on observe les propriétés passives de la membrane du neurone.
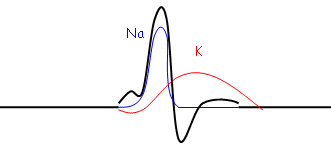
En 2, le potentiel de seuil est atteint ? le potentiel d'action va atteindre +45 à +50mV, ce qui correspond à peu près au potentiel d’équilibre du sodium.
 Le potentiel d'action est du à une augmentation transitoire de la perméabilité membranaire pour le sodium ([Na]ext>[Na]int). La perméabilité membranaire aux ions (surtout pour K+ et Na+) est modifiée pendant le potentiel d'action.
Le potentiel d'action est du à une augmentation transitoire de la perméabilité membranaire pour le sodium ([Na]ext>[Na]int). La perméabilité membranaire aux ions (surtout pour K+ et Na+) est modifiée pendant le potentiel d'action.
Les expériences de voltage clamp consistent à imposer un saut de potentiel à la membrane. Ce saut est à la base d’un courant qu’on neutralise en injectant dans la cellule un courant de sens opposé. On maintient la membrane au potentiel imposé ; on définit la nature du courant apparu.
Résultats : on enregistre le courant total qui traverse la membrane pour différents sauts de potentiel.
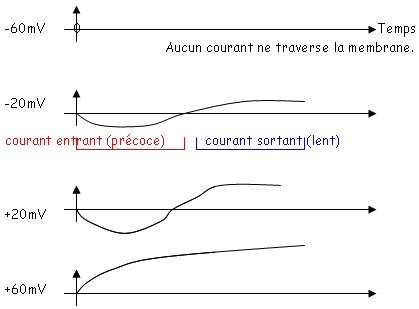
Le même ion ne peut pas à la fois sortir et entrer. A –20mV, Na à tendance à rentrer (à cause du gradient électrique). K+ va alors tendre à sortir.
Pour étudier le Na, on utilise du TEA (qui bloque les canaux K+).
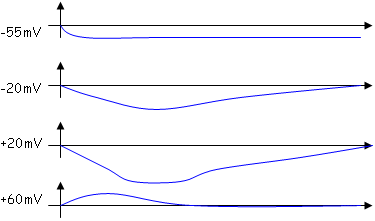
A +60mV, l’intérieur de la cellule est plus positif que le potentiel du Na : le courant s’inverse. C’est le potentiel d’inversion d’un courant qui donne une indication sur la nature de l’ion qui circule à travers la membrane.
Les canaux impliqués dans ce courant sont « voltage dépendant ».
Le courant sodium s’annule spontanément alors que la différence de potentiel reste constante.
Pour étudier les canaux K+, on utilise la TTX (tétrodotoxine) qui bloque les canaux Na+.
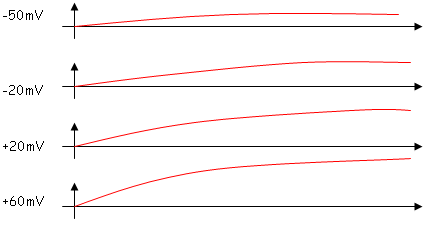
Les canaux ne s’ouvrent qu’avec la dépolarisant de la membrane (V dépendant). Plus la dépolarisation croit, plus le courant s’amplifie : donc, entrée de K+. Toutefois, on n’a pas de potentiel d’inversion (il ne peut pas entre mis en évidence). Le fonctionnent des canaux K+ tend à repolariser la membrane. On remarque aussi que le courant observé ne s’annule pas avec le temps pour une différence de potentiel donnée.
 ces canaux sont Na-Vdépendants.
ces canaux sont Na-Vdépendants.
Ce sont ces deux courants qui se développent simultanément pendant le potentiel d'action. Le courant Na assure la phase de dépolarisation membranaire alors que le courant K+ assure la phase de repolarisation membranaire.
Ces courants sont dus à l’augmentation transitoire de la conductance membranaire pour le sodium et le potassium.
g=i/(Em-Eion)
Le courant K est appelé courant de la rectification retardée.
B Conduction/Le patch clamp.
On impose un courant sur une portion (on étudie alors un seul canal).
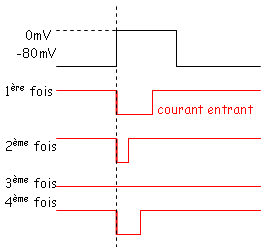
Ce canal ne s’ouvre pas toutes les fois, ou, l’ouverture est aléatoire. Quand le canal s’ouvre, l’intensité du courant est toujours la même. La durée est aléatoire.
Quand le canal s’ouvre, il s’ouvre sans latence. Quand il se referme, il ne se rouvre pas même si la stimulation persiste.
L’ouverture d’un canal dépend de l’intensité de la stimulation (la probabilité d’ouverture augmente avec l’accroissement de l’intensité).
Le canal Na présente une porte d’activation et une d’inactivation.
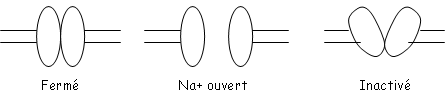
Fermé Na+ ouvert Inactivé
La somme de ces comportements individuels explique l’inactivation spontanée des canaux Na (et du courant Na+).
La rectification retardée.
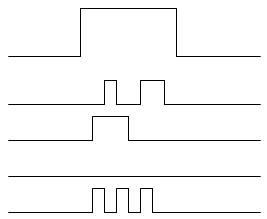
Le courant est d’amplitude constante, l’ouverture est aléatoire. Si la dépolarisation augmente, il y a plus de chances d’ouverture.
Un canal est capable de s’ouvrir, se fermer, se rouvrir pendant une même dépolarisation. L’ouverture est retardée.
Quand on stimule un neurone avant le potentiel de seuil, on a juste une dépolarisation légère. Si le potentiel de seuil est dépassé, on a un pas. Ce potentiel de seuil est le seuil d’excitation des canaux voltage dépendant (pour les amorcer).
Quand les canaux Na s’ouvrent, le sodium rentre et cela continue jusqu’à atteindre l’annulation spontanée et l’augmentation légèrement retardée de la conductance au potassium.
La conductance membranaire aux ions dépend de la différence de potentiel membranaire mais aussi du temps.
1 Le potentiel calcique.
Le potentiel d'action n’est pas le seul potentiel présent dans le neurone.
Il faut une forte excitation pour ouvrir les canaux calciques. Le potentiel d'action calcique est déclenché par la mise en jeu de canaux sodium. La repolarisation membranaire est due à des canaux K+ voltage dépendant de la rectification retardée mais aussi à des canaux calciques, activés par le calcium. Ces canaux sont caractéristiques des mouvements calciques.
Au cours du potentiel d'action, la concentration calcique intracellulaire augmente beaucoup. Le calcium est souvent à l’origine de déclenchement de voies métaboliques.
La conduction du potentiel d'action se fait donc sans perte d’amplitude et est unidirectionnelle.
Si on considère le potentiel d'action à sa naissance, la zone membranaire est dépolarisée alors que la zone adjacente est polarisée : il y a création de courants locaux (courants de fuite). L’intensité de ces courants s’atténue le long de la fibre mais comme les canaux (voltage-dépendants) sont proches, ils sont tout de même activés et, il y a recréation, de proche en proche, du potentiel d'action.
 On parle de conduction régénérative sur les axones (alors que sur les dendrites, la conduction est décrémentielle).
On parle de conduction régénérative sur les axones (alors que sur les dendrites, la conduction est décrémentielle).
Ici, plus l’axone est large, plus la conduction est rapide. Là, la myéline entoure la fibre. Sur les fibres myélinisées, la conduction est saltatoire et la vitesse de conduction s’en trouve augmentée.
Les espaces entre la myéline sont appelés « Nœud de Ranvier ». La myéline crée un manchon isolant qui s’oppose au passage du courant tout en diminuant la résistance membranaire et donc, diminue le temps de charge.
L’influx ne peut se reboucler qu’aux nœuds de Ranvier où sont présents de nombreux canaux voltage-dépendants :  La vitesse de conduction est fortement augmentée.
La vitesse de conduction est fortement augmentée.
On trouve en majorité ce type de fibres dans le système nerveux périphérique. La perte de myéline va entraîner de graves pathologies. Par exemple, la démyélinisation du système nerveux central entraîne l’apparition de sclérose en plaque.
Le sens de progression du courant. La progression se fait du soma vers l’arborisation terminale. Le potentiel d'action ne peut pas remonter car les canaux voltage-dépendants situés en amont de la dépolarisation sont dans un état inactif.
V La transmission synaptique.
A Etude des canaux chimio-dépendants.
La jonction neuromusculaire : c’est une connexion entre une fibre motrice et une fibre musculaire : la zone de jonction est appelée « plaque motrice ».
Expérience : on provoque une stimulation de l’axone et on enregistre les phénomènes électriques se passant au niveau de la plaque motrice.
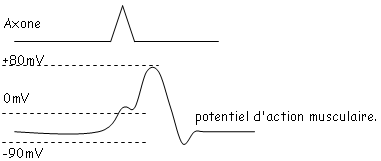
Cas du curare : c’est un poison de la plaque motrice qui entraîne la paralysie par découplage de l’axone moteur avec le muscle.
La première dépolarisation correspond à un potentiel post synaptique excitateur (PPSE) : c’est le potentiel de plaque motrice. On montre que ce potentiel local se propage de façon électrique.
B L’origine du potentiel.
En voltage-clamp, on va étudier les courants ioniques mis en œuvre. On prend une plaque motrice à un potentiel imposé. Si on bloque la membrane à –100mV et que l’on provoque une stimulation de l’axone moteur, on enregistre un fort courant rentrant.

Les courants entrants transportent des ions positifs : on a donc une dépolarisation.
0mV est le potentiel d’équilibre obtenu pour le passage simultané de deux ions : Na et K au travers de la membrane. On parle de canaux cationiques.
Le même résultat est obtenu si l’on injecte de l’acétylcholine dans la fente synaptique au lieu de stimuler l’axone moteur. Les canaux s’ouvrent : ils sont chimio-dépendants. Cette dépolarisation est limitée par la quantité de K+ sortant. Le courant créé par les canaux chimio-dépendants se propage et va stimuler des canaux voltage-dépendants, ce qui explique la seconde phase de la dépolarisation.
Donc : le potentiel d'action arrive au niveau de la terminaison, les canaux voltage-dépendants s’ouvrent, du Ca2+ rentre et il y a libération de neurotransmetteurs. L’acétylcholine se fixe sur les récepteurs nicotiniques (liés à un canal cationique). L’activation de ces récepteurs entraîne un potentiel de plaque motrice qui déclenche un potentiel d'action sur la fibre musculaire par activation de canaux voltage-dépendants.
Ces synapses sont uniquement excitatrices et elles fonctionnent avec un rapport 1/1 (réponse pour tous les potentiels d'action).
Au niveau des synapses de l’encéphale, il existe des synapses excitatrices et des inhibitrices qui peuvent être de types différents en fonction de leur localisation.
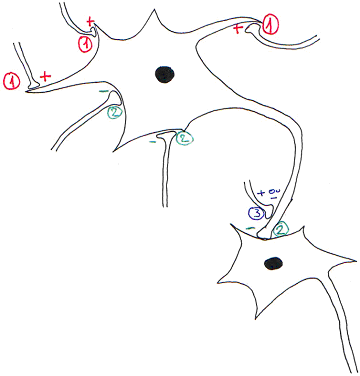
1 : synapse axo-dendritique.
2 : synapse axo-somatique.
3 : synapse axo-axonique (excitatrice ou inhibitrice).
Quand la synapse est excitatrice, elle pourra entraîner un PPSE (avec dépolarisation). Quand elle inhibitrice, elle pourra donner un PPSI (avec hyper polarisation).
Le neurone fait la somme algébrique de ces informations dont la résultante sera l’émission, le cas échéant, au niveau du cône axonique, d’un potentiel d'action ou d’un train de potentiels d'action.
La sommation peut donner une stimulation infraliminaire qui ne déclenchera pas de potentiel d'action ou une stimulation supraliminaire qui, elle, donnera un potentiel d'action. Dans le cas d’un train de potentiels d’action, on pourra trouver entre deux et dix potentiels.
Les synapses excitatrices mettent en jeu des canaux cationiques. Les inhibitrices, elles, mettent en jeu des canaux laissant passer spécifiquement, soit le chlore (anionique), soit le potassium (cationique).
Le neurone va intégrer toutes ces informations (les potentiels d’action infraliminaires qui lui parviennent). Ses caractéristiques (valeur des constantes d’espace et de temps) vont définir les capacités de sommation spatiale et temporelle.
1 sommation spatiale.
Si plusieurs potentiels post-synaptiques excitateurs apparaissent sur des branches dendritiques différentes, ils vont être conduits passivement jusqu’au niveau du cône axonique (baisse d’amplitude avec la distance).
Si les pertes sont peu importantes, il va y avoir apparition d’un potentiel d'action. La perte d’amplitude des PPSE est liée à la constante d’espace de chaque dendrite : plus la constante est élevée, plus la perte d’amplitude est réduite.
Il en va de même pour les PPSI.
2 Sommation temporelle.
La sommation temporelle concerne la sommation en un même point (d’une dendrite) de plusieurs PPS arrivant successivement : plus la constante de temps est élevée, plus la cellule pourra sommer de PPS.
La constante de temps définie la capacité de sommation temporelle. T=R x C. T augmente quand le diamètre augmente.
C Relation morphologie/caractéristiques.
Au niveau des synapses axo-axoniques, il peut encore y avoir modulation de l’information.
La terminaison axonique est dépourvue de canaux voltage-dépendants : le potentiel d'action envahie donc passivement la terminaison de l’axone. Il y aura donc baisse d’amplitude. Cette dernière pourra être modulée par une synapse axo-axonique facilitatrice ou inhibitrice.
En conséquence, la modulation du potentiel d'action joue sur la quantité libérée de neurotransmetteurs.
VI Les neurotransmetteurs.
Il existe environ une centaine de neurotransmetteurs différents dans le système nerveux central.
A Les grandes classes.
- Acides aminés (glutamate, aspartate, gaba, glycine).
- Amines biogènes : adrénaline, noradrénaline, dopamine et sérotonine.
- Acétylcholine.
- Enképhalines (peptides, morphinomimétiques).
- Hormones.
B Principe de fonctionnement.
Certains nucléotides n’ont qu’un type d’action (ils sont rares) : les acides aminés. Le glutamate et l’aspartate sont excitateurs ; le gaba et la glycine sont présents chez les interneurones inhibiteurs.
Tous les neurotransmetteurs ont deux types de récepteurs post synaptiques :
- Ionotropiques : le récepteur est directement couplé à un canal ionique. L’action du neurotransmetteur est rapide et correspond toujours à une variation du potentiel de membrane.
- Métabotropiques : le récepteur est couplé à une protéine G membranaire : la fixation du neurotransmetteur entraîne l’activation de messagers secondaires et de voies métaboliques dans la cellule, conduisant, en fonction du type cellulaire, à une excitation ou à une inhibition cellulaire ; ou, à des effets à long terme sur le métabolisme cellulaire.  Cette transmission synaptique est lente et modulable.
Cette transmission synaptique est lente et modulable.
Par exemple, l’acétylcholine a un effet excitateur sur un récepteur nicotinique, et, sur un récepteur muscarinique, un effet excitateur ou inhibiteur.
I Remarques introductives.
Les fonctions sensorielles permettent à l’individu (son organisme) de recueillir des informations sur le milieu extérieur et sur le milieu intérieur.
- Les « 5 sens » liés à une prise active : * regarder * écouter * toucher * goûter * sentir.
- D’autres sensibilités conscientes : * douloureuses * température * proprioception (sensibilité de son propre corps).
- Sensibilités inconscientes : * taux d’O2 * taux de CO2 * température (pour la régulation de la température corporelle).
- Classification basée sur l’origine des informations : * extéroception * intéroception.
- Classification selon la nature des événements : * mécanoception (réponse à des informations) * chimioception (sensibilité aux molécules) * photoception * thermoception.
- La somesthésie est la sensibilité provenant du corps.
- Le maintient de l’éveil est plus facile quand il y a arrivée de nombreuses informations.
- Lors d’un fonctionnement du système autonome , on parle alors d’hallucinations.
II Le système sensoriel.
Le système est composé d’entrées (moyens d’acquisition des informations) et d’une sortie (ce que l’on ressent).
A Les entrées du système.
Nous ne sommes pas forcément sensibles à toutes les informations : il y a filtrage de ces informations aux entrées des systèmes sensoriels. Le filtrage n’est pas identique pour toutes les espèces animales. Les insectes sont par exemple sensibles aux U.V.
C’est le stimulus qui agit sur le système.
B La sortie du système.
La sortie du système est une sensation. Il existe des instruments méthodologiques qui permettent d’étudier nos sensations : la psychophysique.
- Le seuil de stimulation est la quantité minimale d’informations pour qu’apparaisse une sensation.
- Le seuil différentiel est la différence minimale qui soit perceptible entre deux stimulations.
- Localisation spatiale d’une stimulation : elle permet de marquer le point d’origine du stimulus.
- Mesure de discrimination : c’est la distinction de deux stimulations identiques, rapprochées dans l’espace et le temps.
En fonction de la référence où l’on se trouve, la sensation est différente.
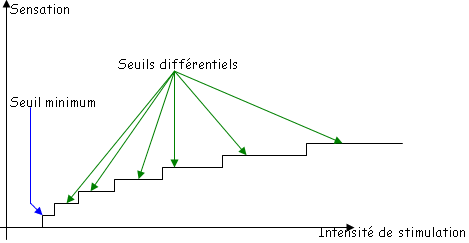
En général, on utilise des unités logarithmiques (log de l’intensité de la stimulation).
III Les organes sensoriels.
Les organes sensoriels sont regroupés dans une même zone (« les 5 sens ») ou peuvent être répartis dans tout le corps (somesthésie).
Un organe sensoriel regroupe deux éléments : le ou les annexes pour le filtrage et le récepteur sensoriel pour l’envoie du message nerveux.
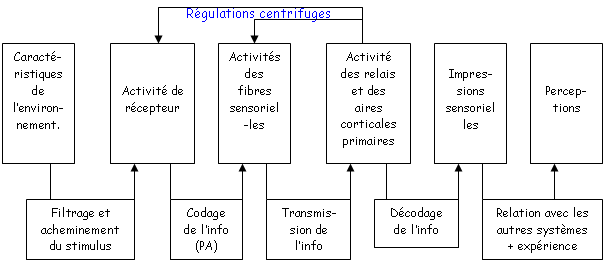
A La mise en place de la réponse.
Il y a des différences selon le type des récepteurs. On a trois différents récepteurs qui correspondent à la mise en jeu de 1 à 3 cellules pour le codage de l’information.
1 Les récepteurs de type 1.
|
|
C’est le cas des récepteurs tactiles, il est composé d’une unique cellule (récepteur simple). Le recueil des potentiels de récepteurs est proche du site d’initiation du potentiel d'action. C’est une sommation simple qui donne le potentiel d'action. L’information naît sur une zone de la peau et va jusqu’à la moelle épinière.
|
2 Les récepteurs de type 2.
|
|
Ils sont typiques des récepteurs auditifs (audition et équilibration) ; deux cellules sont nécessaires.
La première cellule est une cellule sensorielle, ciliée, sensible à une déformation de la partie apicale. Elle fait apparaître un potentiel de récepteur qui va entraîner la libération de neurotransmetteurs (rôle pré synaptique). Il y aura alors génération d’un potentiel d'action dans le neurone (rôle post synaptique).
Le codage est réalisé en deux étapes, par deux cellules différentes. Il est possible qu’il y ait des axones centrifuges pouvant avoir un effet inhibiteur ou excitateur.  Modulation de la réponse. Modulation de la réponse.
|
3 Les récepteurs de type 3.
|
|
Ce type de récepteurs (visuels) met en jeu trois cellules.
La première cellule est sensible à l’action de la lumière et envoie des potentiels de récepteurs.
Le potentiel d'action apparaîtra au niveau de la troisième cellule.
La seconde cellule est une cellule de liaison qui présente une hyper polarisation ou une dépolarisation.
De la cellule 1 à la cellule 3, il y a conduction sans potentiel d'action. La conduction est donc décrémentielle.
Il y a des possibilités d’interaction entre les différents récepteurs par les cellules horizontales et par les cellules amacrines. Il y a donc un grand nombre de traitements avant l’envoie du message.
|
4 Finalement.
• Plus il y a de distance entre le site transducteur et le site générateur, plus il y a de traitements intermédiaires.
• L’information a changé de support. Il faut donc pouvoir retrouver : la durée, la localisation, l’intensité et la nature de la stimulation.
• Le codage de l’intensité. Selon la stimulation, on a un potentiel de récepteur qui code en amplitude. Il peut y avoir des sommations spatiales ou temporelles. L’intensité augmente quand l’amplitude du potentiel de récepteur croît. On a une notion de type logarithmique entre l’intensité et l’amplitude du potentiel de récepteur.
• Si la dépolarisation cellulaire est suffisante, il y aura déclenchement d’un ou plusieurs potentiels d’action. Le codage de la stimulation est réalisé en modulation de fréquence des potentiels d’action émis. On a aussi un système de seuillage des déclenchements des potentiels d’action dans les récepteurs.
• Le codage de la durée. On a deux types de réponse :
- Une réponse tonique : elle dure pendant toute la stimulation ; c’est réponse à adaptation lente (nocirécepteurs, articulations).
- Une réponse phasique : elle ne code qu’une partie de la stimulation (l’apparition du stimulus) ; c’est une réponse de type « ON ». Ce type de réponse code mal la durée mais elle présente une adaptation rapide. En réalité, on a trois réponses phasiques différentes : la réponse « ON » ; la réponse « OFF » ; la réponse « ON-OFF ».
• Interaction Intensité/durée : Quand la stimulation est brève, son intensité doit être forte pour être sentie.
• Le codage des caractéristiques spatiales : il y a correspondance topique (point par point) entre les points de la stimulation et là où ils vont être projetés. Au niveau des relais, on a cette correspondance et même au niveau cortical. Il n’y a pas proportionnalité entre les différentes zones (la peau, très importante en dimension, n’est associée qu’à une faible partie du cortex). Il y a des cheminements parallèles des informations, selon leur origine.
• Les champs récepteurs (notion électro-physiologique) forment un lien entre la zone stimulée et la réponse enregistrée.
• On parle de réponses adéquates quand c’est la stimulation pour laquelle le système est adapté. La sensation perçue dépend du système et non de la stimulation.
L’œil / Système sensoriel visuel.
I Généralités/Définitions.Un stimulus lumineux peut être défini par :
- sa brillance (intensité, éclat),
- sa couleur,
- sa taille (dimension),
- sa forme,
- une dimension de mouvement,
- sa profondeur. Un stimulus efficace a sa longueur d’onde comprise entre 400 et 700nm (entre le violet et le rouge).
L’œil n’a pas la même sensibilité pour les différentes longueurs d’onde. Lors d’une expérience où un sujet compare des plages de couleurs différentes et de même intensité (au niveau physique), celui-ci doit faire varier leur intensité physique pour avoir la même intensité de sensibilité visuelle. La meilleure sensibilité de l’œil est de l’ordre de 550nm. Pour des sujets adaptés à l’obscurité, il y a un décalage avec la première courbe et le maximum de sensibilité est atteint à 500nm.
 Il y a une dualité dans le fonctionnement de notre vision (diurne et crépusculaire).
Il y a une dualité dans le fonctionnement de notre vision (diurne et crépusculaire).
Le seuil de sensibilité absolue (quantité minimale d’énergie) donne la valeur la plus faible pour laquelle quelques photons suffisent à donner l’impression de lumière.
Cette sensibilité dépend tout de même de la zone de la rétine qui est stimulée et d’une précédente adaptation à l’obscurité.
A Les seuils différentiels.
Pour un niveau de gris, on a 30 à 40 distinctions. On n’est pas forcément sensible à la valeur de l’absorption  impression de contraste.
impression de contraste.
 Le système visuel nous renseigne plus sur la valeur relative que sur la valeur absolue.
Le système visuel nous renseigne plus sur la valeur relative que sur la valeur absolue.
B Courbe d’absorption à l’obscurité.
Cette courbe est la mesure du seuil absolu.
Au début de l’expérience, le seuil est relativement élevé ( mauvaise sensibilité du sujet) puis la sensibilité s’améliore progressivement.
mauvaise sensibilité du sujet) puis la sensibilité s’améliore progressivement.
La courbe présente un seuil de stabilisation.
Si l’on oblige le sujet à fixer la cible lumineuse, on a une adaptation médiocre. Si ce sujet ne fixe pas cette cible, on obtient alors une sensibilité maximale car le stimulus arrive en dehors du point fixé.
C Le champ visuel.
Ler champ visuel correspond à la zone de l’espace dans laquelle un stimulus est détectable pour un œil relativement fixe.
Pour un champ monoculaire, on a 90° de vision en temporal, 60° en nasal et 70° en haut et en bas.
La majeure partie du champ visuel global est binoculaire : sur 120°, on a une vision double qui permet la vision en3D grâce à ce recouvrement des deux champs visuels.
Il existe une zone qui se révèle aveugle (la tache aveugle) : c’est une zone de la rétine sans récepteurs.
D L’acuité visuelle ou discrimination spatiale.
L’acuité visuelle est la capacité à distinguer deux points rapprochés de l’espace. C’est le plus petit angle qui permette de distinguer deux objets rapprochés.
L’acuité est exprimée en degrés d’angle à cause de la bonne résolution. ? ? 1’ d’angle.
En fait, avec ces résultats, c’est que l’on est dans la zone la plus favorable de l’œil. Quand on ne fixe pas l’objet, l’acuité diminue fortement.
E La discrimination temporelle.
Chez l’homme, la discrimination temporelle est relativement mauvaise : elle est comprise entre 4 et 5ms.
F La vision des couleurs.
L’Homme est capable de distinguer 200 nuances colorées sur la base de la longueur d’onde.
En réalité, on en distingue beaucoup plus car ce que l’on voit ne correspond pas qu’à la longueur d’onde. On distingue aussi la saturation (degré de pureté), la brillance (intensité).
 On voit à peu près 1.000.000 de nuances différentes.
On voit à peu près 1.000.000 de nuances différentes.
G La vision de la profondeur.
On est capable de distinguer des objets en profondeur de ½ millimètre pour 1 mètre. A 10 mètres, on distingue 10 centimètres de profondeur.
La disparité rétinienne est la différence entre l’image de l’œil droit et celle de l’œil gauche qui donne deux images très légèrement différentes.
II Description de l’organe de l’œil.
L’œil est une formation sphérique dont le diamètre moyen est de 2,5 centimètres.
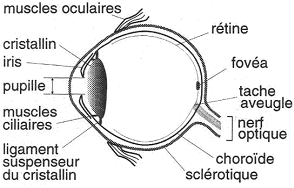
A La sclérotique.
La sclérotique est la partie dure, fibreuse qui donne sa forme à l’œil (le blanc). Elle est en continuité avec la gaine du nerf optique et même avec les méninges (la dure-mère).
Vers l’avant, cette sclérotique devient transparente et laisse passer la lumière : c’est la cornée. Cette dernière joue un rôle essentiel car c’est à ce niveau que les rayons lumineux subissent la réfraction maximale (phénomène qui permet de recevoir des images latérales).
Cette zone présente une richesse en muscles de l’œil (quatre nerfs crâniens contrôlent la motricité de l’œil).
B La choroïde.
La choroïde est une couche intermédiaire riche en vaisseaux sanguins. Elle permet la synthèse de nombreux liquides de l’œil (rôle métabolique). Elle contient un grand nombre de cellules pigmentaires qui forment la chambre noire de l’œil pour éviter les reflets lumineux. A l’avant de la choroïde, on trouve l’iris qui est un sphincter constitué de fibres musculaires circulaires. La contraction de ces fibres qui provoque la fermeture de la pupille est appelée « myosis ». On trouve aussi des muscles antagonistes (radiaires) pour l’ouverture de la pupille : c’est la « mydriase ». Ces deux systèmes sont commandés soit par le système orthosympathique (pour la mydriase) et par le système parasympathique (myosis). L’ouverture et la fermeture de ce diaphragme sont régulées par voie réflexe.
Ces systèmes peuvent toutefois être liés à d’autres facteurs (à cause du système orthosympathique) que des stimulus visuels.On trouve le cristallin (lentille optique convergente) qui peut subir des déformations. Ce cristallin possède un noyau dur avec autour, des fibres conjonctives enchevêtrées qui permettent une certaine souplesse.
Autour de ce cristallin se trouve un ligament suspenseur qui étire en permanence cette lentille (phénomène passif). Il y a aussi le mécanisme des muscles ciliaires qui permettent la déformation de l’arrière du cristallin et modifient ainsi son rayon de courbure. La « lentille » devient plus convergente : c’est l’accommodation.
Au repos, on a une vision nette à l’infini. L’accommodation, pour voir les objets proches, est un phénomène actif.
La presbytie entraîne une diminution de la souplesse du cristallin qui accommode alors moins bien.
La pupille est le noir de la chambre noire que l’on voit de l’extérieur.
C La rétine.
La rétine correspond à la partie la plus interne qui est très fine. C’est une zone nerveuse, en fait, l’organe sensoriel de l’œil.
La sphère n’est pas la meilleure forme pour obtenir la meilleure image. Les images arrivant sur la partie centrale seront bonnes alors que celles qui arrivent sur les zones périphériques seront plus floues.
On trouve trois couches cellulaires sur cette rétine. La zone photosensible est au fond et la lumière doit donc venir traverser les couches supérieures. Cette zone comprend les cônes et les bâtonnets. Au niveau de la fovéa (région de la rétine dans l’axe optique), la rétine est moins épaisse. Les deux premières couches sont déportées latéralement : la lumière arrive plus directement.
On a deux types de récepteurs répartis différemment sur la rétine. A 0°, on a donc la fovéa qui ne comporte que des cônes (en grand nombre) qui deviennent rares en s’éloignant vers la périphérie. Les bâtonnets sont beaucoup plus nombreux et sont répartis tout autour de la fovéa, sur toute la rétine périphérique (et particulièrement autour de la fovéa). Il y a aussi une zone particulière où l’on ne trouve ni cône ni bâtonnets : « la tâche aveugle ».
De l’intérieur de l’œil vers l’extérieur, on trouve :
- Les cellules ganglionnaires.
- Les neurones bipolaires.
- Les cônes et/ou les bâtonnets.La transduction a lieu dans les cônes ou les bâtonnets ; l’information transite dans un neurone bipolaire et un potentiel d'action (ou une salve de potentiels d’action) naît dans une cellule ganglionnaire. Tous les axones convergent au niveau du point d’insertion du nerf optique et traversent la rétine.  C’est une « rétine inversée »car la lumière arrive dans un sens et l’information chemine en sens inverse. C’est une caractéristique des yeux de vertébrés alors que les yeux de mollusques ne sont pas inversés.Au niveau de la fovéa, la lumière stimule un cône qui en relation avec un neurone bipolaire lui-même, relié à son neurone ganglionnaire : chaque cône a sa ligne de réponse.
C’est une « rétine inversée »car la lumière arrive dans un sens et l’information chemine en sens inverse. C’est une caractéristique des yeux de vertébrés alors que les yeux de mollusques ne sont pas inversés.Au niveau de la fovéa, la lumière stimule un cône qui en relation avec un neurone bipolaire lui-même, relié à son neurone ganglionnaire : chaque cône a sa ligne de réponse.
Au niveau de la rétine périphérique, plusieurs (3 à 5) bâtonnets sont en relation avec un neurone bipolaire. Plusieurs (4 à 6) neurones bipolaires sont eux-mêmes en relation avec un neurone ganglionnaire. Un neurone ganglionnaire est donc représentatif d’une zone de la rétine. On comprend donc mieux la discrimination : la fovéa a une discrimination parfaite : « point par point » alors que la rétine périphérique possède une définition par zone, par conséquent, une mauvaise résolution spatiale.
En vision crépusculaire, les cônes de la fovéa seront insuffisamment excités pour donner une information. Au contraire, la rétine périphérique répond à la faible lumière : les informations de plusieurs bâtonnets convergent vers un neurone bipolaire et plusieurs neurones bipolaires convergent sur un neurone ganglionnaire : on obtient donc, par sommation, un potentiel d'action. La rétine périphérique est la zone la plus photosensible.
La rétine périphérique est la zone la plus photosensible.
III La transduction visuelle.L’arrivée de la lumière dans la cellule visuelle entraîne une différence de potentiel en hyper polarisation. On remarque la faiblesse du potentiel de repos relativement élevé (-35mV). En fait, la lumière ne fait qu’amener le potentiel membranaire de la cellule photosensible au niveau du potentiel de repos d’une cellule classique.Dans les cônes et les bâtonnets, on note la présence de segments interne (vers le globe oculaire) et de segments externes, avec des replis membranaires où se trouvent des photopigments (absorbant la lumière).Sur les cônes, les replis sont simples alors que sur les bâtonnets, les replis sont anastomosés.Le photopigment le plus connu est la « rhodopsine ». C’est une molécule transmembranaire constituée d’une opsine et d’un groupement prosthétique : le rétinal (associé à l’opsine).
La rhodopsine absorbe les rayons lumineux selon des pics dont le plus important est situé dans les UV (à 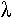 =300nm). Les UV étant rares, le pic qui nous intéresse est donc le pic
=300nm). Les UV étant rares, le pic qui nous intéresse est donc le pic  (entre 500 et 510nm) : c’est celui qui explique le maximum de sensibilité nocturne.
(entre 500 et 510nm) : c’est celui qui explique le maximum de sensibilité nocturne.
Quand la lumière arrive sur la rhodopsine, elle transforme ce pigment en méta rhodopsine et le rétinal passe de la forme 11cis à la forme trans. Il y a donc séparation en opsine/rétinal. Un recyclage est possible au bout de quarante cinq minutes.
Au niveau du segment externe, les canaux sodium sont ouverts en permanence à l’obscurité. Seul le segment interne comporte des pompes à sodium (pompe Na/K), d’où l’existence de ce courant d’obscurité. ? C’est ce courant qui entraîne un potentiel de repos plus élevé que dans les autres cellules.
La lumière va provoquer la fermeture des canaux sodium et donc, une hyper polarisation.
Ces canaux sodium sont soumis à la présence de GMPc (ils sont GMPc dépendants). Si la concentration en GMPc diminue, les canaux se ferment.
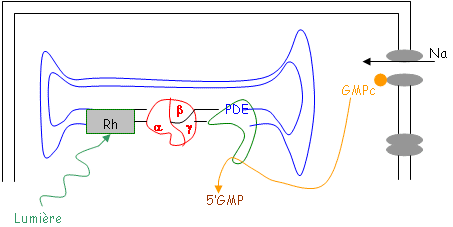
Il y a activation d’une protéine « g » (Transducine) après la coupure de la rhodopsine. Il y a alors activation d’une phosphodiestérase qui vient détruire le caractère cyclique du GMPc et donc fermer les canaux.
Au niveau fonctionnel, le mécanisme se déroule avec une certaine inertie : d’où la faible résolution temporelle de l’œil.
La rhodopsine est le pigment des bâtonnets.
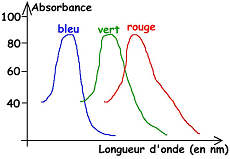
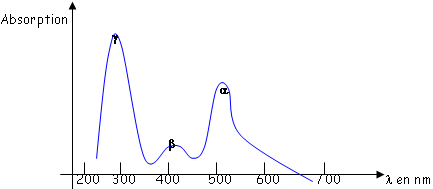
Le spectre d’absorption des cônes (ci dessus) nous montre qu’il existe trois types de pigments, donc trois cônes différents.
En réalité, seule la configuration de l’opsine diffère par rapport à la rhodopsine des bâtonnets, ce qui crée un décalage du spectre d’absorption. On peut voir qu’il y a un recouvrement du spectre par les différents cônes. Ils vont être plus ou moins stimulés pour leur propre pigment : c’est une vision trichromatique.
Il existe des cas où les sujets ne possèdent pas les trois types de cônes ; il peut manquer de un à trois types de cônes : c’est le daltonisme.
IV Mécanismes d’adaptation à la lumière.
Les cellules photoréceptrices donnent en permanence un courant d’obscurité par des canaux Na-GMPc dépendant. C’est le taux de GMPc qui détermine l’ouverture de ces canaux. Cet aminoacide cyclique est synthétisé par la guanylate cyclase. Chaque fois que le sodium entre dans la cellule, du Ca2+ entre aussi ; le rapport est de 7 Na pour 1 Ca2+. C’est ce calcium qui va agir sur cette enzyme en l’empêchant de synthétiser du GMPc.
Si l’éclairement est très fort, tous les canaux se ferment (récepteurs saturés). Le calcium ne peut plus rentrer et sa concentration intracellulaire va diminuer. Il y a alors levée de l’inhibition de la guanylate cyclase qui reprend la synthèse de GMPc et provoque ainsi la réouverture des canaux.
 Il y a alors dépolarisation puis adaptation au nouveau niveau d’éclairement.
Il y a alors dépolarisation puis adaptation au nouveau niveau d’éclairement.
Ce mécanisme est différent du mécanisme d’adaptation à l’obscurité : il est beaucoup plus rapide et n’a besoin que de quelques secondes.
Les cellules bipolaires sont en connexion avec les cellules photosensibles. On trouve deux nouveaux types cellulaires qui assurent les liaisons horizontales :
- Les cellules horizontales. Elles établissent des liaisons sur les synapses des neurones bipolaires et sensoriels.
- Les cellules amacrines. Elles établissent des liaisons sur les synapses des neurones bipolaires et ganglionnaires.
Si l’on plante une électrode dans une cellule bipolaire, on obtient deux types de réponses qui dépendent du type de cellules horizontales mises en jeu : dépolarisation ou hyperpolarisation. Attention, il n’y a pas de potentiel d'action dans ces cellules mais seulement des variations de potentiel.
On a pu montrer que ces cellules répondent à l’action d’un neurotransmetteur spécial : le glutamate. Celui-ci est émis à l’obscurité. Quand on stimule la rétine, la quantité de glutamate émis dans la synapse va diminuer.
Le neurone bipolaire se dépolarise à la lumière, donc, quand il y a moins de glutamate :  Le glutamate va hyperpolariser cette cellule. Au niveau de la synapse, on trouve des canaux GMPc dépendants.
Le glutamate va hyperpolariser cette cellule. Au niveau de la synapse, on trouve des canaux GMPc dépendants.
Pour les cellules bipolaires hyperpolarisantes :
- A la lumière, elles sont dépolarisées par le glutamate.
- A l’obscurité, elles sont hyperpolarisées.
V Les champs récepteurs.
A Champ récepteur au niveau des cellules bipolaires.
En fait, ce que l’on observe est un « champ récepteur ». On recherche, par un spot lumineux fin, la zone de l’espace où la présence du stimulus modifie la réponse de la cellule (dépolarisation ou hyperpolarisation).
On obtient, au niveau des cellules bipolaires, des champs récepteurs circulaires de quelques degrés (1 à 4). La réponse va être différente si ce spot se trouve au centre ou à la périphérie du champ. Par exemple, on peut avoir une dépolarisation quand le centre est stimulé et une hyperpolarisation quand c’est la périphérie qui l’est.
La réponse antagoniste est une inhibition latérale exercée par les cellules horizontales.
Pour une cellule bipolaire hyperpolarisante :
|
|
Quand on stimule dans l’axe, on obtient une hyperpolarisation.
Quand on stimule la périphérie, on obtient une dépolarisation. |
On obtient des différences selon le lieu d’enregistrement de la rétine :
- Sur la fovéa : La partie centrale du champ récepteur est très petite (1 minute d’angle)
- Sur la périphérie : Il va y avoir sommation spatiale et la partie centrale du champ va être de plusieurs degrés.
Sur ces cellules, la conduction est purement électrique, car les cellules sont de petite taille.
B Champ récepteur au niveau des cellules ganglionnaires.
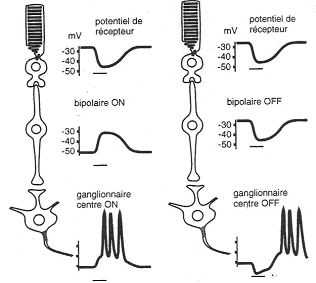
Au niveau de ces cellules, on trouve aussi une zone circulaire mais aussi, l’apparition de potentiels d’actions. On observe les mêmes types de champs mais ils sont nommés différemment.
|
Les « centres ON » : Pour des cellules ganglionnaires liées à des cellules bipolaires dépolarisantes. Pour une stimulation dans la région ON, il y a apparition d’un potentiel d'action ou augmentation de la fréquence de potentiels d'action. Si la zone périphérique est stimulée, il y aura inhibition du potentiel d'action ou diminution de la fréquence des potentiels d'action.
|
|
|
|
Les « centres OFF » : Pour des cellules ganglionnaires liées à des cellules bipolaires dépolarisantes. La stimulation du centre de la zone va inhiber les potentiels d'action ou faire chuter leur fréquence. La stimulation de la zone périphérique permettra l’apparition de potentiels d'action ou l’augmentation de leur fréquence.
|
Là aussi, pour la taille de la partie centrale, il y a une différence entre la zone fovéale (1 minute d’angle) et la zone périphérique (5 à 6 degrés).
La zone synaptique entre une cellule sensorielle, une cellule bipolaire et une cellule horizontale est appelée « une triade ». Il se manifestera l’influence de la cellules centrale et des cellules latérales antagonistes.
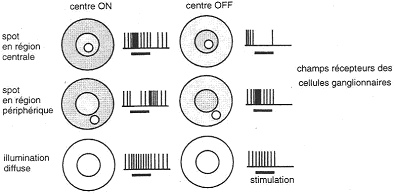
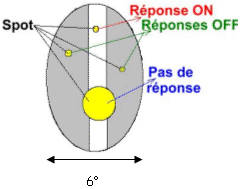
Pour un centre ON, quand le spot est en région centrale, il va déclencher l’accroissement de la fréquence des potentiels d'action.
Lorsque ce spot est en région périphérique, il va y avoir inhibition de la réponse (disparition totale [éclairement de toute la périphérie] ou partielle des potentiels d'action).
Quand le spot occupe toute la région centrale, la fréquence des potentiels d'action va être fortement augmentée (maximum).
Lors d’une illumination diffuse, il n’y a pas d’effet notable.
Pour les centres OFF, c’est la même chose que pour le centre ON mais inversée. Lorsque tout le champ est recouvert par la lumière, il n’y a aucune réponse.
C La classification des cellules ganglionnaires.
Chez les primates, on peut réaliser une classification des cellules ganglionnaires. On trouve :
1 Les cellules P.
Ce sont de petites cellules, nombreuses (80% des cellules ganglionnaires), situées au niveau de la fovéa. Elles possèdent une arborisation dendritique très importante. L’antagonisme entre le centre du champ et la périphérie est très marqué.
2 Les cellules M.
Ces cellules sont de très grandes dimensions avec peu d’arborisation dendritique mais très étendues. On les trouve au niveau de la rétine périphérique. Leur champ récepteur est plus large. L’antagonisme entre le centre et la périphérie est moins marqué. Elles ont une bonne sensibilité au mouvement.
 Elles interviennent dans la vision peu précise.
Elles interviennent dans la vision peu précise.
3 Les cellules W.
Ce sont des cellules de très petite taille qui répondent beaucoup au mouvement. Elles ont un réponse très « ON/OFF » : elles répondent à l’allumage et à l’extinction.
 Elles ont un rôle dans la régulation de la motricité de l’œil.
Elles ont un rôle dans la régulation de la motricité de l’œil.
VI L’organisation des voies afférentes.
Le premier relais des nerfs visuels se fait au niveau des corps genouillés latéraux. C’est un relais pour les cellules P et M.
Toutefois, le cheminement sera différent selon l’origine des neurones ganglionnaires.
A Les corps genouillés latéraux.
Le champ visuel est divisé en deux parties, droite et gauche. Pour la vision de l’hémichamp droit :
- Au niveau de l’œil droit, les stimulus qui touchent sur la rétine nasale arrivent après le croisement sur les corps genouillés latéraux gauches.
- Au niveau de l’œil gauche, les stimulus touchant la rétine temporale arrivent après le chiasma optique sur les corps genouillés latéraux gauche.
Toutes les informations venant de gauche (pas de l’œil gauche mais de la partie gauche de la vision) se projettent à droite.
Toutes les informations venant de droite se projettent à gauche.
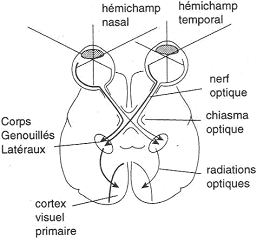
B Le cortex visuel primaire.
Après les corps genouillés latéraux, les informations se projettent sur le cortex visuel primaire (Aire 17) qui se situe autour de la scissure calcarine.
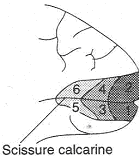
Les informations fovéales (venant d’une très petite zone) se projettent sur une large zone du cortex visuel : ce sont les informations les mieux traitées.
Les tubercules quadrijumeaux antérieurs (ou colliculus supérieurs) reçoivent les informations provenant des cellules W et de quelques cellules M. Ces voies sont le point de départ de voies de réflexes moteurs : accommodation, régulation du diamètre de la pupille.
Selon l’origine spatiale du stimulus, différentes zones de la rétine sont stimulées : on aura alors des projections différentes au niveau des relais et du cortex visuel.
C Organisation au niveau des relais.
1 Les corps genouillés latéraux.
On peut analyser des champs récepteurs au niveau des corps genouillés latéraux. Ils sont très comparables à ceux des cellules ganglionnaires : circulaires, concentriques, centre ON ou OFF avec une accentuation de l’antagonisme entre le centre et la périphérie du champ.
Les corps genouillés latéraux font parti du thalamus qui est une zone de triage des informations sensorielles, en relation étroite avec le cortex cérébral.
Dans les corps genouillés latéraux, 80% des fibres viennent du cortex et seules 20% des fibres proviennent des afférences visuelles (rétines).
La projection des fibres n’est pas aléatoire : les parties latérales sont plus volumineuses que les parties centrales.
Ces corps genouillés sont constitués de six couches successives.
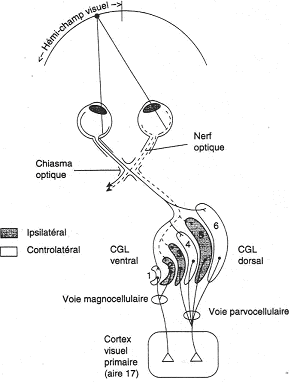
Les zones latérales reçoivent les informations provenant des cellules P, de la fovéa (zones 3, 4, 5, 6) alors que les zones 1 et 2 reçoivent les informations de la rétine périphérique, cellules M.
Les informations de la rétine nasale se projettent sur les couches 1, 4, 6. Les information de la rétine temporale se projettent sur les couches 2, 3, 5.
Par une coloration au désoxyglucose - (radioactif) qui se fixe dans les tissus les plus actifs – lorsque l’on stimule un œil (l’autre étant masqué), on révèle ensuite les zones actives qui confirment la disposition des projections sur les couches des corps genouillés latéraux.
2 Le cortex cérébral.
Deux faisceaux partent des corps genouillés latéraux vers le cortex :
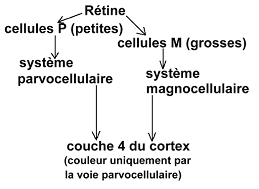
- Le faisceau P : Parvocellulaire, qui transporte l’information fovéale.
- Le faisceau M : Magnocellulaire, qui transporte l’information périphérique.
Ces deux faisceaux se projettent dans des zones précises du cortex.
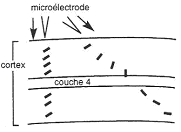
Le cortex a six couches successives en profondeur. Les fibres venant des corps genouillés latéraux arrivent dans la couche 4. Le premier relais est ici dans la couche 4. Les neurones qui arrivent sont des neurones visuels à champ récepteur circulaire, concentrique avec antagonisme, à centre ON ou OFF.
Si l’on enregistre les autres couches de ce cortex, on trouve des nouveaux neurones avec un nouveau type de champ récepteur. On peut réaliser une classification des différents champs (classification de Hubel et Wiesel) :
- Cellules simples.
- Cellules complexes.
- Cellules hypercomplexes.
 Les cellules simples.
Les cellules simples.
Ces cellules ont un champ récepteur allongé, un peu plus étendu que ceux de la rétine. Il n’est pas concentrique ; il y a antagonisme entre la partie longitudinale et les parties latérales.
On retrouve ces champs en stimulant l’œil droit ou l’œil gauche  la réponse est binoculaire, mais un œil répond plus fort que l’autre (
la réponse est binoculaire, mais un œil répond plus fort que l’autre ( c’est la dominance oculaire). Cette dominance sert à l’adaptation à la réception d’informations orientées dans l’espace : le stimulus optimal est allongé.
c’est la dominance oculaire). Cette dominance sert à l’adaptation à la réception d’informations orientées dans l’espace : le stimulus optimal est allongé.
 Ces cellules sont des détecteurs d’orientation spatiale du stimulus.
Ces cellules sont des détecteurs d’orientation spatiale du stimulus.
Remarque : dans le cortex, on a des cellules pour détecter toutes les orientations possibles de la stimulation.
On passe de champs récepteurs circulaires à un champ plus grand par la sommation de cellules dirigées dans une certaine direction : vers la cellule simple qui intègre ces informations. Plusieurs centaines de cellules de la couche 4 vont vers une cellule simple.
 Les cellules complexes.
Les cellules complexes.
Ces cellules sont toujours à champ récepteur étendu. Elles répondent à une orientation du stimulus : différence entre blanc/noir  max. et noir/blanc
max. et noir/blanc  min.
min.
Elles répondent aussi à la position de la limite noir/blanc. La réponse est maximale au 2/3 du champ.
Finalement, elles répondent aussi à une notion de mouvement. La réponse est maximale quand l’angle se déplace au milieu du champ (? réponse hyper complexe).
 Le niveau de spécialisation des cellules complexes est plus complexe ( ! ) que celui des cellules simples. Elles permettent un traitement séquentiel de l’information. Il existe toutefois une limite à ce traitement.
Le niveau de spécialisation des cellules complexes est plus complexe ( ! ) que celui des cellules simples. Elles permettent un traitement séquentiel de l’information. Il existe toutefois une limite à ce traitement.
A côté de ce traitement de l’information visuelle, il en existe un en parallèle qui a été démontré par l’étude des cellules simples.
Les détecteurs ne sont pas répartis aléatoirement dans le cortex.
Si une électrode est enfoncée perpendiculairement à la surface du cortex, on enregistre successivement les cellules simples qui répondent à l’orientation ( environ 45°)  il y a une orientation par zone.
il y a une orientation par zone.
Si l’électrode est enfoncée à 45°, on rencontre des cellules à orientation légèrement différente les unes des autres (2 à 2).
Il existe donc des colonnes d’orientation. Tout le cortex visuel présente cette architecture.
Par coloration au désoxyglucose, on peut montrer qu’il existe des zones répondant à l’axe de la stimulation : on a une mosaïque de répartition des cellules simples sous la surface du cortex.
Les cellules simples ont un champ récepteur « binoculaire ». Il y a toujours un œil dominant par rapport à l’autre  c’est la dominance oculaire. La coloration montre une mosaïque représentant l’œil dans la participation de la réponse des cellules simples.
c’est la dominance oculaire. La coloration montre une mosaïque représentant l’œil dans la participation de la réponse des cellules simples.
 On peut décomposer la totalité du cortex en modules représentant les différentes directions de l’espace en codant pour les dominances controlatérales (l’œil dominant est de l’autre côté) ou ipsilatérales (l’œil dominant est du même côté).
On peut décomposer la totalité du cortex en modules représentant les différentes directions de l’espace en codant pour les dominances controlatérales (l’œil dominant est de l’autre côté) ou ipsilatérales (l’œil dominant est du même côté).
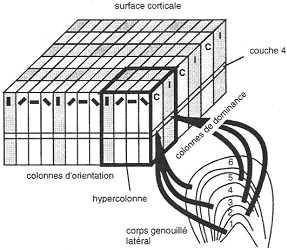
Dans un bloc, on trouve toutes les directions de l’espace avec une réponse pour l’œil controlatéral et une pour l’ipsilatéral : c’est une unité fonctionnelle : l’hypercolonne. Cette hypercolonne est une zone corticale de 1mm² regroupent les cellules simples répondant à toutes les direction de l’espace et à l’origine de la stimulation (œil controlatéral ou ipsilatéral).
D’une colonne d’orientation à sa voisine, il y a une dizaine de degrés d’écart (de 10° et 10°). La largeur de la colonne varie entre 30 et 100µm. La dominance oculaire est de 500µm. Une hypercolonne regroupe à peu près 50 000 cellules simples.
Selon le nombre d’hypercolonnes stimulées, on a la dimension de l’objet (en fonction de son orientation).
Au-delà des aires primaires, il y a d’autres traitements par les aires secondaires ou associatives : elles ont un rôle dans la localisation de la stimulation visuelle et dans le traitement du mouvement.
Le traitement est différent selon l’origine des informations (voie magnocellulaire ou parvocellulaire). L’information parvocellulaire (fovéale) subit un traitement pour la couleur. Il existe des cellules qui répondent différemment dans l’hypercolonne, réparties en deux régions chacune.
Au centre de chaque demie hypercolonne, il y a une tâche (blob) où il y a les cellules répondant à la couleur. Les champs récepteurs sont circulaires, concentriques et à antagonisme qui correspond à couleur de stimulation (+  ON et -
ON et -  OFF).
OFF).

Le jaune est vu par une réponse intermédiaire vert/rouge.
 On a une simplicité de ces 2 x 2 types de cellules dans le cortex.
On a une simplicité de ces 2 x 2 types de cellules dans le cortex.
VII Bilan.
Au final, on a deux grandes voies dans le cortex primaire :
- La voie pariétale : elle transmet les informations du système somesthésique (mouvements, …) pour participer à la formation de la vision stéréoscopique.
- La voie d’origine parvocellulaire : elle passe dans la région ventrale, permet la vision des formes (reconnaissance) et finit par participer à la vision stéréoscopique.
Contrôle nerveux de la motricité somatique.
I Remarques générales.
Un muscle se contracte en réponse à un ordre moteur venant du système nerveux central.
La contraction musculaire donne deux réponses observables :
- Un raccourcissement du muscle qui entraîne le déplacement d’un segment de membre ( mouvement).
mouvement).  C’est la contraction phasique, isotonique : le tonus musculaire reste identique.
C’est la contraction phasique, isotonique : le tonus musculaire reste identique.
- Le développement d’une force importante sans mouvement apparent.  ? C’est la contraction tonique, isométrique, sans raccourcissement.
? C’est la contraction tonique, isométrique, sans raccourcissement.
Chaque muscle peut assurer les deux contractions mais on trouve deux grandes catégories de muscles qui, en fonction de leur emplacement sur le squelette, seront toniques ou phasiques.
Les muscles qui assurent le mouvement sont plutôt distaux : en position distale, à l’extrémité des membres.
Les muscles assurant le tonus sont situés dans l’axe du corps (axiaux) et comprennent aussi les muscles extenseurs des extrémités.
Ces muscles ont des caractéristiques cellulaires différentes :
- Muscles toniques : ils sont rouges (très irrigués), on y met en évidence des contractions lentes et de longue durée.
- Muscles à mouvement : ce sont des muscles pâles à contractions rapides qui sont rapidement fatigués.
Quand un mouvement se produit, il y a mise en jeu de deux muscles antagonistes afin que l’articulation soit mobilisée.
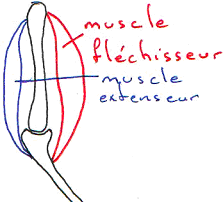
Lors de la contraction d’un muscle, son antagoniste est relâché par inhibition de sont motoneurone (de l’antagoniste). Attention, il n’y a pas d’ordre moteur qui induise l’allongement. Un ordre moteur provoquera la contraction ou l’inhibition d’un muscle. L’allongement est un phénomène extérieur mécanique.
On verra que la motricité est organisée de façon hiérarchique. Les mouvements les plus simples sont les réflexes et les activités automatiques (marche, toux) dont le contrôle est essentiellement assuré par la moelle épinière.
Un niveau de complexité supérieur concerne le tonus et la posture : faculté de maintenir la position du corps. (exemple : la station debout).
Le contrôle de la posture et du tonus met en jeu le tronc cérébral et le cervelet, et, prend en compte des ré-afférences sensorielles des yeux et de l’oreille interne.
Le troisième niveau de complexité concerne les mouvements volontaires. Ils nécessitent l’initiation du mouvement (motivation, idée), la programmation et la réalisation motrice (rôle du lobe frontal). Il y a aussi l’intervention parallèle des ganglions de la base et du cervelet dans le contrôle de la programmation et l’exécution du mouvement.
La voie de sortie finale où convergent tous les ordres moteurs est le motoneurones ?, situé dans la corne ventrale de la moelle épinière.
II Le système musculaire.
Fibre musculaire = cellule musculaire.
Le muscle n’est pas qu’un organe moteur. Il possède, au niveau des tendons et de la partie charnue, des récepteurs sensoriels. L’innervation du muscle comporte des fibres sensorielles et des fibres motrices.
A Innervation motrice.
On distingue trois types de motoneurones innervant le muscle. Leur corps cellulaire est situé dans la corne ventrale de la moelle épinière (nerf rachidien) ou dans les noyaux moteurs du tronc cérébral (nerfs crâniens).
1 Le motoneurone  .
.
Ce motoneurone quitte la moelle épinière par la racine ventrale et vient innerver le muscle par l’intermédiaire d’une jonction neuromusculaire. Il innerve les fibres musculaires extrafusales
Un motoneurone  se divisent en plusieurs collatérales qui innervent chacune, une fibre musculaire.
se divisent en plusieurs collatérales qui innervent chacune, une fibre musculaire.
L’ensemble des fibres innervées par un seul motoneurone constitue « l’unité motrice ». Le rapport d’innervation peut être de 1/10ème à 1/100ème. Il dépend de la fonction du muscle : 1/10ème pour les muscles phasiques (contrôle fin de l’activité motrice) ; 1/100ème pour les muscles toniques.
Une fibre musculaire ne reçoit qu’une fibre nerveuse  un ordre du motoneurone
un ordre du motoneurone  provoque la contraction de l’ensemble des fibres constituant l’unité motrice.
provoque la contraction de l’ensemble des fibres constituant l’unité motrice.
2 Le motoneurone  .
.
Les motoneurones  sont plus petits et moins nombreux que les
sont plus petits et moins nombreux que les  . Ils ont toutefois la même localisation. Ils innervent exclusivement les fibres intrafusales (ou fusoriales), c’est-à-dire, contenues dans le fuseau neuromusculaire qui est un des récepteurs sensoriels situés dans le muscle.
. Ils ont toutefois la même localisation. Ils innervent exclusivement les fibres intrafusales (ou fusoriales), c’est-à-dire, contenues dans le fuseau neuromusculaire qui est un des récepteurs sensoriels situés dans le muscle.
Un motoneurone va innerver plusieurs fuseaux.
3 Le motoneurone  .
.
Chez les mammifères et chez l’Homme, ce troisième type de motoneurone présente une innervation mixte : innerve à la fois les fibres intrafusales et extrafusales.
B Innervation sensorielle.
A l’intérieur du muscle, dans les tendons et au niveau des articulations se trouvent des récepteurs sensoriels à l’origine de la proprioception (composante de la somesthésie, cortex pariétal). La proprioception, c’est la sensation de percevoir son propre corps : position dans l’espace, par rapport à la gravité, des segments de membres les uns par rapport aux autres.
On trouve deux types de récepteurs musculaires. Les récepteurs proprioceptifs sont associés à des fibres sensitives réparties en groupes en fonction de leur diamètre :
- Les fibres des groupes 1 et 2 : ces fibres sont de gros diamètre et myélinisées. Leur vitesse de conduction est rapide.
- Les fibres des groupes 4 et C : ces fibres sont fines, amyélinisées, associées à la transmission de la douleur (vitesse plus lente).
1 Le fuseau neuromusculaire.
Le fuseau neuromusculaire est un organe sensoriel qui se réparti à l’intérieur de la partie charnue du muscle. Ces fuseaux sont situés parallèlement aux fibres musculaires. Ce sont de petits organes ovoïdes délimités par une capsule conjonctive remplie d’une substance gélatineuse.
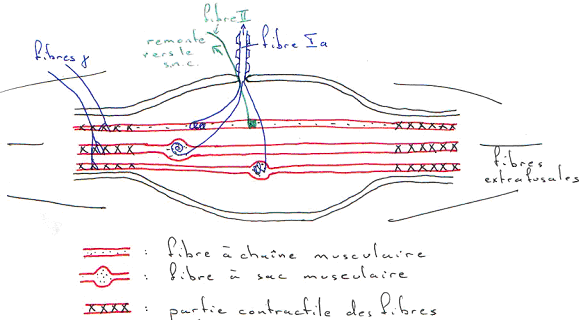
Ils contiennent des fibres musculaires intrafusales particulières :
- Les fibres à chaîne musculaire.
- Les fibres à sac musculaire.
 La partie contractile de ces fibres est aux extrémités.
La partie contractile de ces fibres est aux extrémités.
Le fuseau neuromusculaire est un organe sensoriel avec :
- Des fibres afférentes. On en trouve qui innervent la zone centrale des fibres intrafusales  ce sont les fibres Ia : elles innervent les fibres à sac ou à chaîne.
ce sont les fibres Ia : elles innervent les fibres à sac ou à chaîne.
- Des fibres de groupe II qui innervent les fibres à chaîne.
Ces fibres sensorielles ont un corps cellulaire situé dans le ganglion spinal (racine dorsale).
Le fuseau neuromusculaire présente une innervation motrice. Les motoneurones  innervent la partie distale des fibres intrafusales. En formant des jonctions neuromusculaires.
innervent la partie distale des fibres intrafusales. En formant des jonctions neuromusculaires.
 Fonctionnement du fuseau neuromusculaire.
Fonctionnement du fuseau neuromusculaire.
Le fuseau neuromusculaire est sensible à l’étirement du muscle. Quand ce dernier s’allonge, on enregistre des trains de potentiels d'action qui remontent vers la moelle épinière par les fibres Ia et II.
L’étirement de la partie centrale des fibres est à l’origine d’une déformation mécanique des terminaisons sensorielles qui s’enroulent dans cette région.
Des canaux membranaires s’ouvrent sous l’effet d’actions mécaniques (déformations) et sont à l’origine d’un potentiel de récepteur au niveau de la terminaison. Si le seuil de dépolarisation est atteint, il y a apparition de potentiels d'action au niveau du premier nœud de Ranvier (à la sortie de la fibre de la capsule). Les informations remontent vers la moelle épinière où elles sont utilisées dans un réflexe. Ces informations, par des collatérales ascendantes, vont gagner le cortex pariétal où elles seront utilisées pour la perception consciente du corps et des membres et dans la mise en jeu de boucles de régulation longues du mouvement.
 Codage de l’information.
Codage de l’information.
Les fibres Ia et II ne codent pas exactement les mêmes informations.
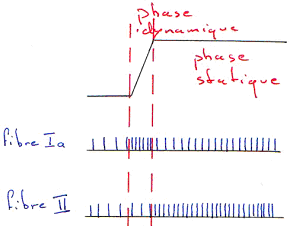
La fréquence sur les fibres II dépend de la nouvelle longueur atteinte par le muscle : elle ne code pas la phase dynamique.
Les fibres Ia codent la vitesse de la variation de longueur du muscle alors que les fibres II codent la longueur instantanée du muscle.
 Le fuseau neuromusculaire code les deux paramètres.
Le fuseau neuromusculaire code les deux paramètres.
Quand le fuseau neuromusculaire est étiré par allongement du muscle, le système nerveux est renseigné en permanence des variations de longueur.
Pendant la contraction musculaire, le fuseau neuromusculaire est silencieux : la partie équatoriale est distendue, donc, il n’est plus sensible. Les fibres fusimotrices  vont alors intervenir pour faire retrouver la sensibilité intrafusale. Ces fibres ? sont commandées par le système nerveux central. Un ordre moteur véhiculé par ces fibres entraîne la contraction des parties polaires des fibres intrafusales. Si elles se contractent, il y a étirement de la région équatoriale :
vont alors intervenir pour faire retrouver la sensibilité intrafusale. Ces fibres ? sont commandées par le système nerveux central. Un ordre moteur véhiculé par ces fibres entraîne la contraction des parties polaires des fibres intrafusales. Si elles se contractent, il y a étirement de la région équatoriale :  c’est la restauration de la décharge des fibres sensorielles.
c’est la restauration de la décharge des fibres sensorielles.
Le fuseau neuromusculaire est un récepteur sensoriel dont le niveau de sensibilité est défini par le système nerveux central (pour contrôler le tonus et la tension du muscle pendant le mouvement).
Pour un mouvement fin, on trouve deux types de fibres  :
:
- Les fibres  dynamiques : elles vont augmenter la sensibilité du fuseau à la phase dynamique d’étirement.
dynamiques : elles vont augmenter la sensibilité du fuseau à la phase dynamique d’étirement.
- Les fibres  statiques : leur effet est d’augmenter la fréquence de base de décharge : il y a perte de sensibilité du fuseau. Ce codage intervient plus dans le contrôle du tonus.
statiques : leur effet est d’augmenter la fréquence de base de décharge : il y a perte de sensibilité du fuseau. Ce codage intervient plus dans le contrôle du tonus.
2 Le récepteur de Golgi.
Le récepteur de Golgi est présent dans les tendons (partie d’insertion du muscle sur l’os). Il est constitué de faisceaux de collagène entouré d’une capsule. Ces faisceaux sont placés en série avec les fibres squelettiques.
Le récepteur est innervé par une fibre sensorielle de gros diamètre (fibre Ib) ainsi que par d’autres axones du groupe 3 au rôle inconnu.
Cette fibre dont le corps cellulaire est situé dans le ganglion de la racine dorsale remonte vers la moelle épinière.
Ce récepteur n’a pas d’innervation motrice. Le stimulus efficace est la contraction du muscle. Quand le muscle se contracte, les unités motrices sont contractées, ce qui provoque l’étirement du récepteur (à cause de la tractions sur les tendons). La déformation mécanique est à l’origine du train de potentiels d'action enregistrés sur la fibre Ib.
Ce récepteur présente une réponse statique et une réponse dynamique pendant la contraction. Il renseigne le système nerveux sur la force de contraction exercée par le muscle sur les tendons. Cette information peut être utilisée dans un réflexe de relâchement brutal de la contraction, si la tension sur les tendons est trop élevée.
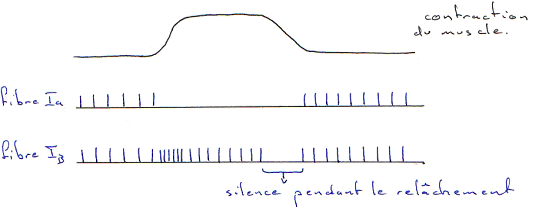
Le muscle en tant que système musculaire possède deux récepteurs qui permettent au système nerveux central d’être informé en permanence sur la longueur du muscle et sur la force de contraction.
III Activités réflexes médullaires.
En général, un réflexe correspond à une connexion qui s’établie dans le système nerveux central entre une afférence sensorielle et une efférence motrice.
En fonction de la localisation des récepteurs sensoriels par rapport à l’effecteur musculaire, on distingue deux classes de réflexes : les réflexes intrinsèques et les réflexes extrinsèques.
Les arcs réflexes peuvent être plus ou moins complexes et faire intervenir les structures supra-médullaires. Les réflexes médullaires s’établissent au niveau de la moelle épinière (dans la substance grise). Ils persistent après la section de la moelle épinière.
Remarque : chez les mammifères plus évolués, ces réflexes persistent après la section mais vont être modifiés par le système nerveux central.
A Réflexes intrinsèques.
Ces réflexes sont déclenchés par des récepteurs situés dans l’organe effecteur. On trouve deux réflexes : le réflexe myotatique qui est déclenché par la stimulation du fuseau neuromusculaire et le réflexe du au récepteur de Golgi (réflexe tendineux de Golgi).
1 Le réflexe myotatique.
Ce réflexe est la contraction réflexe du muscle, provoquée par son propre étirement. Quand on l’étire, il va se contracter (muscle homonyme).
Ce réflexe est en permanence mis en jeu dans le maintien de la posture (station debout). La contraction réflexe des muscles extenseurs des membres, en permanence étirés par la pesanteur, assure le maintien de l’ouverture des articulations (membres inférieurs)
Si ce contrôle ne se fait plus, c’est la chute.
Ce réflexe myotatique n’est pas visible immédiatement. De façon clinique, on le met en évidence par la percussion du muscle extenseur de la cuisse ou de la cheville.
 Circuit nerveux.
Circuit nerveux.
L’étirement du muscle provoque l’étirement des fuseaux neuromusculaires et donc, des trains de potentiels d'action passent sur les fibres Ia. Cette information, codée en fréquence, atteint la moelle épinière par la racine dorsale. Les fibres Ia se connectent de façon monosynaptique avec les motoneurones  qui innervent le muscle.
qui innervent le muscle.
Chaque motoneurone  reçoit plusieurs boutons synaptiques de chacune des fibres Ia provenant du muscle.
reçoit plusieurs boutons synaptiques de chacune des fibres Ia provenant du muscle.
 On enregistre des PPSE qui vont être soumis à des intégrations spatiales et temporelles. Cette synapse est excitatrice et le neurotransmetteur est le glutamate.
On enregistre des PPSE qui vont être soumis à des intégrations spatiales et temporelles. Cette synapse est excitatrice et le neurotransmetteur est le glutamate.
Les mêmes fibres Ia inhibent, par l’intermédiaire d’un interneurone inhibiteur, le motoneurone  du muscle antagoniste : c’est le principe de « l’innervation réciproque ». Les mêmes afférences inhibent les muscles antagonistes avec un interneurone qui utilise comme neurotransmetteur le GABA ou la glycine pour inhiber le motoneurone
du muscle antagoniste : c’est le principe de « l’innervation réciproque ». Les mêmes afférences inhibent les muscles antagonistes avec un interneurone qui utilise comme neurotransmetteur le GABA ou la glycine pour inhiber le motoneurone  antagoniste.
antagoniste.
Cette inhibition réciproque est nécessaire si l’on veut que l’articulation fonctionne.
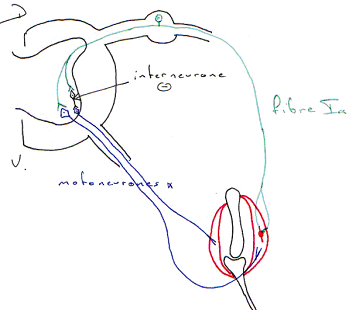
 Autorégulation des motoneurones
Autorégulation des motoneurones  .
.
Les motoneurones  sont soumis à une inhibition récurrente (leur niveau d’activité est auto-contrôlé).
sont soumis à une inhibition récurrente (leur niveau d’activité est auto-contrôlé).
Le motoneurone émet une collatérale qui vient exciter un interneurone inhibiteur (GABA ou glycine) : c’est la cellule de Renshaw. Le motoneurone s’auto-inhibe et inhibe le taux de décharge sur les fibres  et donc, la force de contraction développée par le muscle.
et donc, la force de contraction développée par le muscle.
La cellule de Renshaw inhibe les motoneurones  qui innervent le muscle et les motoneurones des muscles synergistes (muscles qui accompagnent le muscle homonyme). Par contre, elle lève l’inhibition sur le muscle antagoniste.
qui innervent le muscle et les motoneurones des muscles synergistes (muscles qui accompagnent le muscle homonyme). Par contre, elle lève l’inhibition sur le muscle antagoniste.
 Régulation de tous les systèmes associés.
Régulation de tous les systèmes associés.
 La boucle
La boucle  .
.
Quand un muscle est étiré, par voie réflexe, il reprend sa longueur initiale : c’est un système rigide. Le réflexe myotatique, isolé de toute régulation, s’oppose au mouvement. Ce réflexe est ajusté en permanence, ce qui permet d’ajuster la longueur du muscle.
Ce système d’ajustement est assuré par les fibres  fusimotrices : on parle de « boucle
fusimotrices : on parle de « boucle  ».
».
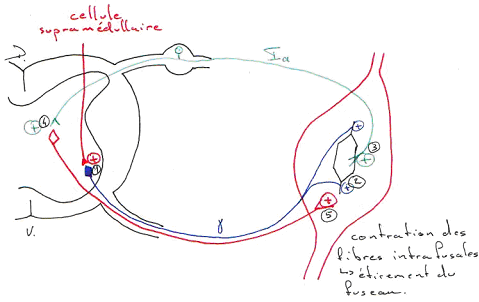
Le muscle se met à la longueur définie par le programme moteur. La longueur du muscle est contrôlée en permanence par la boucle 
 un muscle ne peut que se contracter.
un muscle ne peut que se contracter.
On observe d’abord l’activation de  puis celle d’
puis celle d’ . Dans les mouvements volontaires, il y a co-activation des motoneurones
. Dans les mouvements volontaires, il y a co-activation des motoneurones  et
et  , ce qui signifie que la programmation centrale d’un mouvement comporte simultanément l’activation des motoneurones
, ce qui signifie que la programmation centrale d’un mouvement comporte simultanément l’activation des motoneurones  et
et 
 la programmation du mouvement et du tonus musculaire est nécessaire.
la programmation du mouvement et du tonus musculaire est nécessaire.
La mise en jeu du système  fusimoteur assure plusieurs fonctions. Ce système règle la sensibilité du fuseau. Quand le muscle est contracté, le récepteur retrouve sa sensibilité grâce au motoneurone
fusimoteur assure plusieurs fonctions. Ce système règle la sensibilité du fuseau. Quand le muscle est contracté, le récepteur retrouve sa sensibilité grâce au motoneurone  .
.
La boucle  permet de fixer la longueur du muscle à une valeur définie par les centres moteurs : c’est « le point de consigne ». Le réflexe myotatique permet de maintenir ce point mais ce dernier peut varier à tous moments.
permet de fixer la longueur du muscle à une valeur définie par les centres moteurs : c’est « le point de consigne ». Le réflexe myotatique permet de maintenir ce point mais ce dernier peut varier à tous moments.
2 Le réflexe tendineux de Golgi.
Il s’agit de l’inhibition des motoneurones  innervant un muscle, en réponse à la contraction du même muscle.
innervant un muscle, en réponse à la contraction du même muscle.
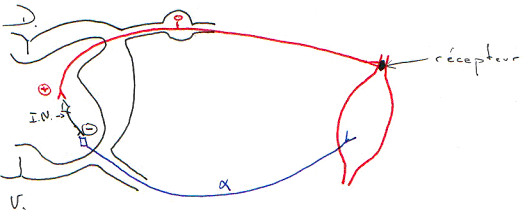
Quand le muscle est contracté, la latence du motoneurone est supérieure à celle observée dans le réflexe myotatique. Il doit y avoir intervention d’un interneurone inhibiteur.
La fibre Ib active, par voie polysynaptique, les motoneurones des muscles antagonistes.
 C’est un réflexe d’inhibition autogénique, développé dans les muscles extenseurs. Dans les muscles fléchisseurs, le réflexe n’est pas symétrique. On a montré que l’inhibition des motoneurones
C’est un réflexe d’inhibition autogénique, développé dans les muscles extenseurs. Dans les muscles fléchisseurs, le réflexe n’est pas symétrique. On a montré que l’inhibition des motoneurones  (PPSI) apparaît en début de stimulation (de la contraction du muscle). Quand la contraction est maintenue, l’inhibition disparaît.
(PPSI) apparaît en début de stimulation (de la contraction du muscle). Quand la contraction est maintenue, l’inhibition disparaît.
Cela signifie que la décharge des afférences Ib est inhibée au niveau central par un contrôle de type présynaptique. Le contrôle de l’inhibition pré-synaptique a lieu au niveau de la moelle épinière, sur les entrées sensorielles.
Ce réflexe permettrait de réaliser des contractions harmonieuses en évitant les paliers et d’amortir des variations d’intensité des contractions. Par contre, quand la contraction est trop violente, on observe un relâchement brutal (réflexe myotatique inverse) qui correspond à une forte inhibition de motoneurone  .
.
 C’est un réflexe pour la protection des tendons.
C’est un réflexe pour la protection des tendons.
B Les réflexes extrinsèques.
Les réflexes extrinsèques sont déclenchés par la stimulation de récepteurs sensoriels cutanés et musculaires non localisés dans l’organe effecteur. On trouve par exemple les réflexes ipsilatéraux de flexion qui sont les plus caractéristiques. Ce sont en général des réflexes de protection. Ils mettent en jeu une coordination musculaire importante.
Les fibres afférentes concernées sont :
- Les fibres A ou C, d’origine cutanée. Elles sont fines, amyélinisées et correspondent souvent à des terminaisons libres dans la peau. Elles sont généralement associées aux stimulations douloureuses (haut seuil pour le déchargement).
ou C, d’origine cutanée. Elles sont fines, amyélinisées et correspondent souvent à des terminaisons libres dans la peau. Elles sont généralement associées aux stimulations douloureuses (haut seuil pour le déchargement).
- Toutes les fibres sensitives d’origine musculaire sauf les grosses fibres (Ia et Ib).
 Ces fibres forment l’ensemble de « Afférents du Réflexe de Flexion » (ARF).
Ces fibres forment l’ensemble de « Afférents du Réflexe de Flexion » (ARF).
Ces fibres atteignent les couches dorsales de la moelle épinière et vont se connecter de façon largement polysynaptique avec les motoneurones qui commandent les muscles fléchisseurs et les muscles synergistes.
Le passage de l’information se fait avec un délai de 3 à 4ms, donc, il y a 3 ou 4 synapses qui sont traversées.
Les mêmes afférences, par innervation réciproque, provoquent l’inhibition des muscles extenseurs.
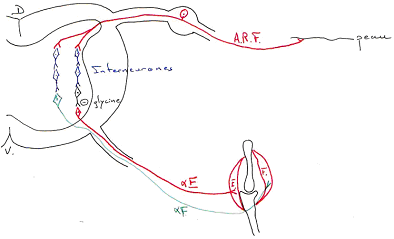
C’est un circuit polysynaptique.
La glycine intervient dans la perméabilité membranaire au chlore. Les informations venant des ARF stimulent les segments médullaires adjacents en hauteur :  les collatérales montent et/ou descendent sur les interneurones longitudinaux (dans la moelle épinière).
les collatérales montent et/ou descendent sur les interneurones longitudinaux (dans la moelle épinière).
Ceci explique que le réflexe de flexion peut s’étendre aux autres membres, en fonction de l’intensité de la stimulation.
Si la stimulation est faible, le réflexe reste situé au membre stimulé. Si l’intensité augmente, la flexion du membre stimulé s’accompagne de l’extension du membre opposé de la même ceinture. Si l’intensité est très forte, on observe en plus, des réponses inversées pour les membres de l’autre ceinture.
Cette extension croisée et de réponses inversées pour l’autre ceinture mettent eu jeu des interneurones médullaires qui sont évidemment stimulés par les ARF.
D’autres réflexes extrinsèques sont connus et utilisés cliniquement pour tester l’intégrité des voies nerveuses :
- Notamment réflexe cutané plantaire qui provoque la flexion des orteils (réflexe de Babinski).  Il y a un contrôle des centres supra-médullaires sur les réflexes.
Il y a un contrôle des centres supra-médullaires sur les réflexes.
- Réflexe cutané abdominal : contraction des muscles abdominaux provoquée par la stimulation de la peau du ventre.
- Réflexe crémastérien : rétraction des testicules provoquée par la stimulation de la face interne des cuisses.
 Il y a un contrôle permanent des centres médullaires par le système nerveux central.
Il y a un contrôle permanent des centres médullaires par le système nerveux central.
IV Contrôle du tonus et de la posture.
La posture est position particulière et stable du corps dans l’espace. Son maintien est un phénomène actif, sous le contrôle du système nerveux central. Ce contrôle nécessite la coordination d’activités réflexes motrices. La posture a trois fonctions essentielles :
- S’opposer à la gravité (lutter contre l’affaissement du corps).
- Assurer l’équilibre du corps immobile quand une force externe s’ajoute au poids : rétroactions correctives.
- Coordonner le maintien de l’équilibre du corps avec l’exécution d’un mouvement : anticipation du contrôle de la posture.
Ce sont des régions différentes de l’encéphale qui exercent ces régulations mais qui sont toutes situées au niveau du tronc cérébral. L’activité musculaire qui sous-tend la posture, bien qu’inconsciente (non perçue), est permanente : c’est le tonus musculaire. Celui-ci est permanent et accompagne les activités motrices.
A Contrôle médullaire du tonus.
Ce tonus musculaire correspond à l’état de tension des muscles au repos. Il est entretenu par le taux de décharge des motoneurone  . La décharge de ces neurones est elle-même déterminée par la décharge des afférences Ia. Le tonus est particulièrement développé dans les muscles axiaux et les muscles extenseurs. Les motoneurones concernés occupent la partie médiane de la corne ventrale.
. La décharge de ces neurones est elle-même déterminée par la décharge des afférences Ia. Le tonus est particulièrement développé dans les muscles axiaux et les muscles extenseurs. Les motoneurones concernés occupent la partie médiane de la corne ventrale.
Le tonus est maintenu par le réflexe myotatique. Ce tonus est en permanence réajusté par la boucle  qui va déterminer la fréquence de décharge de base des fibres Ia. Cependant, si l’on sectionne la moelle épinière, le tonus est complètement modifié : la section haute (inter-coliculaire) ou décérébration entraîne une hypertonie
qui va déterminer la fréquence de décharge de base des fibres Ia. Cependant, si l’on sectionne la moelle épinière, le tonus est complètement modifié : la section haute (inter-coliculaire) ou décérébration entraîne une hypertonie  opisthotonos (rigidité de décérébration) ; la section basse de la moelle épinière provoque l’hypotonie. La lésion des motoneurones
opisthotonos (rigidité de décérébration) ; la section basse de la moelle épinière provoque l’hypotonie. La lésion des motoneurones  , ou la section des afférences Ia entraînent aussi l’hypotonie.
, ou la section des afférences Ia entraînent aussi l’hypotonie.
 La moelle épinière, seule, n’est pas capable d’assurer le tonus adapté. Elle est donc sous l’influence de centres supra-médullaires.
La moelle épinière, seule, n’est pas capable d’assurer le tonus adapté. Elle est donc sous l’influence de centres supra-médullaires.
B La formation réticulée.
La formation réticulée est localisée dans le tronc cérébral et s’étend du mésencéphale au bulbe rachidien. Elle occupe la partie centrale du tronc cérébral. Elle se présente sous forme de réseau désorganisé de fibres à l’intérieur desquelles sont dispersées les corps cellulaires. On observe des faisceaux ascendants activateurs ou inhibiteurs sur le cerveau antérieur. On trouve aussi des faisceaux descendant activateurs ou inhibiteurs.
Cette structure reçoit, par des collatérales, des informations de toutes les modalités sensorielles qui ne sont pas décodées mais qui servent d’activateur général et maintiennent un niveau d’éveil cérébral. La formation réticulée est le « commutateur du cerveau ».
Les faisceaux ascendants servent à l’activité : veille/sommeil. Les faisceaux descendant vont permettre d’ajuster le contrôle moteur en fonction de l’état de veille/sommeil.
La formation réticulée pontique (du pont de Varol) constitue un système activateur descendant. Les fibres réticulospinales se connectent par des voies directes ou indirectes sur les motoneurones  et
et  . Les synapses activatrices entraînent une augmentation du tonus musculaire et des réflexes médullaires, en général.
. Les synapses activatrices entraînent une augmentation du tonus musculaire et des réflexes médullaires, en général.
La formation réticulée bulbaire constitue un système inhibiteur descendant sur les mêmes motoneurones (extenseurs) et fusimoteurs ( ).
).
 Ces deux systèmes antagonistes exercent leurs effets de façon simultanée : le tonus dépend de l’équilibre entre les deux. Pendant le sommeil, le tonus diminue ou disparaît complètement pendant la phase de sommeil paradoxal.
Ces deux systèmes antagonistes exercent leurs effets de façon simultanée : le tonus dépend de l’équilibre entre les deux. Pendant le sommeil, le tonus diminue ou disparaît complètement pendant la phase de sommeil paradoxal.
La formation réticulée est responsable des ajustements à-priori du tonus musculaire en vue de la réalisation du mouvement.
 Cette formation exerce un contrôle anticipateur.
Cette formation exerce un contrôle anticipateur.
C Noyau vestibulaire et cervelet dans les ajustements correcteurs de la posture.
La posture peut être modifiée par des évènements extérieurs et imprévisibles, ce qui sous-entend la capacité de correction, donc, de rétroaction sensorielle.
Tous les sens participent à ces réajustements. Les récepteurs sensoriels les plus sollicités sont les récepteurs à l’équilibre de l’oreille interne : les récepteurs vestibulaires.
1 Les récepteurs vestibulaires.
Les récepteurs vestibulaires sont localisés dans la partie interne de l’oreille, appelée vestibule. Le vestibule comporte des canaux semi-circulaires disposés dans chaque plan de l’espace. A la base de chaque canal se trouve une ampoule qui contient les récepteurs sensoriels.
Ces récepteurs portent le nom de « crêtes ampullaires ». Ces crêtes sont constituées de cellules ciliées. Les récepteurs sont sensibles aux accélérations angulaires de la tête. A la base des canaux semi-circulaires, on trouve deux sacs : « utricule » et « saccule ». Chacun renferme un organe sensoriel constitué de cellules ciliées : les « maculas ». Ces organes sensoriels sont sensibles aux déplacements linéaires de la tête dans les trois plans de l’espace. La sensation se fait grâce aux déplacements des « otolithes » qui sont des cristaux de CaCO3 placés sur les cils. Par inertie, ces cristaux entraînent le déplacement des cils. Dans certains cas (pathologies), il y a déplacement des otolithes dans les crêtes, ce qui provoque des vertiges.
Toutes ces cellules ciliées sont innervées par le nerf vestibulaire qui gagne le tronc cérébral et se projettent sur les noyaux vestibulaires. Le noyau le plus concerné dans ces réactions de correction est le noyau latéral ou « de Deiters ».
Les informations en provenance des vestibules sont reçues par ce noyau de Deiters. Les afférences se projettent également sur la partie caudale du cervelet. Les noyaux vestibulaires et le cervelet envoient en retour, des informations sur la moelle épinière pour corriger le dérèglement de la posture.
Le noyau de Deiters est à l’origine du faisceau vestibulo-spinal qui atteint tous les segments ipsilatéraux. Le faisceau exerce une excitation des motoneurones  et
et  des muscles anti-gravitaires et contribue, avec la formation réticulée pontique, à l’activation tonique posturale.
des muscles anti-gravitaires et contribue, avec la formation réticulée pontique, à l’activation tonique posturale.
Les cellules du noyau de Deiters sont elles-mêmes sous le contrôle inhibiteur du cervelet. Par voie indirecte, le cervelet exerce donc une action inhibitrice sur le tonus : ce sont les réactions compensatrices qui sont également décrites à partir d’informations visuelles qui gagnent les colliculi supérieurs (ils sont à l’origine des réflexes oculomoteurs).
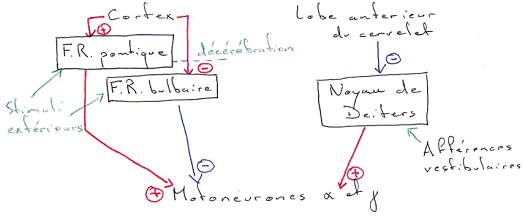
Dans le cas d’une décérébration, on supprime totalement l’influence inhibitrice de la formation réticulée bulbaire. L’influence de la formation réticulée pontique est maintenue.
 On a donc une hypertonie.
On a donc une hypertonie.
La rigidité de décérébration est atténuée par la section des racines dorsales de la moelle épinière (car on supprime la boucle  ).
).
Si l’on provoque la lésion du noyau de Deiters, on abolit la rigidité du côté de la lésion chez l’animal décérébré.
Si, chez un animal décérébré, on provoque la lésion du lobe antérieur du cervelet, on accroît la rigidité et la section des racines dorsales, dans ce cas, n’abolie pas la rigidité (activation des motoneurones  ).
).
V Les mouvements volontaires.
Un mouvement volontaire est sous la dépendance du néo-cortex moteur ou extra-moteur et sous celle de structures comme les ganglions de la base ou du cervelet.
Un mouvement volontaire peut être divisé en trois phases :
- La phase préparatoire, au cours de laquelle se fait l’identification de l’objet, sa reconnaissance, sa position et la position du corps par rapport à l’objet. Cette phase est sous le contrôle du cortex sensoriel associatif (cortex frontal).
- La phase de programmation du mouvement à accomplir.
- La phase d’exécution du mouvement au cours de laquelle, on distingue différentes étapes :
• Initiation du mouvement ou mouvement balistique (rapide et ample). Cette partie est initiée par les ganglions de la base. Elle va au bout sans rétroaction sensorielle : c’est le déplacement initial du segment concerné.
• Ajustement. Le mouvement se ralentie et est contrôlé par des ré-afférences sensorielles. Cette phase implique la participation du cervelet.
• Préhension (saisie de l’objet). Elle met en jeu la motricité fine des extrémités. Cette motricité est directement contrôlée par l’aire motrice primaire.
A Les territoires corticaux moteurs.
Les territoires corticaux moteurs se situent dans le lobe frontal. En avant du sillon de Rolando se situe le cortex moteur primaire.
A l’avant de ce cortex, on trouve l’aire motrice supplémentaire (ou aire motrice secondaire). La troisième aire motrice (cortex pré-moteur) est à l’avant et à la base du cortex moteur.
Les stimulations électriques délivrées dans le cortex moteur primaire entraînent des contractions de muscles isolés dans la moitié du corps opposé à la stimulation.
On peut montrer qu’au sein du cortex moteur primaire est contenue une représentation somatique de tous les muscles :  c’est l’homonculus moteur, équivalent de l’homonculus somesthésique.
c’est l’homonculus moteur, équivalent de l’homonculus somesthésique.
Remarque : la représentation de la force est beaucoup plus grande que celles des autres parties du corps, sauf les doigts et la musculature de la parole. La représentation des zones peut être modifiée en fonction des aptitudes et des apprentissages.
La stimulation de l’aire motrice supplémentaire provoque le mouvement d’un membre (coordination entre muscles antagonistes).
La stimulation de l’aire pré-motrice provoque des réactions d’orientation de toute une partie du corps (elle implique la coordination bilatérale).
On a vu que l’aire motrice I est l’aire d’exécution du mouvement. Les aires pré-motrice et supplémentaire étaient la localisation d’un programme moteur transmis à l’aire primaire. Si l’aire primaire est lésée, la stimulation des deux autres aires ne se traduit pas par des mouvements.
Les aires supplémentaires et pré-motrices contiennent une mémoire des programmes moteurs.
Les neurones de l’aire primaire du cortex moteur ne codent pas uniquement la contraction d’un muscle mais commandent aussi la force que doit développer un muscle au cours du mouvement.
B Les voies motrices descendantes.
Les informations convergent vers la corne ventrale.
Les aires motrices corticales sont à l’origine de voies motrices descendant vers les motoneurones de la moelle épinière (voies cortico-spinales). Les cellules de la couche 5 du cortex (cellules pyramidales) sont à l’origine de ces voies. Ces fibres corticales empruntent la capsule interne, se rassemblent dans les pédoncules cérébraux où elles forment les faisceaux pyramidaux.
« Faisceau pyramidal » est du à la forme de faisceau au niveau du bulbe et non aux fibres pyramidales.
Ces fibres sont issues des cortex moteurs mais aussi du cortex somesthésique.
Les fibres motrices se terminent sous la corne ventrale. Les fibres somesthésiques se terminent dans la corne dorsale où elles contrôleraient le niveau des entrées sensorielles (fibres Ia, Ib, …)
Les ¾ des fibres du faisceau pyramidal croisent la ligne médiane au niveau des pyramides bulbaires et se terminent dans la partie latérale de la corne ventrale.  C’est le faisceau cortico-spinal latéral qui contrôle essentiellement la musculature des membres et des extrémités.
C’est le faisceau cortico-spinal latéral qui contrôle essentiellement la musculature des membres et des extrémités.
Le ¼ restant entre directement dans la moelle épinière et constitue le faisceau cortico-spinal ventral : les fibres, une fois arrivées à leur destination, croisent la ligne médiane dans la moelle épinière pour atteindre les motoneurones de la partie médiane de la corne ventrale. Ces fibres contrôlent la musculature axiale.
Une partie des fibres issues ces cortex moteurs font relais dans le tronc cérébral. Certaines s’arrêtent dans le mésencéphale (au niveau du noyau rouge) à partir duquel émerge le faisceau rubro-spinal qui se termine sur les motoneurones de la partie latérale (membres et extrémités).
Les derniers : les dernières fibres font relais au niveau de la formation réticulée. Elles donnent les faisceaux réticulo-spinaux se terminant dans la partie médiane de la moelle épinière.
 Le cortex moteur dispose ainsi de deux voies pour influencer les motoneurones spinaux :
Le cortex moteur dispose ainsi de deux voies pour influencer les motoneurones spinaux :
- La voie directe ou voie pyramidale.
- La voie indirecte qui passe par le noyau rouge et la formation réticulée.
La voie cortico-spinale est récente phylogénétiquement et n’est pas terminée à la naissance chez l’Homme.
La section de la voie directe n’entraînera pas de paralysie mais les mouvements fins, la dextérité et la rapidité des mouvements seront abolis.
La section du faisceau pyramidal entraînera une hypertonie médullaire et une hyporéflexivité (extrinsèque). Le réflexe de Babinski disparaîtra aussi.
C Sources d’information des aires motrices.
La principale source d’information est le cortex frontal (aire d’association) qui planifie les actions complexes. Le complexe frontal reçoit lui-même des informations des aires associatives, pariétales, …
Le cortex frontal va élaborer l’action après avoir intégré toutes ces informations et va commander l’activité des aires motrices, pré-motrices, supplémentaires.
 Les ordres d’exécution sont assurés par l’aire motrice primaire.
Les ordres d’exécution sont assurés par l’aire motrice primaire.
L’exécution du programme moteur est alors sous contrôle des ré-afférences sensorielles.
D Contrôle de l’exécution et de la programmation motrice.
1 Le cervelet.
Le cervelet est important dans la coordination du mouvement et du guidage, surtout grâce aux informations visuelles.
Le cervelet peut être divisé en trois parties :
- Le cérébrocervelet : il reçoit des afférences corticales qui font un relais au niveau du pont et croisent la ligne médiane.
- Le vestibulocervelet : il reçoit les afférences en provenance des vestibules de l’oreille interne.
- Le spinocervelet : il reçoit les afférences des propriocepteurs de la moelle épinière.
Dans le vestibule et le spinocervelet, les afférences sont ipsilatérales (pas de croisement).
Les efférences du cervelet sont issues des noyaux moteurs cérébelleux et se dirigent vers le thalamus. Le thalamus renvoie lui-même ces informations sur le cortex moteur et pré-moteur.  Il n’y a pas de projection directe du cervelet sur les motoneurones médullaires (de la moelle épinière). Le cervelet a donc accès aux projections cortico-spinales qui organisent les contractions coordonnées.
Il n’y a pas de projection directe du cervelet sur les motoneurones médullaires (de la moelle épinière). Le cervelet a donc accès aux projections cortico-spinales qui organisent les contractions coordonnées.
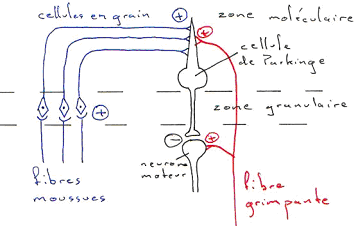
La cellule de Parkinge est la seule voie efférente du cortex cérébelleux. Ainsi, la fibre grimpante qui se connecte directement sur la cellule de Parkinge et qui laisse les informations sur les noyaux des motoneurones. Cette fibre provient d’un noyau du mésencéphale (l’olive inférieure) qui reçoit elle-même des informations du noyau rouge des voies extra-pyramidales.
La cellule de Parkinge reçoit des fibres parallèles dont les corps cellulaires sont les cellules en grain qui reçoivent elles-mêmes des informations venant des noyaux du pont de la moelle épinière et des vestibules par l’intermédiaire des fibres moussues.
Toutes les afférences sont excitatrices, sûrement glutamaergique. La seule efférence (cellule de Parkinge) est inhibitrice sur les noyaux moteurs cérébelleux.
Le cervelet reçoit des informations venant des cortex moteurs (pont) qui constituent une copie du programme moteur envoyé à la moelle épinière : c’est la copie d’efférence.
Il reçoit également des ré-afférences sensorielles qui vont renseigner à chaque instant sur l’exécution du mouvement en cours.
La confrontation de ces deux types d’informations permet de vérifier si le programme moteur est correctement exécuté.
Par un phénomène de dépression synaptique (à côté des cellules en grain), l’inhibition tonique exercée par la cellule de Parkinge peut être levée sur les noyaux moteurs.  Le noyau moteur sous la cellule de Parkinge peut être amené à corriger le mouvement.
Le noyau moteur sous la cellule de Parkinge peut être amené à corriger le mouvement.
Ce type de régulation a également été démontré dans les apprentissages moteurs.
 Il y a donc une confrontation des informations entre le cortex et les récepteurs sensoriels qui permet une modulation du programme moteur.
Il y a donc une confrontation des informations entre le cortex et les récepteurs sensoriels qui permet une modulation du programme moteur.
2 Les ganglions de la base.
Les ganglions de la base sont dans les hémisphères cérébraux, sous la couche corticale. Ils comportent :
- Le striatum ou néo-striatum = noyau caudé + putamen.
- En allant vers la ligne médiane, on trouve le globus palidus ou pallidum.
- Encore plus profondément, on atteint le noyau sous-thalamique ou corps de Luys.
Le globus palidus et noyau sous-thalamique appartiennent au diencéphale. Le striatum appartient, lui, au télencéphale. Ce sont les noyaux gris centraux ou ganglions de la base.
La substance noire (dans de mésencéphale) fait parti des noyaux gris centraux.
Cet ensemble joue un rôle déterminant dans l’initiation et l’arrêt des mouvements.
Les voies d’entrée des informations se font sur le striatum. La seule voie de sortie est constituée par la partie interne du globus palidus (= bulbe latéral + secteur interne).
Le noyau caudé reçoit des afférences d’aires corticales associatives et plurimodales. Il devrait intervenir dans le déclenchement d’actes moteurs complexes : dans les aspects cognitifs du mouvement (intention, signification).
Le putamen reçoit des afférences provenant d’aires sensorielles primaires. Il devrait traiter des informations en rapport avec le contexte sensoriel dans lequel le mouvement sera exécuté.
Le striatum reçoit d’importantes afférences dopaminergiques issues de la substance noire. Cette dernière reçoit en retour des projections du striatum.
On peut distinguer deux voies de sortie : directe et indirecte.
- Directe : elle se projette du striatum sur le globus palidus interne.
- Indirecte : cette voie établie un premier relais sur le globus palidus externe, qui, lui-même, se projette sur le noyau sous-thalamique qui renvoie l’information sur le globus palidus interne.
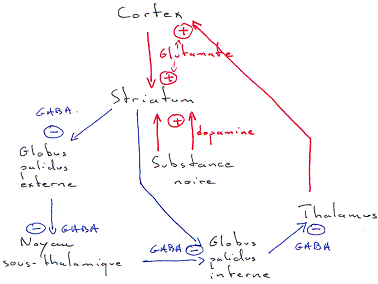
La voie directe faciliterait l’initiation en induisant la dés-inhibition tonique du thalamus. La voie indirecte entraînerait une inhibition tonique accrue sur ce thalamus.
 Les deux voies ont un effet opposé et interviendraient sur l’initiation et l’arrêt des mouvements.
Les deux voies ont un effet opposé et interviendraient sur l’initiation et l’arrêt des mouvements.
Les pathologies extra-pyramidales résultent de dérèglements de ces voies. Comme pathologies, on peut trouver :
- La maladie de Parkinson. C’est une maladie qui provoque l’hypokinésie et est caractérisée par des tremblements et une mauvaise initiation des mouvements. Cette maladie est due à la dégénérescence de voies dopaminergiques venant de la substance noire.  La voie directe est déficiente et le mouvement ne peut être déclenché. Les traitements sont : une ingestion de L-Dopa qui peut aider l’initiation et le contrôle des mouvements ; ou, une stimulation électrique du noyau sous-thalamique.
La voie directe est déficiente et le mouvement ne peut être déclenché. Les traitements sont : une ingestion de L-Dopa qui peut aider l’initiation et le contrôle des mouvements ; ou, une stimulation électrique du noyau sous-thalamique.
- La chorée de Huntington. Il y a spécifiquement une dégénérescence des neurones épineux du striatum qui se projettent sur le globus palidus externe. Il en résulte un disfonctionnement de la voie indirecte et notamment, une diminution des effets activateurs du noyau sous-thalamique sur le globus palidus interne. Ces dérèglements ont pour effets une très forte dés-inhibition sur le thalamus qui provoque des mouvements désordonnés brusques et sans signification qui se greffent sur des programmes moteurs normaux. La maladie est accompagnée de troubles du comportement, d’irritabilité puis de démence et enfin de mort. Dans cette pathologie, les mouvements sont possibles.
- Lors de syndromes moteurs pyramidaux, d’atteintes des cortex moteurs et des voies descendantes, il y a une incapacité à effectuer des mouvements. Les réflexes sont diminuer sauf le réflexe myotatique qui lui, est augmenté.
Neurobiologie cellulaire.
|
Cellules gliales du système nerveux périphérique :
|
|
Les cellules de Schwann.
|
|
|
Cellules gliales du système nerveux central :
|
| Macroglie : oligodendrocytes et astrocytes (de type I et II). |
Microglie. |
I Les cellules de Schwann.
Ces cellules produisent de la myéline (70% de lipides et 30% de protéines). Elles ne s’entourent qu’autour d’un axone : reconnaissance obligatoire. Parmi les protéines, on trouve la protéine P0 : c’est une protéine d’adhérence qui a un rôle dans la compaction de la myéline.
S’il y a une mutation sur P0, on peut voir la manifestation de maladie comme : la maladie de Charcot-Marie-Tooth ou le syndrome de Déjerine-Sottas.
En général, ces maladies provoquent des modifications de la vitesse de conduction sur l’axone. On assiste fréquemment a des anomalies sur les organes innervés (muscles,…) à amyotrophie.
Les relations neurones-glie peuvent avoir des conséquences favorables :
- Par exemple, les cellules de Schwann exercent un effet trophique sur les neurones.
- Dans un cas d’axotomie (où l’axone dégénère), les cellules de Schwann prolifèrent et expriment un récepteur à un facteur de croissance et synthétisent elles-mêmes un facteur de croissance (le Neuron Growing Factor) selon un gradient. L’axone repousse, attiré par la piste moléculaire du NGF.
II Les oligodendrocytes au niveau central.
Les oligodendrocytes sont les équivalents fonctionnels des cellules de Schwann. Le système d’enroulement est différent. Chacune de ces cellules peut s’entourer autour de plusieurs axones (jusqu’à 50).
Ces relations neurones-glie sont bidirectionnelles.
La multiplication des oligodendrocytes dépend de signaux envoyés par le neurone. Si ces signaux sont absents, les oligodendrocytes dégénèrent puis meurent par apoptose (mort programmée).
Les signaux neuronaux s’opposent à cette mort : l’activité des neurones permet de maintenir en vie ces oligodendrocytes.
Si l’on veut éliminer les oligodendrocytes sans tuer le neurone, on doit supprimer l’activité neuronale. Pour cela, on peut injecter du TTX au niveau du nerf optique. Effets :
- blocage des canaux Na Vdépendants,
- blocage de la formation des potentiels d’action.
Remarque : les oligodendrocytes possèdent des canaux ioniques.
III Les astrocytes.
Les astrocytes sont des cellules à aspect étoilé quand ils sont matures. Les deux types (I et II) n’ont rien à voir (origine différente et rôle différent).
« Maintenant nous savons qu'il existe une autre cellule précurseur appelée GRP (glial restricted precursor) qui donne naissance aux oligodendrocytes, les astrocytes I et II. Donc à ce jour on connaît deux types de cellules précurseurs (à suivre...) »
A Les astrocytes de type I.
Ils forment une barrière hémato-céphalique qui est composée d’eux et de cellules endothéliales. Les astrocytes I forment la glia limitans.
Les pieds astrocytaires forment une barrière autour des capillaires sanguins.
B Les astrocytes de type II.
Ce sont des cellules qui ont un contact intime avec les neurones de part leurs échanges. Les contacts ont lieu là où il y a de la place (nœud de Ranvier, corps cellulaire, terminaison).
Un astrocyte II peut avoir des échanges avec plusieurs neurones.
1 Fonctionnement.
Ces cellules modulent l’activité et la terminaison synaptique des neurones.
 Les astrocytes II ont un contrôle sur l’excitabilité (contrôle de l’équilibre ionique) et possèdent donc des canaux ioniques.
Les astrocytes II ont un contrôle sur l’excitabilité (contrôle de l’équilibre ionique) et possèdent donc des canaux ioniques.
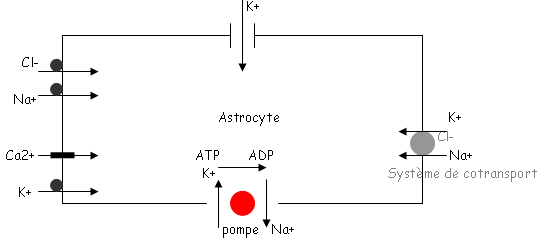
Si le K+ extracellulaire augmente, il peut entrer dans les astrocytes par des canaux passifs ou par des pompes (ATPases).
 Ces astrocytes permettent donc de contrôler l’état électrique du neurone. Au voisinage de plusieurs neurones, les astrocytes vont entraîner des mouvements calciques (
Ces astrocytes permettent donc de contrôler l’état électrique du neurone. Au voisinage de plusieurs neurones, les astrocytes vont entraîner des mouvements calciques ( vague calcique).
vague calcique).  Ces cellules exercent une synchronisation de l’activité synaptique.
Ces cellules exercent une synchronisation de l’activité synaptique.
2 La modulation de la transmission synaptique.
Les principaux neurotransmetteurs du système nerveux central sont ; le glutamate (action +) et le gaba (action -).
L’astrocyte est capable de capter ces deux neurotransmetteurs.
Si l’activité gabaergique est trop forte et si la captation (de gaba) est trop faible, il y a synthèse de glutamate à partir de gaba.
Ces deux molécules ont un précurseur commun : la glutamine.
Glutamine à glutamate (+NH3) à gaba.
Ceci est un système de contrôle à activité limitée.
3 Les interactions métaboliques.
La consommation d’énergie est très importante. La source d’énergie des astrocytes est le glucose (stocké sous forme de glycogène). Pourtant, ce n’est pas sous l’une de ces deux formes que l’énergie est donnée au neurone par la cellule gliale, mais sous la forme d’alanine. Il faut que le neurone se dépolarise pour que l’astrocyte libère la source d’énergie.
« Autre nouveauté, il semblerait que en plus de l'alanine, le lactate serait cédé par l'astrocyte au neurone pour qu'il soit transformé en pyruvate et entrer dans le cycle de krebs. »
IV La microglie.
Les cellules de la microglie sont des cellules particulières dont l’origine est éloignée des autres cellules gliales : ce sont des macrophages cérébraux.
On les trouve le plus souvent au moment de la naissance (pendant la formation des voies nerveuses, certains neurones dégénèrent) et à la mort d’un neurone ; sinon, ils sont en faible quantité : on parle alors de microglie résidente.
La microglie peut jouer un rôle dans des maladies comme l’infection par le virus du sida (cas où infection du système nerveux central) :
« Ce ne sont pas les porteurs du HIV qui provoquent des neuropathies, mais le HIV lui-même, en infectant la microglie, qui une fois infectée, va envoyer des signaux de mort cellulaire aux neurones et donc provoquer des neuropathies. »
Les macrophages passent la barrière et le virus se multiplie dans les cellules microgliales. La microglie envoie des signaux de prolifération aux astrocytes et des signaux de mort neuronal aux neurones ou à l’astrocyte (signaux de type TNF).
L’audition.
L’audition permet d’obtenir des renseignements sur le milieu extérieur grâce aux extérocepteurs de la cochlée (dans l’oreille interne).
I Le stimulus adéquat.
Le stimulus adéquat est le « son » : une vibration des molécules du milieu (air, liquide, solide) qui est formée d’une énergie mécanique.
Remarque : la lumière est une énergie électromagnétique.
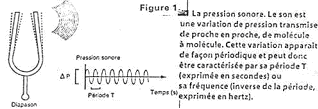
L’énergie est transmise de molécule en molécule avec une vitesse de 340m/s dans l’air, à 20°C. Le son est une variation de pression dans un milieu en fonction du temps.
A Vibrations sonores et intensité.
Les ondes sonores sont des variations de pression entre une pression élevée et une pression basse  C’est l’intensité ou l’amplitude de la pression sonore. Cette pression est généralement mesurée en Pa (pascal ou N.m-²). Toutefois, on utilise beaucoup plus souvent les décibels (échelle logarithmique), unité mise en place par Graham Bell.
C’est l’intensité ou l’amplitude de la pression sonore. Cette pression est généralement mesurée en Pa (pascal ou N.m-²). Toutefois, on utilise beaucoup plus souvent les décibels (échelle logarithmique), unité mise en place par Graham Bell.
Pression sonore = 20 x log(Pression mesurée/Pression de référence).
La pression de référence est une pression proche du seuil d’intensité absolu moyen du système auditif humain.
Ce seuil est testé pour une gamme de fréquence comprise entre 1000 et 4000Hz, soit, 2.10-5N.m-2. Un son de 2.10-2N.m-2 peut être exprimé en décibels de cette manière :
Son = 20 x log(2.10-2/2.10-5) = 60dB.
Cette échelle a été choisie pour que la sensation sonore auditive double quand l’intensité sonore augmente de 10dB.
B Vibration sonore et fréquence (F).
F = 1/T en Hertz.
Un son pur est constitué d’une seule fréquence mais il n’est n’existe par naturellement.
Un son musical peut-être décomposé en une fréquence fondamentale (fréquence la plus basse) et fréquences harmoniques ‘multiples de la fréquence fondamentale).
Un bruit blanc est un son où toutes les fréquences sont représentées à la même intensité.
II Caractéristiques de la sensibilité auditive.
L’Homme n’est pas sensible à toutes les vibration sonores, seulement les vibrations comprises entre 20Hz et 20KHz. C’est le spectre audible moyen de l’Homme.
Le chien a un spectre qui monte à 40KHz et celui de la chauve-souris va de 20KHz à 200KHz.
A Sensibilité à l’intensité de la pression sonore.
L’intensité seuil absolue se situe autour de 4dB pour l’Homme, pour une fréquence de 1KHz. Les seuils varient en fonction de la fréquence. L’oreille humaine possède une faible sensibilité pour les fréquences inférieures à 1KHz.
Les courbes équivalentes présentent la même intensité pour une variation de fréquence : ce sont des isophones (même sensation sonore).
Au-delà de 130dB, il y a sensation de douleur (c’est le seuil douloureux).
Un murmure : 10dB ; une conversation : 40dB ; une dispute : 70dB ; un coup de tonnerre : 120dB.
B Sensibilité à la fréquence de la pression sonore.
Le seuil relatif : intensité seuil différentielle qui est égale à 1dB  variation d’intensité minimale pour qu’un sujet sente une modification. Le seuil différentiel est faible : à 1000Hz, ce seuil est de 3Hz.
variation d’intensité minimale pour qu’un sujet sente une modification. Le seuil différentiel est faible : à 1000Hz, ce seuil est de 3Hz.
C Sensibilité à la localisation du son.
La sensibilité à la localisation du son permet l’orientation. Cette localisation est possible grâce à la différence de sensation qui atteint les deux oreilles.
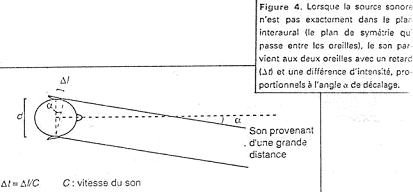
Si le son est sur l’axe interaural, il arrive en même temps aux deux oreilles avec la même intensité. S’il est au-delà de cet axe, il atteint les oreilles de manière asynchrone et l’intensité sera différente. Le décalage dans le temps permet de localiser l’émetteur dans l’espace.
La discrimination de sons est possible, avec au minimum, un délais entre les deux oreilles de 30µs ; soit, 3° au-delà de l’axe interaural.
Le mode de localisation dépend de la gamme de fréquence. Pour des fréquences inférieures à 1,4KHz, le système nerveux trouve la localisation par un simple déphasage entre les oreilles. Si la fréquence est supérieure à 1,4KHz, le système nerveux trouve la localisation par la différence d’intensité du son qui arrive aux oreilles.
III La transformation de l’énergie vibratoire en stimulus efficace.
A Anatomie fonctionnelle de l’oreille.
L’oreille comporte trois parties : l’oreille externe, l’oreille moyenne et l’oreille interne.
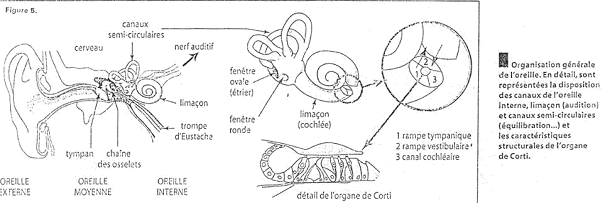
1 L’oreille externe.
Chez l’homme, l’oreille externe sert a canaliser les sons vers l’oreille moyenne. Chez les autres mammifères, cette oreille peut être orientée pour faciliter la localisation des sons.
L’oreille externe et l’oreille moyenne sont séparées par une membrane fine ; le tympan qui va vibrer à cause des vibrations sonores.
2 L’oreille moyenne.
C’est une cavité remplie d’air qui constitue la « caisse » du tympan. Elle communique avec le pharynx par l’intermédiaire de la trompe d’Eustache (=soupape). Dans la cavité, on trouve une chaîne d’osselets : le premier, collé au tympan, est le marteau ; le second est l’enclume et le troisième est l’étrier qui communique avec l’oreille interne. Ce dernier est accolé à une structure qui limite l’oreille interne : la fenêtre ovale.
Les osselets sont disposés en levier, ce qui permet d’obtenir un gain énergétique dans la transformation de l’onde sonore. La surface du tympan est quinze fois plus grande que la fenêtre ovale, ce qui entraîne un gain de 20dB.
Il existe un système de protection contre les sons trop intenses : les muscles situés entre les os et le marteau et ceux placés entre les os et l’enclume, quand un son est trop fort, vont se contracter et réduire la vibration des osselets afin de diminuer la transmission sonore vers l’oreille interne (protection de 40dB).
3 L’oreille interne.
C’est ici que sont localisés les récepteurs sensoriels. On les trouve au niveau de la cochlée (ou limaçon). La cochlée est constituée de trois canaux qui s’enroulent sur 2,5 tours (enroulement hélicoïdal). Deux de ces canaux sont appelés « rampes ».
On trouve donc :
- la rampe vestibulaire,
- la rampe tympanique,
- le canal cochléaire au centre.
Les rampes tympanique et cochléaire communiquent entre elles à l’apex de la cochlée : hélicotrème. Elles sont remplies d’un liquide, la périlymphe ( liquide extracellulaire, riche en sodium).
liquide extracellulaire, riche en sodium).
Le canal cochléaire est fermé, rempli d’endolymphe, riche en potassium.
Entre la rampe tympanique et le canal cochléaire se trouve la membrane basilaire. Tout le long de cette membrane se trouve le véritable organe sensoriel : l’organe de Corti qui contient les récepteurs).
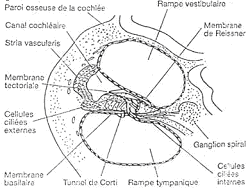
Les récepteurs sont des cellules ciliées, en rangées. De part et d’autre de l’étrier de Corti, on trois rangées de cellules ciliées internes et une rangée de cellules ciliées externes. Ces cellules sont fixées dans une membrane gélatineuse : la membrane tectoriale.
Les cils des cellules ciliées sont baignés par l’endolymphe alors que la partie basse baigne dans de la périlymphe : il se crée alors une différence de potentiel de 80mV (endolymphe > 0 par rapport à la périlymphe). Le milieu interne des cellules ciliées présente une différence de potentiel de –90mV avec la périlymphe et –170mV avec l’endolymphe.
B Propagation sonore des vibrations vers les récepteurs.
Ces vibrations sonores transmises au tympan sont ensuite transmises aux osselets. Quand les vibrations sont à la fenêtre ovale, elles atteignent la périlymphe vestibulaire, puis, tympanique, jusqu’à la fenêtre ronde. Le passage d’un milieu aérien à un milieu liquide provoque une atténuation des sons de 30dB.
Les mouvements des liquides, au niveau des rampes, provoquent la déformation de la membrane basilaire par ondulation. Cette membrane est fléchie d’un côté ou de l’autre.
Comme la membrane tectoriale est fixe, le mouvement relatif entre cette membrane et la membrane basilaire amène à une inclinaison des cils qui codent cette vibration sonore.
Dès 1920, Von Beckésie a observé ces mouvements de membrane basilaire dont l’amplitude maximale de vibration de cette membrane est différente selon la fréquence : la partie basale a un maximum de vibration pour les fréquences élevées alors que la partie près de l’apex a son maximum de vibration pour les basses fréquences. On fait, on trouve que la membrane basilaire a une structure différente selon l’endroit où l’on se trouve.

On peut en déduire que les cellules ciliées n’ont pas de rôle particulier : c’est la membrane basilaire qui permet la vibration en fonction de la fréquence. Les cellules ciliées ont une structure électromécanique qui leur permet de rentrer en vibration selon la fréquence en fonction de leur constitution.
IV Codage de l’information dans les cellules ciliées.
A Organisation fonctionnelle des récepteurs.
Ces cellules sont ciliées (les cils sont appelés des stéréocils) et situées de part et d’autre des piliers de Corti (3 rangées d’un côté –externes- et 1 rangée de l’autre –internes-). A leur base, les cellules ciliées sont en connexion avec une fibre nerveuse afférente (récepteur de type 2). Cette connexion diffère entre les cellules ciliées internes et les externes.
Les fibres afférentes sensorielles ont leur corps cellulaire dans le ganglion spinal et les axones constituent en parti le nerf auditif. Les fibres afférentes font un premier relais au niveau du bulbe rachidien. 90% des fibres afférentes font contact avec les cellules ciliées internes (la rangée unique) et les 10% restant font contact avec les cellules ciliées externes.
On trouve environ 10 fibres afférentes en contact avec une cellule interne  divergence de l’information. Donc, pour une fibre afférente, il n’y a contact qu’avec une seule cellule réceptrice.
divergence de l’information. Donc, pour une fibre afférente, il n’y a contact qu’avec une seule cellule réceptrice.
Au contraire, une cellule afférente va faire contact avec plusieurs cellules externes : c’est une convergence des informations.
 On en déduit que ce sont les cellules internes qui codent l’information sonore.
On en déduit que ce sont les cellules internes qui codent l’information sonore.
Les récepteurs reçoivent des informations du système nerveux central pour modifier la sensibilité.
B Mécanisme de transduction.
Le potentiel de membrane varie en fonction du mouvement des cils. S’ils sont inclinés dans un sens, on a une dépolarisation de la membrane de la cellule qui peut entraîner un potentiel de récepteur. Dans le cas d’un mouvement en sens inverse des mêmes cils, il y aura hyperpolarisation de la membrane de la même cellule.
L’inclinaison des cils est un phénomène rapide : ces dépolarisations sont dues à un phénomène mécanique.
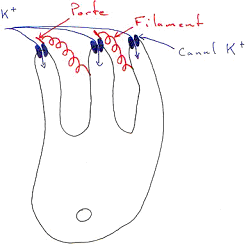
Quand les cils sont verticaux, les canaux sont légèrement ouverts à cause du potentiel de l’endolymphe (-170mV). Quand les cils s’inclinent, ici, vers la gauche, il y a ouverture des canaux K+ car la porte de chaque canal, qui est reliée à un filament élastique, s’ouvre plus (elle est reliée au cil précédent). Il va alors se créer un potentiel membranaire (dépolarisation).
Lors d’un mouvement vers la droite, il y a fermeture des canaux et donc, hyperpolarisation. Ces cellules sont connectées aux fibres afférentes.
V Traitement central de l’information.
Quand une cellule ciliée est dépolarisée, elle libère des neurotransmetteurs activateurs qui vont propager un PPSE puis, donner un potentiel d'action. Les mouvements vibratoires se traduisent par des bouffées de potentiels d'action.
ATraitement au niveau des fibres afférentes.
Un récepteur (fibre afférente) répond à des fréquences particulières (hautes ou basses). Quand on enregistre une de ces fibres, on mesure la fréquence de décharge de potentiels d'action maximale pour une fréquence de vibration spécifique. La même fibre répond pour des fréquences proches de sa fréquence spécifique mais moins fortement. On observe donc :
- Une fréquence spécifique caractéristique.
- Une courbe d’accord pour la gamme de réponse (équivalent du champ récepteur dans la vision).
Le codage des fréquences dépend de la gamme de fréquence :
- Si F<500Hz : la cellule afférente répond à chaque vibration : c’est un codage point par point.
- Si 500Hz<F<4KHz : comme un neurone décharge au maximum à 500Hz, il ne peut pas coder seul. Le système de codage est donc différent. Il y a corrélation entre la stimulation et la réponse (1 potentiel d'action pour x cycle(s) ). Comme la somme de plusieurs neurones codant pour cette fréquence comprise entre 500 et 4000Hz.
- Si F>4KHz : il n’y a plus de corrélation. Il semble que ce soit la tonotopie qui permette le codage.
Le premier relais bulbaire est constitué des noyaux cochléaires. On trouve de nombreux relais :
- 2nd relais : olives supérieures.
- 3ème relais : lemniculus.
- 4ème relais : homonculus.
- 5ème relais : colliculus inférieurs.
Le relais sur le thalamus se fait au niveau des corps genouillés médians.
Au niveau de chaque cortex auditif, on a une information relativement complète venant des deux oreilles (la lésion d’un cortex n’entraîne pas de problème de surdité si l’autre est intact).
Tous les relais gardent une organisation somatotopique.
B Traitement des paramètres.
L’information devient de plus en plus complexe. Les courbes d’accord sont retrouvées mais s’amenuisent à cause de l’inhibition latérale.
Dans le cortex, on observe une organisation en colonnes :
- Colonnes de fréquence (même fréquence).
- Colonnes de neurones répondant à la stimulation des deux oreilles.
- Colonnes de neurones répondant à la stimulation d’une seule oreille (équivalent à la dominance oculaire).
On trouve des aires qui correspondent aux sons complexes (langage) et à la compréhension. L’air de Broca, dans le cortex moteur (frontal), est aussi bien développée.
C Localisation des sons.
Pour un son où F<1400Hz, seul le déphasage entre les deux oreilles est utile pour la localisation. Le traitement est réalisé dès l’olive supérieure (dite médiane).
D L’intensité des sons.
L’intensité des sons est traitée au niveau de l’olive supérieure latérale.